营养型酵母细胞破壁方法的研究
2018-05-16康洁
康 洁
(商丘师范学院 生物与食品学院,河南 商丘 476000)
啤酒酵母细胞营养物质十分丰富,除含有大量的蛋白质外,还具有维生素B和丰富的钙、铁、铬等微量元素[1,2,3],还含有人体所必需的8种氨基酸[4],所以,酵母细胞一直被作为食品添加剂和饲料添加剂,加入食品、饲料里,饮料、酒类和调味品生产也常常使用[5,6,7].然而,酵母细胞壁不易破裂,细胞内容物不易被充分吸收利用[8],因此影响了啤酒酵母深度开发和利用.目前,国内研究酵母细胞破壁的报道也有[9,10],但实用效果不是太好,我们利用食用的安琪酵母为材料,设计了4种破壁方法的正交实验,并进行统计分析和破壁率比较,以期找到能在食品开发生产中使用的酵母细胞的破壁方法.
1 材料与方法
1.1 材料试剂与设备
市兽安琪酵母,马铃薯产于商丘荷兰土豆品种,小牛血清,上海易佰聚经贸有限公司;考马斯亮蓝G-250、葡萄糖、琼脂、乳酸、美蓝染色液、氯化钠、氢氧化钠等购于天津基准化学试剂有限公司.
超声波细胞破碎机,上海和呈仪器制造有限公司;OLYMPUS相差显微镜;UV2003紫外可见分光光度计,上海精密仪器仪表有限公司;无菌操作台、高压蒸汽灭菌锅,常州国华电器有限公司;分光光度计,上海精密仪器仪表有限公司.
1.2 方法
1.2.1 酵母细胞复苏培养及扩大培养
称取0.2 g酵母粉,于无菌环境下加入适量无菌水,混匀后,参考文献[11,12]涂布于马铃薯葡萄糖固体培养基.将接种后的培养基置于28 ℃的恒温培养箱中,培养72 h,至菌斑生成.
在无菌操作台上挑取啤酒酵母菌斑少许,转至马铃薯葡萄糖乳酸培养液中[13],并在28 ℃下扩大培养20 h,收集细胞,离心,保存备用.
1.2.2 细胞溶出蛋白质含量的测定
紫外光分光光度法测定蛋白.
参考文献[14]制作小牛血清标准曲线:取11支试管,分别加入0、2.5 μL、5 μL、7.5 μL、10 μL、12.5 μL、15 μL、17.5 μL、20 μL、22.5 μL、25 μL的1 mg/mL BSA溶液,再用0.2 mol/L PBS补充到20 μL.最后分别加入1 mL考马斯亮兰G250试剂,在旋涡混合器上混合;2 min后,测定各样品在595 nm处的光吸收值;以血清蛋白含量为横坐标,OD值为纵坐标,绘制标准曲线,得线性回归方程y=0.0136x+0.3459(R2=0.9911).
吸取1 mL酵母细胞破壁后的上清液1 mL,按上述方法测蛋白含量,重复3次取平均值,折算破壁率.
1.2.3 酵母细胞破壁方法
将收集的酵母细胞与乙酸-乙酸钠(pH4.7)混合制成200个/mL浓度的酵母细胞悬液,备用.
1.2.3.1 氯化钠破壁
参考文献[15],结合本实验室特点,将氯化钠配置成3种浓度,如表1,取10 mL酵母细胞悬液,加入等体积的3种氯化钠溶液,混合,设置3种破壁时间和三种温度条件,进行正交实验.对每组实验结果进行台盼蓝染色和革兰氏染色,显微镜观察、计数、拍照,计算破壁率,同时按照1.2.3方法测破壁液的蛋白质含量.
表1 氯化钠破壁正交实验表
Table1 orthogonal test table of sodium chloride
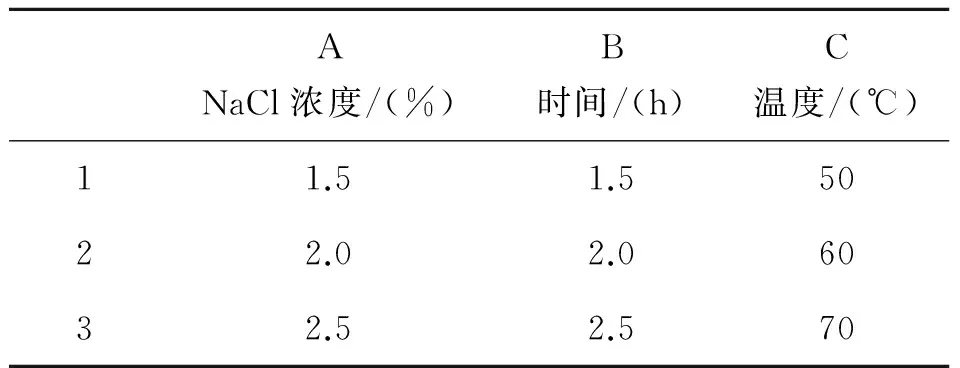
ANaCl浓度/(%)B时间/(h)C温度/(℃)11.51.55022.02.06032.52.570
表2 氢氧化钠破壁正交实验表
Table2 orthogonal test table of sodium hydroxide

ANaOH浓度/(%)B时间/(h)C温度/(℃)13.02.07024.52.58034.03.090
显微镜观察法检测,吸取少许破壁后的酵母细胞混合液于载玻片,用台盼蓝染液染色,破壁的酵母细胞则被染上蓝色,没有破壁的细胞不能被染上颜色.革兰氏染色法检测,吸取少许破壁后的酵母细胞混合液于载玻片,用革兰氏染色,未破壁细胞为紫色,破壁的细胞成红色.
1.2.3.2 氢氧化钠破壁
参考文献[16]将氢氧化钠配置成三种浓度,如表2,取10 mL酵母细胞悬液,加入等体积的3种氢氧化钠溶液,混合,设置3种破壁时间和3种温度条件,进行正交实验.对每组实验结果进行台盼蓝染色和革兰氏染色,显微镜观察、计数、拍照,计算破壁率和破壁液蛋白质含量,方法同1.2.3.1.
1.2.3.3 超声波破壁
取10 mL的酵母细胞悬液于小容器中,再放置于超声波细胞破碎机中,破壁.破壁条件设置如表3,进行正交实验.对每组实验结果进行台盼蓝染色和革兰氏染色,显微镜观察、计数、拍照,并计算破壁率和破壁液蛋白质含量,方法同1.2.3.1.
表3 超声波破壁正交实验表
Table3 ultrasonic broken wall orthogonal experiment table

A间歇时间/(s)B连续工作次数/(次)C功率/(W)110105021515603202070
表4 反复冻融法破壁正交实验表
Table4 orthogonal test table of repeated freeze-thaw broken wall

A融化温度/(℃)B融化时间/(h)C冷冻时间/(h)D冻融次数/(次)1700.51.522801.02.033901.52.54
1.2.3.4 反复冻融法破壁
取10 mL的酵母细胞悬液于小试管,中间停顿条件全部保持一致,并反复放置冰柜与温度水浴锅之间冻融,冷冻温度统一为-20 ℃,恒温水域锅温度设定为3个梯度,如表4,进行四因素三水平实验.对每组实验结果进行台盼蓝染色和革兰氏染色,显微镜观察、计数、拍照,并计算破壁率和破壁液蛋白质含量,方法同1.2.3.1.
1.2.3.5 两种方法混合破壁
以破壁率及溶出蛋白为标准,从1.2.3.1、1.2.3.2、1.2.3.3、1.2.3.4方法中优化出最佳条件组合,并将其中两种方法组合一起为一个实验,双法处理酵母细胞,每个实验重复3次,计算破壁液溶出蛋白量,Excel整理分析.
2 结果与分析
2.1 氯化钠法对酵母细胞的破壁

表5 氯化钠破壁正交试验结果表

图1 显微镜下看到的破壁细胞(放大1000倍) Fig1 The broken cell seen under the microscope 注:a台盼蓝染色;b革兰氏染色 Becareful:a Trypan blue staining;b Gram staining
图1a和图1b分别是酵母细胞经1.5%氯化钠在60 ℃恒温水浴锅内破壁后,经台盼蓝染色和革兰氏染色的效果图.经台盼蓝染色,破壁的酵母细胞被染上蓝色,没有破壁的细胞不能被染上颜色;经革兰氏染色,未破壁细胞为紫色,破壁的细胞成红色.从图1可以看出,在A1B2C2组合条件下,二者染色结果一致,说明细胞已破壁死亡.
2.2 氢氧化钠法对酵母细胞的破壁


表6 氢氧化钠破壁正交试验结果表
2.3 超声波法对酵母细胞的破壁
根据表3的超声波破壁酵母细胞的正交实验,通过染色、观察、计数、蛋白测量计算破壁率,得出结果见表7.

表7 超声波破壁正交试验结果表

续表7

2.4 反复冻融法对酵母细胞的破壁
根据表4的反复冻融法破壁酵母细胞的正交实验,通过染色、观察、计数、计算破壁率,得出结果如表8.

表8 反复冻融法正交试验结果表

2.5 4种破壁方法的比较
将4种酵母细胞破壁方法的破壁率结果进行整理,并绘制成折线图2.从图2看出,超声波方法对酵母细胞的破壁率最高值94.13%,也是4种方法中破壁率最高的,但曲线波动较大,说明超声波条件的选择比较灵敏,对结果影响明显,操作中要注意把握设定条件.由图2还可以看出,反复冻融破壁率最大值虽次于超声波,但曲线波动较小,说明不同冻融条件破壁的效果差异不大,操作中对破壁条件相对比较容易掌控.
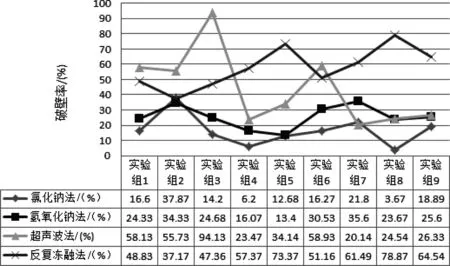
图2 4种方法破壁效果比较 Fig2 Comparison of wall breaking effects of four methods
2.6 混合法对酵母细胞的破壁效果
由于超声波法破壁率最高,选择超声波A3B1C3条件,即超声波功率在70 W、连续工作10次、间歇时间20 s,分别与氯化钠、氢氧化钠和反复冻融法组合成双破壁法,计算破壁率,结果如表9.

表9 混合法破壁结果
表9显示,3种混合法最后的破壁率无显著差异(P>0.05),但超声波与氢氧化钠混合的破壁率与氯化钠混合的破壁率之间有差异(0.01 酵母细胞营养价值丰富,但是其细胞壁成分主要为β-葡聚糖和甘露聚糖[17],通用的果胶酶和纤维素酶酶解破壁法往往效果不好,导致细胞营养不能充分利用.我们采用氯化钠破壁、氢氧化钠破壁、超声波破壁、反复冻融法破壁4种方法,经比较超声波破壁法效果做好,在设定功率70 W、连续工作10次、间歇时间20 s条件下酵母细胞的破壁率可以达到94.13%,而经过超声波与氯化钠破壁、氢氧化钠破壁、反复冻融破壁分别结合,进行混合破壁后,破壁率不比单独的超声波高,3组混合的破壁率没有显著差异(P>0.05),这说明超声波破壁可以破坏酵母细胞壁的大分子结构,而几种化学物质对酵母细胞壁的分子结构破坏不大.除超声破外,反复冻融对酵母细胞壁结构也明显的影响,在融化温度90 ℃、时间1 h然后在-20 ℃条件下冷冻1.5 h,反复冻融4次,可以达到78.87%的破壁率. 酵母在食品加工、发酵饮料、做酒、酸乳、醤醋方面有很大用途,而能破壁的酵母细胞也可以应用在食品加工行业作为添加剂,以期给食品增加许多风味,也可以应用在化妆品行业和饲料加工业[18],近几年酵母细胞因其含有大量的VB和矿物质微量元素也被应用在了保健品或营养强化剂[19]以及工程改造酵母菌株[20].因此,我们的研究成果对酵母细胞的充分利用,开拓应用空间以及对功能食品的开发生产都具有深远意义. 参考文献: [1]浦福良.干燥啤酒酵母的营养价值及其新用途[J].食品研究与开发,1986(3):66-70. [2]贾艳萍,赵军.啤酒酵母的营养与综合利用[J],啤酒科技,2006(7):76-82. [3]丁宏伟,王春玲,丁红洁.啤酒酵母泥中的功能性成分及其应用前景[J].齐鲁师范学院学报,2013,28(03):133-136. [4]何志平,陈廷登,唐振兴.啤酒酵母的营养和风味价值[J].酿酒科技,2003,9(02):70-73. [5]白晓婷.酵母类产品在饲料中的研究与应用[J].中国饲料,2005,004(02):18-23. [6]沈波,邬本成,王改琴.啤酒酵母的营养价值及其在饲料中的应用[J].猪业科学,2014(9):56-61. [7]李大鹏.啤酒酵母营养饮料的研制[J].粮食与食品工业,2005(2):201-211. [8]Anna Czech,Aleksandra Smolczyk,Katarzyna Ognik,et.Nutritional Value of Yarrowia Lipolytica Yeast and its Effect on Growth Performance Indicators n Piglets[J].De Gruyter,2016,16(04):1091-1100. [9]张莉弘,高城.废啤酒酵母细胞超声波破壁工艺优化[J].啤酒科技,2014,236(4):65-67. [10]李艳,阮南,杨翠竹.不同破壁方法对提取废啤酒酵母RNA的影响[J].食品科学,2008(3):89-95. [11]丁浩,张帆,曹研,等.马铃薯葡萄糖培养基制作方法的改进[J].中国酿造,2012,31(4):141-144. [12]王丽敏,李军,胡小松.苹果原料中酵母菌的分离鉴定[A].中国农业大学学报,2004,9(4):14-17. [13]沈萍,陈向东.微生物学[M].北京:高等教育出版社,2006,230-239. [14]张莉弘,吴琼.几种废啤酒酵母细胞破壁方法的比较[J].长春大学学报,2014,24(4):464-467. [15]杨翠竹,李艳,阮南,等.酵母细胞破壁技术研究与应用进展[J].食品科技,2006,31(07):138-142. [16]徐那,秦丹,蔡水淋,等.几种不同破壁方法对提取酵母内容物的影响[J].农产品加工,2015,29(03):101-106. [17]徐智鹏,胡骏鹏,周小辉.酵母细胞壁多糖的作用及其成分检测方法[J].中国饲料,2015(3):341-351. [18]陈雄,黄煌,胡成远,等.酵母浸出物的营养特性及其在微生物发酵中的应用[J].食品科技,2009,34(12):253-257. [19]吴振,江建梅,舒媛,等.啤酒酵母及其衍生品的应用研究进展[J].中国酿造,2014,33(10):10-13. [20]MaríaLópez-Malo;EstéfaniGarcía-Rios;BrunoMelgar;et.Evolutionary engineering of a wine yeast strain revealed a key role of inositol and mannoprotein metabolism during low-temperature fermentation[J].BMC Genomics,2015,16(1):335-351.3 讨 论
