微波辅助提取红菇多糖的工艺条件优化
2018-05-16张媛媛解立斌田洪伟王广翰
张 彬 ,王 宇 ,张媛媛 ,解立斌 ,田洪伟 ,张 进,王广翰
(石家庄学院 a.人事处;b.化工学院,河北 石家庄 050035)
0 引言
红蘑,铆钉菇科几种野生红色食用菌的统称,在真菌分类上属于担子菌亚门层菌纲、伞菌目、铆钉菇科、铆钉菇属.该菌是针叶树木重要的外生菌根菌,目前在承德坝上的深山中、燕山及青龙深山中以及辽西凌源地区山野中生长,都是当地的山民人工采集,然后晾干,外观通体呈肉色,故称之为肉蘑.宋斌等[1-3]研究发现,红菇中含有丰富的蛋白质、碳水化合物、氨基酸以及人体必须的各种微量元素.其中红菇多糖具有降低胆固醇、治疗失血性贫血、提高机体免疫力、抗炎、抗癌、增强血管收缩等功效[4-6].目前,多糖提取方法主要有溶剂浸提法、酶法、超声辅助提取法、微波提取法以及超临界流体萃取法等.微波提取法不论在节能、高效,还是在操作方面都具有一定优越性[7].苏晨曦等[8]用微波辅助提取法通过响应面分析从香菇中提取香菇多糖,多糖得率为6.46%.李娅丽[9]利用微波辅助提取法提取人参多糖,提取率达23.32%.这些研究表明微波提取法的优势.
以河北省承德市某地区生长的野生红菇为原料,采用微波辅助提取红菇中的多糖,通过采用苯酚-硫酸法进行测定[10-12],并采用正交试验对提取工艺进行了优化研究,希望为发展绿色生态产业、提高自然资源利用率提供一定理论依据.
1 材料和方法
1.1 材料与试剂
红菇(河北省承德市)、无水乙醇(天津市恒兴化学试剂公司)、苯酚(天津市永大化学试剂公司)、浓硫酸分析纯(天津市永大化学试剂公司)、葡萄糖分析纯(天津市永大化学试剂公司).
1.2 仪器与设备
微波化学反应器(上海远怀化工科技有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);HCP-100型粉碎机(浙江省永康市金穗机械制造厂);电热水浴锅(天津市泰斯特仪器有限公司);多用真空泵SB-Ⅲ型(南京予凯仪器设备有限公司);紫外可见分光光度计(上海仪电分析仪器有限公司).
1.3 实验方法
1.3.1 多糖含量测定方法
1.3.1.1 葡萄糖标准曲线的绘制
准确称取干燥至恒重的葡萄糖标准品置于容量瓶中,加蒸馏水溶解并稀释至刻度,配制成1.0 mg/mL的标准溶液,然后分别移取0.2,0.6,1.0,1.4,1.8 mL标准溶液于具塞比色试管中,加入蒸馏水补足至2 mL.按照苯酚-硫酸法[10]的相应条件下处理后,于491 nm测定其吸光度值,以测得的吸光度为纵坐标,以葡萄糖的浓度为横坐标,绘制标准曲线.
1.3.1.2 多糖得率的计算
在具塞比色管中吸取1 mL红菇多糖样品液,加入蒸馏水1 mL,补足至2 mL.按照苯酚-硫酸法的最佳条件进行处理,测吸光度.然后按式(1)计算红菇多糖得率:

式中W表示红菇多糖样品质量(单位:mg),f表示换算因子,C表示试样中葡萄糖的质量浓度(单位:mg/mL),D表示红菇多糖的稀释倍数.
1.3.2 红菇多糖微波提取流程
将红菇烘干粉碎,称取一定量的红菇粉,按1∶30的比例加入蒸馏水,60℃条件下进行微波处理,热水浸提,抽滤,旋转蒸发、浓缩,得到多糖提取液.
1.3.3 微波法提取红菇多糖的工艺条件优化
1.3.3.1 提取工艺单因素条件试验
固定其他实验条件,分别对料液比、微波温度、微波时间以及浸提时间进行单因素试验.
1.3.3.2 正交试验设计
根据单因素试验结果,采用正交试验设计模型,选取料液比、微波温度、微波时间作为自变量,以红菇多糖提取率为响应值,设计三因素三水平的正交试验,见表1.

表1 正交设计因素与水平表
2 结果与分析
2.1 葡萄糖标准曲线的绘制
以葡萄糖的浓度为横坐标,以吸光度A为纵坐标得到葡萄糖标准曲线,见图1,得回归方程y=0.823x+0.020 5,R2=0.999 5,表明该标准曲线的线性关系良好.

图1 葡萄糖标准曲线
2.2 单因素试验结果
2.2.1 料液比的单因素试验
准确称取 5 g 红菇粉,分别按照液料比 1∶10,1∶20,1∶30,1∶40,1∶50 加入蒸馏水,在微波温度 60 ℃的条件下处理300 s后,80℃热水提取2 h,然后按照苯酚-硫酸法测定吸光度值,并计算多糖得率,实验结果见图2.从图2可知,随着料液比的增大,红菇多糖的得率也在增大.在料液比为1∶30时,红菇多糖的得率到达了最大值,之后趋于平缓.
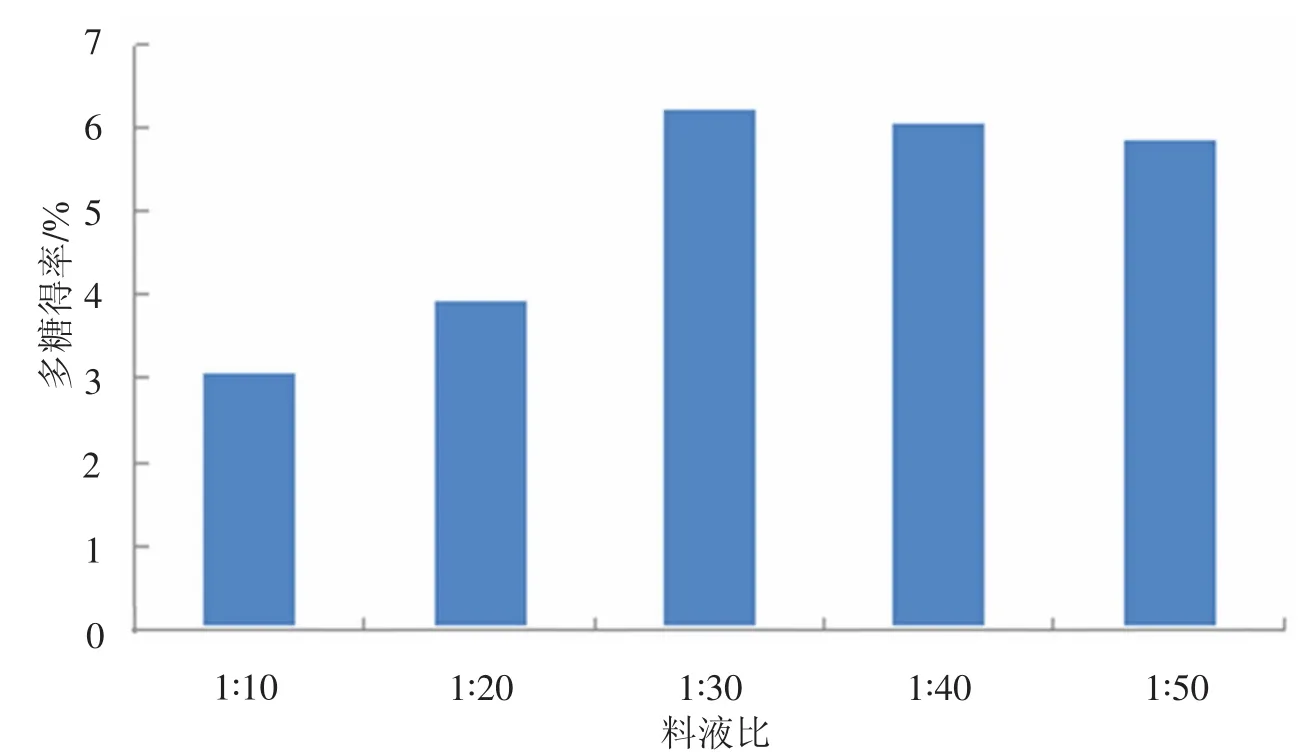
图2 不同料液比对多糖的率的影响
2.2.2 微波温度单因素试验
准确称取5 g红菇粉,按照1∶30的液料比加入蒸馏水,分别在微波温度30,40,50,60,70℃条件下处理300 s后,80℃热水提取2 h,然后按照苯酚-硫酸法测定吸光度值,并计算多糖得率,实验结果见图3.由图3可知,红菇多糖的得率在微波温度为60℃之前呈现上升趋势,在60℃之后开始下降,出现这种情况的原因可能是细胞内的微波热效应过快,从而破坏了多糖的结构.所以微波温度以60℃左右为宜.

图3 不同微波温度对多糖得率的影响
2.2.3 微波时间单因素试验
准确称取5 g红菇粉,按照1∶30的液料比加入蒸馏水,在温度为60℃的条件下,微波处理时间分别为100,200,300,400,500 s后,80℃热水提取2 h,然后按照苯酚-硫酸法测定吸光度值并计算多糖得率,实验结果见图4.从图4可以看出,红菇多糖的得率随微波时间的增多而增大,但是在微波时间300 s后,红菇多糖得率开始降低.红菇多糖得率降低的原因可能是在微波的长时间作用下破坏了多糖结构,使红菇多糖结构出现了降解.

图4 不同微波时间对多糖得率的影响
2.2.4 浸提时间的单因素实验
准确称取5 g红菇粉,按照1∶30的液料比加入蒸馏水,在微波温度为60℃的条件下,处理300 s后,80℃热水分别提取1,1.5,2,2.5,3 h,然后按照苯酚-硫酸法测定吸光度值并计算多糖得率,实验结果见图5.由图5可以看出,红菇多糖的得率在浸提时间为2 h之前有较为明显的增大趋势,而在2 h之后,趋势开始变得平缓,综合提取效率等因素考虑,确定浸提时间为2 h.
2.3 正交试验
以红菇多糖得率作为评价依据,在单因素试验的基础上,选料液比、微波温度、微波时间3个因素进行正交试验,正交试验结果见表2.根据表2中的极差R值,可以得出影响红菇多糖得率的因素的大小依次为料液比>微波时间>微波温度.从正交试验中得出,微波辅助提取红菇多糖的最佳工艺条件为料液比1∶40,微波时间400 s,微波温度60℃.
2.4 验证试验
称取5 g红菇粉,按照最佳提取条件进行提取,重复进行3次试验.验证试验结果见表3.从表3可以看出,在此条件下,红菇多糖平均得率为6.28%,确为最佳条件,工艺条件稳定.
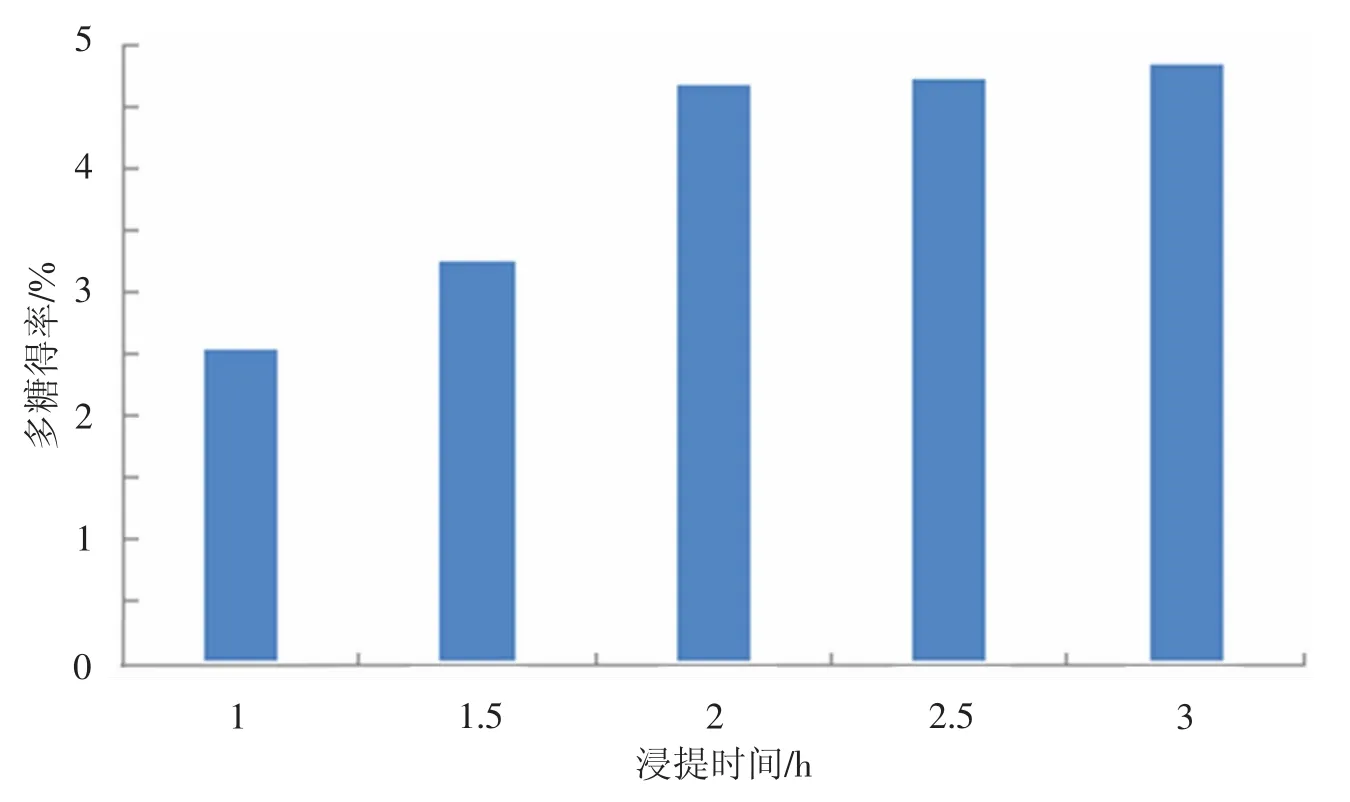
图5 不同浸提时间对多糖得率的影响
3 结论
将微波提取工艺运用到红菇多糖的提取方法中,并对各个因素进行了单因素试验研究,最后通过正交试验得到微波辅助提取红菇多糖的最佳工艺条件是:料液比为1:40,微波时间为400 s,微波温度设定60℃,浸提时间为2 h,在此条件下,红菇多糖得率达到6.28%,且工艺条件稳定.
参考文献:
[1]宋斌,李泰辉,吴兴亮,等.中国红菇属种类及其分布[J].菌物研究,2007,5(1):20-42.

表2 正交试验结果

表3 验证试验结果
[2]孙灵慧,钱珍,刘晓宇.白灵菇和红椎菌的成分分析研究[J].食品科技,2009,34(11):101-104.
[3]殷建忠,周玲仙.云南四种红菇类野生食用菌营养成分分析及评价[J].食品研究与开发,2008,29(27):133-136.
[4]王青云,石木标.中国红菇研究现状与展望[J].中国食用菌,2004,23(4):10-12.
[5]邱龙新.正红菇子实体多糖的提取技术及抗癌活性研究[J].中国食用菌,2004,23(6):48-50.
[6]陈旭健,甘耀坤,吴慧慧,等.红菇子实体对小鼠血糖、血脂的影响[J].食品科技,2008,33(4):237-239.
[7]尹艳,髙文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007,(2):248-250.
[8]苏晨曦,陈文强,彭浩,等.微波辅助提取香菇多糖工艺的响应面优化[J].西北农林科技大学学报,2015,43(11):200-206.
[9]李娅丽.动态微波提取人参皂苷及多糖[D].武汉:武汉工程大学,2015.
[10]张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[11]池源,王丽波.苯酚-硫酸法测定南瓜籽多糖含量的条件优化[J].食品与机械,2014,30(1):89-92.
[12]田广文,陈德育,李学俊,等.猪苓多糖苯酚-硫酸法测定条件的优选[J].中国农学通报,2007,23(7):75-78.
