集胞藻PCC 6803高产精氨酸藻株的紫外诱变选育
2018-05-16戢水玲
戢水玲 高 宏
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
精氨酸是尿素循环的重要中间代谢物, 在医药和食品工业上具有广泛用途:它是复方氨基酸输液的主要成分之一, 是氨中毒性肝昏迷的解毒剂和肝功能的促进剂, 对病毒性肝炎疗效显著, 它还经常用作饲料、食品等的添加剂。
紫外(Ultraviolet, UV)诱变育种, 是利用波长为254 nm的紫外线能引起DNA结构发生改变形成嘧啶二聚体, 尤其是胸腺嘧啶二聚体这一特点, 引起微生物遗传性状发生改变, 然后通过抗性药物筛选出少数性状优良的突变株的过程[1]。之前报道用来精氨酸诱变育种的菌株主要有谷氨酸棒状杆菌、钝齿棒状杆菌、枯草芽孢杆菌和黄色短杆菌, 所使用的抗性标记物主要有D-精氨酸、L-刀豆氨酸、6-氮尿嘧啶、磺胺胍和精氨酸氧肟酸等[2]。然而这些菌株利用的氮源主要为有机氮源, 如: 牛肉膏、蛋白胨、酵母粗提物等。
集胞藻PCC 6803是单细胞蓝藻, 能进行光合自养生长, 也能利用葡萄糖进行混养、异养生长[3], 可利用硝酸盐和亚硝酸盐作为氮源, 合成自己所需的氨基酸等化合物[4]。在工业生产所释放的烟气中,氮氧化物(NOx)是造成酸雨、雾霾的元凶[5]。然而NOx可与水反应形成硝酸根和亚硝酸根, 被蓝藻利用。因此可以在集胞藻PCC 6803中选育高产精氨酸同时去除NOx的藻株。
在精氨酸诱变育种的抗性标记物中, D-精氨酸、L-刀豆氨酸和精氨酸氧肟酸都是L-精氨酸的类似物, 而6-氮尿嘧啶是嘧啶碱基的类似物。在细胞内L-精氨酸对自身合成途径中的关键酶N-乙酰谷氨酸激酶有着反馈抑制作用[6], 通过筛选抗L-精氨酸类似物的突变株, 可以获得L-精氨酸反馈抑制减弱的突变株, 从而使细胞能大量积累精氨酸。氨甲酰磷酸是合成精氨酸和嘧啶的前体物, 受精氨酸和嘧啶碱基的积累阻遏, 当二者存其一时, 发生部分阻遏; 当二者共存时, 几乎发生完全阻遏, 因此选育6-氮尿嘧啶抗性有利于氨甲酰磷酸的积累, 从而有利于精氨酸的合成[7]。基于此, 本研究选择D-精氨酸和6-氮尿嘧啶作为紫外诱变的抗性标记物, 试图在集胞藻PCC 6803中选育将硝酸盐转化为精氨酸的藻株, 将来可用于去除工业废气中的NOx。
1 材料与方法
1.1 藻株和培养条件
集胞藻PCC 6803野生型(wild type, wt)是由北京大学赵进东教授赠送, 集胞藻#13807是分泌精氨酸突变株。除初筛和复筛时培养基中NaNO3浓度为12 g/L外, 藻株的培养条件均为30℃、30 μE/(m2.s)持续光照下BG11培养基混养(1 g/L葡萄糖)培养。
1.2 藻株的紫外诱变
藻株紫外诱变的方法参考Meireles和Tillich的报道[8,9]。具体方法为: 用254 nm波长的紫外光辐射对数期(A730=0.8)的细胞, 辐射一定时间后立即关掉紫外灯。接着在红光(632 nm, 避免光修复[10])下用没有任何抗性的BG11洗涤藻细胞一次, 1.5 mL培养基重悬后, 涂布在铺了NC膜的没有任何抗性的平板上。将所有平板用锡箔纸包住后在黑暗下放置1d后转移NC膜到添加了相应抗性标记物的平板上, 30℃、30 μE/(m2.s)持续光照培养7—10d, 长出单藻落后划线, 用来后续实验。
选择最佳诱变时间的方法是: 每个辐射时间点取500 μL藻细胞稀释10–4后取200 μL涂布平板, 将所有平板用锡箔纸包住后在黑暗下放置1d, 之后在30℃、30 μE/(m2.s)持续光照下培养7—10d, 待长出单藻落后统计藻落数目, 计算致死率。假设某个辐射时间点的藻落数为n, 未经辐射的藻落数为m, 则:致死率=(m–n)/m×100%。取致死率约为85%对应的辐射时间为最佳诱变时间。
选择抗性标记物临界浓度的方法是: 取对数期的藻细胞在含有不同浓度梯度的抗性标记物培养基中培养, 每个浓度梯度设4个平行, 初始接种A730≈0.05, 培养4d后测OD730。以添加抗性标记物作为实验组, 以不加作为对照组, 计算存活率。存活率=实验组A730/对照组A730×100%。取存活率约为3%对应的浓度为抗性标记物临界浓度。
1.3 藻株游离氨基酸的提取
胞外游离氨基酸的提取方法为: 藻细胞经4500×g离心后收集上清液并经0.45 μm过滤器过滤后收集滤液部分用作细胞外游离氨基酸的分析。胞内游离氨基酸的提取参考文献[11]略有改动: 将离心后的藻细胞先用无菌水洗涤2次, 然后用80%的乙醇重悬, 于65℃水浴抽提3h后离心取上清, 经0.45 μm过滤器过滤后滤液部分用作胞内游离氨基酸分析。
1.4 比色法检测精氨酸浓度
初筛采用比色法检测精氨酸浓度[12], 其方法是: 在Eppendorf管中依次加入40 g/L NaOH溶液、80 g/L甲萘酚正丙醇溶液和0.5 mL/L双乙酰正丙醇溶液各300 μL, 再加入300 μL的待测样品。震荡摇匀后, 在30℃水浴15min后检测OD540值, 根据标准曲线换算成精氨酸浓度, 计算每OD730值细胞总精氨酸产量, 据此来评价藻株的产酸能力。每OD730值细胞总精氨酸产量=(胞内精氨酸浓度+胞外精氨酸浓度)/A730。
1.5 高效液相色谱(HPLC)分析精氨酸浓度
复筛采用HPLC检测精氨酸浓度, 其方法参考文献[13, 14], 具体方法如下:
高效液相色谱仪是岛津LC-20A型, 由两台LC-20A高压泵, RF-10AXL荧光检测器, CAPLUGS RC-11型注射进样阀, CTO-20A柱恒温箱, CBM-20A系统控制器组成。色谱柱为安捷伦Zorbax Eclipse-AAA色谱柱(Agilent, USA), 150 mm×4.6 mm, 粒径3.5 μm。流动相A: 40 mmol/L Na2HPO4pH 7.8; 流动相B∶乙腈∶甲醇∶H2O (45∶45∶10v∶v∶v)。
色谱仪工作程序设置的总流量为2 mL/min, 运行时间时26min。0—1.9min, B%(流动相B流速的比例)为0; 1.9—18.1min, B%从0—57%;18.1—18.6min, B%从57%—100%; 18.6—22.3min,B%保持100%; 22.3—23.2min, B%从100%—0;23.2—26min, B%保持为0。检测器的设置为0—16.8min, 激发光/发射光=340/450 nm; 16.8—26min, 激发光/发射光= 266/305 nm。柱温箱设置温度为40℃。
分析过程: 取待测样品15 μL加入到75 μL的硼酸盐缓冲液(pH 10.2)中, 振荡混匀; 之后加入15 μL的邻苯二甲醛衍生试剂(邻苯二甲醛和3-巯基丙酸各10 mg/mL), 振荡混匀; 再加入15 μL的2.5 mg/mL 9-芴甲基氯甲酸酯衍生试剂, 振荡混匀后加入960 μL的H2O充分混匀后, 经0.45 μm过滤器过滤后用注射器吸取50 μL手动进样检测。
1.6 野生型及其突变株的生长曲线
取对数期的细胞接种到50 mL无任何抗性的BG11培养基中, 在30℃、30 μE/(m2.s)持续光照条件下振荡(100 r/min)混养培养, 藻细胞的初始接种浓度OD730为0.05。每个藻株作3个平行试验, 每天定时取样测OD730, 绘制生长曲线。
1.7 数据处理
数据采用Microsoft Excel 2010和SPSS 17.0进行统计分析、作图等。
2 结果
2.1 筛选抗D-精氨酸突变株的结果
作者以集胞藻#13807为紫外诱变出发株, 检测了不同辐射时间的致死率, 发现10—30s致死率急剧增加, 其中20—30s致死率为70%—90%, 40s以后藻细胞全部死亡。由于过高的致死率会导致藻株变异幅度大, 产生较多负突变株, 而太低的致死率又很难达到诱变效果, 因此选择合适的诱变剂量,对获得最佳的诱变效果极为重要。一般来说, 选择致死率在75%—85%之间的诱变剂量较合适, 因此本研究选取25s作为集胞藻#13807的最佳诱变时间。
检测集胞藻#13807耐受D-精氨酸的临界浓度,如图 1所示, 在D-精氨酸为0.6 g/L时藻细胞的存活率仅为5%, 表明此浓度的D-精氨酸已经完全抑制了藻细胞的生长。当提高D-精氨酸浓度至0.8 g/L时藻细胞的存活率仅为3%, 因此本研究选择0.8 g/L作为集胞藻#13807耐受D-精氨酸的临界浓度。
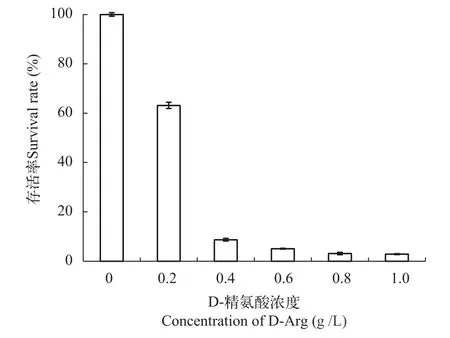
图 1 集胞藻#13807在不同浓度D-精氨酸培养条件下的存活率Fig. 1 The effect of different D-arginine concentrations on the survival rate of #13807
对集胞藻#13807经紫外诱变得到的突变子先在含有0.8 g/L D-精氨酸的固体平板上划线, 然后接种到含0.8 g/L D-精氨酸的液体培养基中培养, 经固体、液体培养基两步抗性筛选后共得到173株用来初筛。对这173株突变株用比色法检测每OD730值细胞总精氨酸产量后, 选取了14株总精氨酸产量提高10倍左右的藻株进行复筛, 经过HPLC分析选取了产量最高的4株做了3次平行实验, 如图 2所示,#13807-111是精氨酸产量显著提高的突变株, 其每OD730值细胞总精氨酸产量相比出发株提高了2.4倍。
2.2 筛选抗6-氮尿嘧啶突变株的结果
为了进一步提高精氨酸产量, 作者对#13807-111进行了第二轮紫外诱变。首先检测了该藻株不同辐射时间的致死率, 结果发现在辐射时间仅为10s时致死率已经达到了80%, 而到15s的时候藻细胞就全部死亡, 因此选择10s作为第二轮的最佳诱变时间。
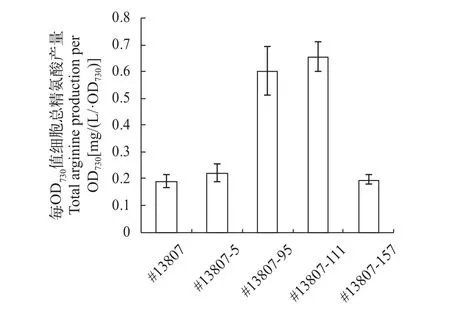
图 2 集胞藻#13807及其突变株每OD730值细胞总精氨酸产量Fig. 2 Total arginine production per OD730 of #13807 and its mutants
检测#13807-111耐受6-氮尿嘧啶的临界浓度,如图 3所示, 当6-氮尿嘧啶浓度为0.2 g/L时, 藻细胞存活率仅为4%, 表明此浓度的6-氮尿嘧啶已经完全抑制了藻细胞的生长, 因此本轮诱变选择0.2 g/L作为#13807-111耐受6-氮尿嘧啶的临界浓度。
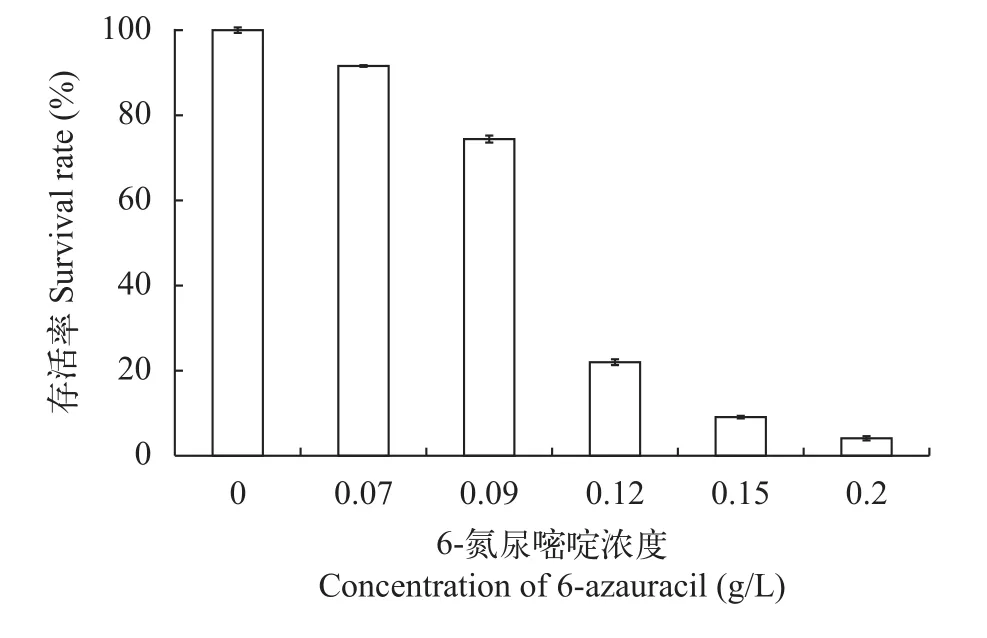
图 3 #13807-111在不同浓度6-氮尿嘧啶培养条件下的存活率Fig. 3 The effect of 6-azauracil on the survival rate of #13807-111
对#13807-111经紫外诱变得到的突变子先在含有0.8 g/L D-精氨酸和0.2 g/L 6-氮尿嘧啶的固体平板上划线, 然后接种到含0.8 g/L D-精氨酸和0.2 g/L 6-氮尿嘧啶的液体培养基中培养, 经固体、液体培养基两步抗性筛选后共得到118株用来初筛。对这118株突变株用比色法检测每OD730值细胞总精氨酸产量后选取了14株产量提高3倍左右的藻株进行复筛, 经HPLC分析获得了一株精氨产量有所提高的突变株#13807-111-55。
对野生型、#13807-111和#13807-111-55绘制了生长曲线, 如图 4所示, 结果表明突变株和野生型的生长速率没有显著差别(P>0.05)。
将出发藻株和两轮诱变得到的突变株同批次培养, 保证培养条件一致: 所有的藻株都在NaNO3为12 g/L、葡萄糖1 g/L的BG11培养基中混养培养10d后HPLC检测胞内、胞外精氨酸产量, 结果如图5所示, 每OD730值细胞, 集胞藻#13807和它的突变株胞内精氨酸产量差异不显著(P>0.05)且都很低,然而它们的胞外精氨酸产量却有显著差别(P<0.05):#13807-111和#13807-111-55的每OD730值细胞胞外精氨酸产量相比#13807分别提高了47.8倍和62.3倍,这表明本研究选育的抗D-精氨酸突变株#13807-111和抗D-精氨酸和6-氮尿嘧啶突变株#13807-111-55都是分泌精氨酸突变株。这两株藻中, 对于每OD730值细胞, #13807-111的总精氨酸产量相比出发株集胞藻#13807有显著提高(P<0.05), 而#13807-111-55的总精氨酸产量相比#13807-111只有略微提升(P>0.05), 表明筛选D-精氨酸抗性更有利于提高精氨酸产量, 而6-氮尿嘧啶抗性对提高精氨酸产量影响很小。虽然如此, 通过两轮紫外诱变筛选抗D-精氨酸和6-氮尿嘧啶的突变株, 作者选育到了每OD730值细胞胞外精氨酸产量提高62.3倍, 总精氨酸产量提高6.0倍的藻株#13807-111-55, 该藻株是一株分泌精氨酸突变株, 每OD730值细胞的胞外和总精氨酸产量分别达到(0.76±0.1) mg/(L.OD730)和(0.82±0.08) mg/(L.OD730)。

图 4 野生型和突变株在30℃、30 μE/(m2.s)混养条件下生长曲线Fig. 4 Growth curves of the wild-type and mutants at 30℃ and 30 μE/(m2.s) under mixotrophic growth conditions
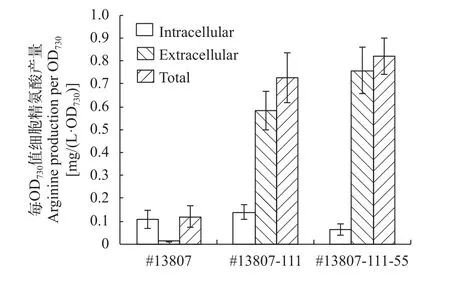
图 5 集胞藻#13807及其突变株每OD730值细胞精氨酸产量Fig. 5 Arginine production per OD730 of #13807 and its mutants
3 讨论
#13807-111是集胞藻#13807经紫外辐射25s得到的突变株, 然而检测该藻株不同辐射时间的致死率, 发现在辐射时间仅为10s时致死率已经达到了80%, 而到15s的时候藻细胞就全部死亡, 造成这一结果的可能原因是紫外诱变对#13807-111某些基因或者位点造成了损伤, 使得它对紫外辐射更加敏感了, 在很小剂量的紫外辐射条件下都有可能造成藻细胞死亡。这提示我们在多次紫外诱变过程中,需要对每次的出发株测试致死率, 从而确定最佳的诱变时间。
D-精氨酸是L-精氨酸的类似物, 通过筛选抗D-精氨酸的藻株可以选育到精氨酸反馈抑制减弱的突变株, 从而提高精氨酸产量。本研究第一轮诱变通过筛选抗D-精氨酸突变株选育到了精氨酸产量显著提高的突变株#13807-111, 其每OD730值细胞总精氨酸产量相比出发株提高了6.0倍, 表明在蓝藻中筛选D-精氨酸抗性能够显著提高精氨酸产量。此外该藻株和#13807-111-55的精氨酸主要分泌到了胞外, 表明这两株突变株都是分泌精氨酸突变株,这可能是因为紫外诱变造成的突变不仅减弱了L-精氨酸的反馈抑制使得总精氨酸产量提高, 而且也改变了细胞膜的通透性使精氨酸分泌到胞外。
6-氮尿嘧啶是嘧啶碱基的类似物, 而嘧啶碱基阻遏氨甲酰磷酸的合成从而影响精氨酸的合成[7],因此选育6-氮尿嘧啶抗性有利于精氨酸的合成。之前有报道称在枯草芽孢杆菌中, Kato等[15]利用亚硝基胍诱变, 选育到了耐受0.1 g/L 6-氮尿嘧啶的突变株AAr-9, 它的精氨酸产量相比出发菌株提高了1.7倍, 达到28 g/L。在本研究中, 利用D-精氨酸抗性选育到了精氨酸产量显著提高的藻株, 而利用6-氮尿嘧啶抗性选育却并没有成功。这可能是因为在枯草芽孢杆菌中, 通过选育6-氮尿嘧啶抗性来提高精氨酸产量的方法, 在蓝藻中不一定适用, 需要选择其他的抗性标记物来提高精氨酸产量。
1991年, Aruma等[16]对谷氨酸棒状杆菌进行NTG处理, 获得了一株精氨酸高产菌H-7096, 经离子交换柱可获得52.8 g/L的精氨酸粗结晶。2003年,苏令鸣等[17]以黄色短杆菌为出发株经NTG诱变和选育, 获得高产精氨酸菌株AN78, 在20 L发酵罐中培养4d, 产酸率可达61.1 g/L。本研究#13807-111-55是精氨酸产量显著提高的突变株, 其胞外和总的精氨酸产量分别为(3.19±0.72)、(3.44±0.65) mg/L,远远低于工业上精氨酸发酵菌的产量, 因此需要更多的研究来进一步提高蓝藻精氨酸产量。首先, 本研究选育抗6-氮尿嘧啶突变株并没有显著提高精氨酸产量, 因此可以通过选育抗其他药物, 例如抗精氨酸氧肟酸、抗磺胺胍、抗L-刀豆氨酸等的突变株来进一步提高精氨酸产量。其次, 由于#13807-111-55能利用葡萄糖异养生长, 因而可以通过不断优化培养条件, 达到高密度培养的目的, 提高精氨酸产量。第三, #13807-111-55是精氨酸分泌突变株, 能利用硝酸盐和亚硝酸盐合成精氨酸并分泌到培养液中, 便于精氨酸的提取纯化。因此#13807-111-55是一株潜在的用于生物脱硝同时分泌精氨酸的藻株。
参考文献:
[1] Miller J H. Mutagenic specificity of ultraviolet light [J].Journal of Molecular Biology, 1985, 182(1): 45—65
[2] Wang X, Tao W Y, Sun Z H,et al. Research progress of L-arginine fermentation [J].Industrial Microbiology,2000, 30(4): 50—54 [王霞, 陶文沂, 孙志浩 等. L-精氨酸发酵研究进展. 工业微生物, 2000, 30(4): 50—54]
[3] Kong R Q, Xu X D, Hu Z Y. A TPR-family membrane protein gene is required for light-activated heterotrophic growth of the cyanobacteriumSynechocystissp. PCC 6803 [J].FEMS Microbiology Letters, 2003, 219(1):75—79
[4] Harano Y, Suzuki I, Maeda S I,et al. Identifi cation and nitrogen regulation of the cyanase gene from the cyanobacteriaSynechocystissp. strain PCC 6803 andSynechococcussp. strain PCC 7942 [J].Journal of Bacteriology, 1997, 179(18): 5744—5750
[5] Niu H and Leung D Y C. A review on the removal of nitrogen oxides from polluted flow by bioreactors [J].Enviornmental Reviews, 2010, 18(1): 175—189
[6] Xu Y, Liang Z Y, Legrain C,et al. Evolution of arginine biosynthesis in the bacterial domain: novel gene-enzyme relationships from psychrophilicMoritellastrains (Vibrionaceae) and evolutionary significance ofN-alpha-acetyl ornithinase [J].Journal of Bacteriology, 2000, 182(6):1609—1615
[7] Chen X L, Xu Z H, Tao W Y. Studies on the genetic engineering strains producing L-arginine [J].Food and Fer-mentation Industries, 2003, 29(12): 97—102 [陈雪岚, 许正宏, 陶文沂. 产L-精氨酸基因工程菌的研究. 食品与发酵工业, 2003, 29(12): 97—102]
[8] Meireles L A, Guedes A C, Malcata F X. Increase of the yields of eicosapentaenoic and docosahexaenoic acids by the microalgaPavlova lutherifollowing random mutagenesis [J].Biotechnology and Bioengineering, 2003,81(1): 50—55
[9] Tillich U M, Lehmann S, Schulze K,et al. The optimal mutagen dosage to induce point-mutations inSynechocystissp. PCC6803 and its application to promote temperature tolerance [J].PLoS One, 2012, 7(11): 1—8
[10] Lucaslledo J I, Lynch M. Evolution of mutation rates:phylogenomic analysis of the photolyase/cryptochrome family [J].Molecular Biology and Evolution, 2009, 26(5):1143—1153
[11] Eisenhut M, Kahlon S, Hasse D,et al. The plant-like C2 glycolate cycle and the bacterial-like glycerate pathway cooperate in phosphoglycolate metabolism in cyanobacteria [J].Plant Physiology, 2006, 142(1): 333—342
[12] Hao G, Qian H. Study on detection methods of L-arginine in fermentation broth [J].Science and Technology of Food Industry, 2005, 2: 184—186 [郝刚, 钱和. 发酵液中L-精氨酸定量检测方法的研究. 食品工业科技分析检测, 2005, 2: 184—186]
[13] Herbert P, Santos L, Alves A. Simultaneous quantification of primary, secondary amino acids, and biogenic amines in musts and wines using OPA/3-MPA/FMOC-Cl fluorescent derivatives [J].Journal of Food Science,2002, 66(9): 1319—1325
[14] Henderson J W, Ricker R D, Bidlingmeyer B A,et al.Rapid, accurate, sensitive, and reproducible HPLC analysis of amino acids: Amino acid analysis using Zorbax Eclipse-AAA columns and the Agilent 1100 HPLC. Agilent Technologies Inc, Publication Number 5980-1193E,2000, 1-10 http://www.chem.agilent.com/Library/chromatograms/59801193.pdf
[15] Kato J, Kisumi M, Takagi T,et al. Increase in arginine and citrulline production by 6-azauracil-resistant mutants ofBacill subtilis[J].Applied & Environmental Microbiology, 1977, 34(6): 689—694
[16] Azuma T, Aoyagi S, Nakanishi T. Process for producing L-arginine [P]. United States Patent: US5034319, 1991-07-23
[17] Su L M, Wang Y M, Li S. Fermentative production of L-arginine by mutant AN78 [J].Industrial Microbiology,2003, 33(2): 1—3 [苏令鸣, 王宜敏, 李爽. 黄色短杆菌变异株AN78的发酵生产L-精氨酸的研究. 工业微生物,2003, 33(2): 1—3]
