吉林蛟河阔叶红松林地表甲虫多样性时间动态分析
2018-05-16刘生冬孟庆繁高文韬赵红蕊李天琦
刘生冬,孟庆繁,高文韬,李 燕,赵红蕊,李天琦
北华大学林学院, 吉林 132013
地表甲虫作为陆生甲虫的一部分,其活动空间绝大多数位于地表及以上15cm以内,主要包括步甲科Carabidae、埋葬甲科Silphidae、拟步甲科Tenebrionidae、隐翅虫科Staphylinidae、象甲科Curculionidae等甲虫。由于地表甲虫食性复杂、身体结构特殊,使其能够对各种环境有较强的适应能力,广泛分布于各生态系统中[1]。于由生活习性的复杂化,一部分地表甲虫对农林会产生重要的危害,成为防治对象,另一些种类具有捕食和加速生物体分解的功能,对生态系统的能量流动和物质循环起着重要的作用。地表甲虫取样方法成熟、误差较小,同时,其物种组成和数量与环境密切相关,部分种类能够成为环境变化的指示性昆虫,近些年不断得到人们的关注[2- 8]。
地表甲虫的多样性与植被群落的结构和组成有着明确的联系[9]。森林类型和林业活动等人为干扰对地表甲虫多样性具有较大影响,而且比其他昆虫反映更加敏感[10- 20],天然林对保护地表甲虫多样性方面起着更加重要的作用[12]。森林内部的枯落物厚度、郁闭度和土壤含水量是影响甲虫个体数量的主要因素[10,12,21- 22],有研究显示枯落物对地表甲虫的影响可能是间接的,枯落物可以增加地表的温度和湿度从而影响甲虫的分布,温度和湿度的变化可能比枯落物本身对甲虫的影响更大[23- 28]。地表甲虫的种类、数量与海拔间存在显著性线性关系[13],多样性和海拔梯度的关系依赖于环境因子之间的作用[29]。国内现有研究多集中在林分组成和结构、人为活动、以及环境因子对地表甲虫的影响,而对于阔叶红松林内地表甲虫多样性的时间动态研究较少。本次研究在整个地表甲虫活跃期连续采集标本,揭示了阔叶红松林中地表甲虫的时间动态,以及优势类群对时间变化的响应,为阔叶红松林内地表甲虫的监测和指示种的研究,以及不同习性的甲虫保护和利用提供科学依据。
1 研究区域概况
研究区域位于张广才岭南段蛟河林业实验区管理局经营区内,地理位置为127°35′—127°51′E, 43°51′—44°05′N,属长白山系的支脉,最高为1176m,最低约330m,相对高差约846m。该区域植物物种资源丰富,属长白山植物区系,原始植被为针阔混交林,后期经演替形成的阔叶红松林、杨桦林、水胡林、阔叶混交林等[30]。建群乔木树种主要包括红松(Pinuskoraiensis)、鱼鳞云杉(Piceajezoensis)、沙冷杉(Abiesholophylla)、胡桃楸(Juglansmandshurica)、水曲柳(Fraxinusmandshurica)、花曲柳(Fraxinusrhynchophylla)、紫椴(Tiliaamurensis)、糠椴(Tiliamandschurica)、蒙古栎(Quercusmongolica)、色木槭(Acermono)、白牛槭(Acermandshuricum)、假色槭(Acerpseudo-sieboldianum)、枫桦(Betulacostata)、白桦(Betulaplatyphylla)、春榆(Ulmusjaponica)、山杨(Populusdavidiana)等。常见的灌木有暴马丁香(Syringareticulatavar.mandshurica)、长白忍冬(Loniceraruprechtiana)、毛榛(Corylusmandshurica)、胡枝子(Lespedezabicolor)、珍珠梅(Sorbariakirilowii)等。
2 研究方法
2.1 样地设置
根据林分组成、林龄等选择经营区内分布面积大、代表性强的林分设置4块300m×400m样地,调查各样地的树种组成、平均年龄等林分因子[31]。样地一:海拔430m,样地中心点坐标127°42′53″E, 43°57′59″N,主要树种为白桦、水曲柳、胡桃楸、春榆、山杨、假色槭等,林分平均年龄约50y。样地二:海拔430m,样地中心点坐标127°43′12″E, 43°57′52″N。主要树种有水曲柳、胡桃楸、山杨、白桦、春榆、红松、鱼鳞云杉、色木槭、假色槭等,林分平均年龄约70y。样地三:海拔550m,样地中心点坐标127°45′26″E, 43°59′33″N。主要树种有红松、胡桃楸、鱼鳞云杉、水曲柳、紫椴、春榆、色木槭、山杨、白牛槭等,林分平均年龄约80y。样地四:海拔660m,样地中心点坐标127°45′22″E, 43°58′2″N。主要树种有红松、胡桃楸、鱼鳞云杉、水曲柳、紫椴、色木槭、春榆、枫桦、白牛槭、假色槭等,林分平均年龄约90y。
2.2 标本采集与鉴定
利用巴氏罐法采集地表甲虫,在每个样地的4个顶点和中心各设置1个样点(用PVC管固定位置),在每个样点设置2m×2m的样方,在样方内相距1m布设9个诱杯,以每个样方为统计单位,每块样地共放置诱杯45个。诱杯利用一次性塑料水杯(高9cm,口径7.15cm),在杯壁上方1/4处打一个直径约为3mm小孔,以免由于雨水过多使标本流失,每个诱杯中放入约100mL诱剂,成分比例为醋∶白糖∶酒精∶水为2∶1∶1∶20。所有标本制成针插标本进行鉴定,步甲科标本由中科院动物所梁红斌副研究员鉴定,部分隐翅虫科由上海师范大学汤亮鉴定,标本保存在北华大学昆虫标本室。
2.3 调查时间
调查时间为2012年和2013年,每年的5 月中旬至8 月下旬,涵盖了整个地表甲虫活跃期,甲虫具体标本回收时间为 5月下旬(May-L)、6月上旬(June-E)、6月下旬(June-L)、7月上旬(July-E)、7月下旬(July-L)、8月上旬(Aug.-E)和8月下旬(Aug.-L),共7个时间,将2年的数据按上述7个时间合计统计。
2.4 数据处理
多样性分析采用以下参数[32- 33]:
式中,Pi=ni/N为第i种占总个体数N的比例。
(2)均匀度Pielou指数J′=H′/ lnS,式中:H′为Shannon-Wiener多样性指数,同(1)。
(3)类群的优势度采用Berger-Parker指数W=Nmax/N,式中:Nmax为优势类群的个体数;N为个体总数。当W≥10%时优势类群,1%≤W<10%为常见类群,W<1%时为稀有类群。
(4)相似性系数采用Jaccard系数I=C/(A+B-C)。式中:A,B分别为2种生境中的物种数;C为2种生境类型中共有的物种数。根据Jaccard的相似性系数原理,当I为0.00—0.25时,为极不相似;I为0.25—0.50时,为中等不相似;I为0.50—0.75时,为中等相似;I为0.75—1.00时,为极相似。
相关分析采用Pearson相关系数,差异性利用非参数Friedman检验,数据和图形使用SPSS 19.0和Sigmaplot 10.5进行处理,对应分析利用Canoco 4.5进行作图与分析。
3 结果与分析
3.1 不同时间地表甲虫物种组成
由于本次研究利用巴氏罐法采集昆虫标本,时间贯穿整个地表甲虫活跃期,所采集的地表甲虫的种类和个体数较多,共采集地表甲虫9849头,隶属22个科79种。其中,步甲科Carabidae、埋葬甲科Silphidae和隐翅虫科Staphylinidae的个体数超过总数的10%,为优势类群,同时,步甲科27种,5252头,占个体总数的53.33%,是整个地表甲虫的绝对优势类群,不同时间(2年合计)地表甲虫各类群个体数量及比重见表1。
从表1中可以看出,6月下旬地表甲虫科数最多,为15个科,占总科数的68.18%,其次是6月上旬和7月下旬。7月上旬个体数量最多,为3222头,占总数的32.71%,其次是7月下旬,占总数的14.33%。8月下旬地表甲虫科数和个体数量都是最低。步甲科个体数量在各个时间都占绝对优势,为各时间优势类群。埋葬甲科个体数量只在8月下旬所占比例相对较少为9.78%,为亚优势类群,而在其他6个时间都为优势类群。隐翅虫科是5月下旬、6月上旬和6月下旬和8月下旬的优势类群,而其他时间为亚优势类群。
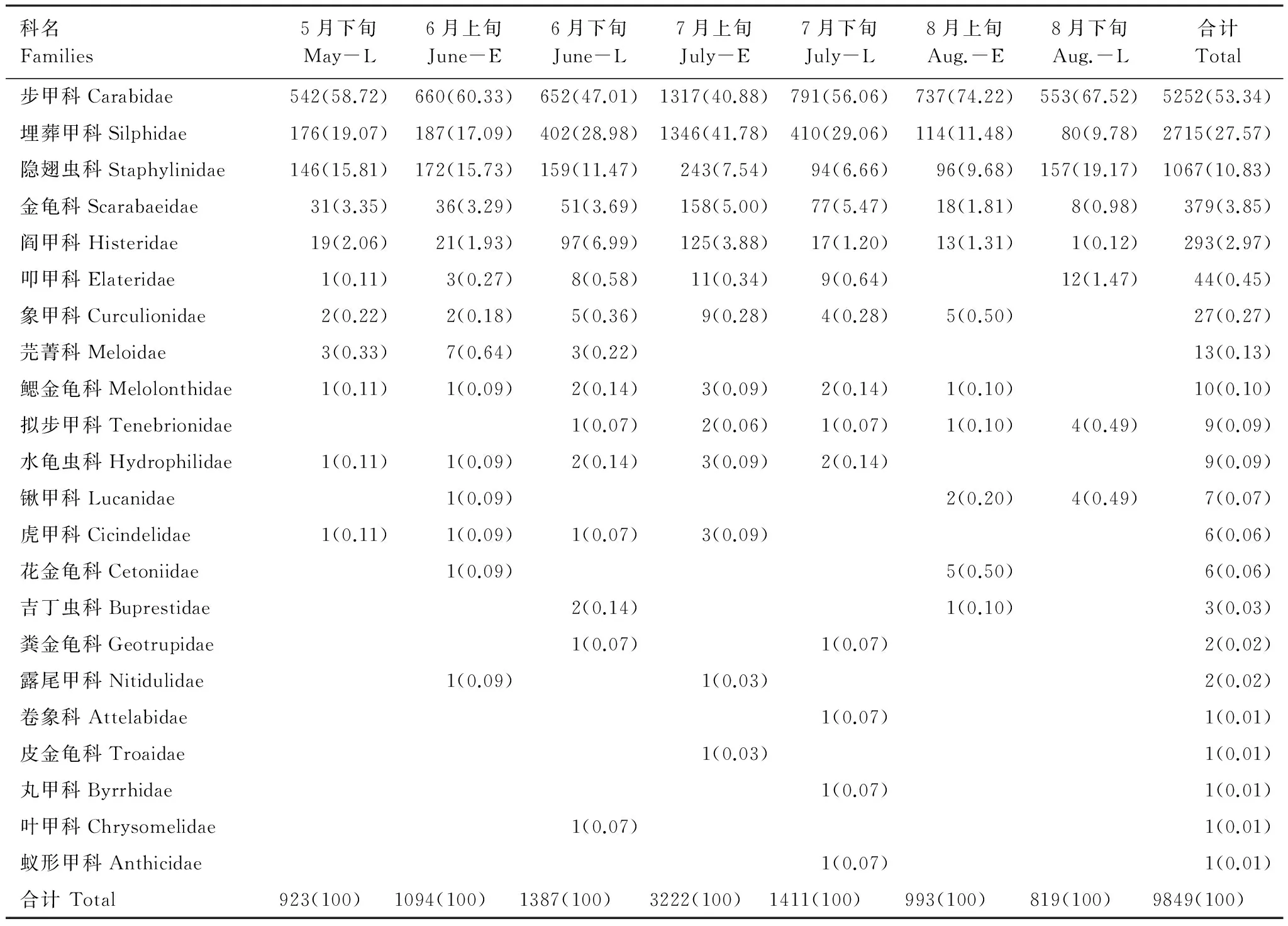
表1 不同时间地表甲虫个体数量/%(2012—2013)
L: late;E: early
步甲科、埋葬甲科和隐翅虫科个体数在各时间所占比重各不相同,步甲科个体数所占比重只在6月下旬和7月上旬相对较低,其他时间所占比重较高,都超过了总个体数的50%。埋葬甲科个体数所占比重7月上旬最高达到了41.78%,也是这个时间个体数最多的类群,其次是7月下旬和6月上旬,而8月份所占比重相对最低。隐翅虫科个体数所占比重从5月下旬开始一直下降,到8月上旬开始有所升高,8月下旬所占比重达到了最高为19.17%。
步甲科、埋葬甲科、隐翅虫科、金龟科和阎甲科在各时间都被采集到,表明其类群分布的时间跨度较大,活跃期较长。叩甲科只在8月上旬未被采集到、象甲科只在8月下旬未被采集到。芫菁科只在5月和6月被采集,其活跃时间较早,而6月以后其活跃度有所降低。拟步甲科个体数较少,活跃期主要集中6月下旬以后,其在5月下旬至6月上旬类群活跃度相对较低。埋葬甲科个体数量除7月上旬略高于步甲科外,其他各时间都是步甲科的个体数量最多。
3.2 地表甲虫群落多样性的时间动态
地表甲虫物种数、个体数、多样性指数、均匀度的时间动态见图1—图4。地表甲虫物种数的时间动态呈单峰型变化,由5月下旬开始增加,到7月上旬达到最大值,8月下旬时降到最低(图1),各采集时间对物种数无显著影响(Q(6,21)=10.986;P>0.05)。地表甲虫个体数从5月下旬开始上升至7月上旬达到最大值,到8月下旬时逐渐降到最低(图2),7月上旬个体数显著高于5月下旬和8月下旬(Q(6,21)=15.848;P<0.05)。不同时间地表甲虫个体数与物种数呈显著正相关(R=0.781,P<0.05)。多样性指数最高出现在7月上旬,其次是7月下旬,而8月上旬时最低(图3)。均匀度指数最高出现在8月下旬,其次是6月下旬,8月上旬最低(图4)。经检验不同时间地表甲虫多样性指数、均匀度指数影响都不显著(Q(6,21)<10.362;P>0.05)。
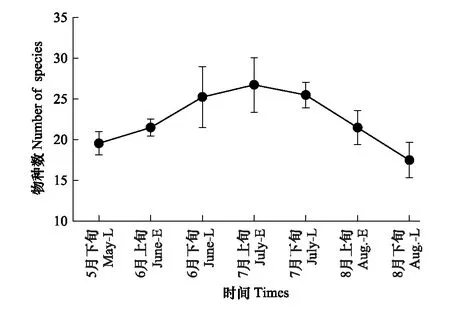
图1 地表甲虫物种数时间动态Fig.1 The temporal dynamics of species number of litter-layer beetles
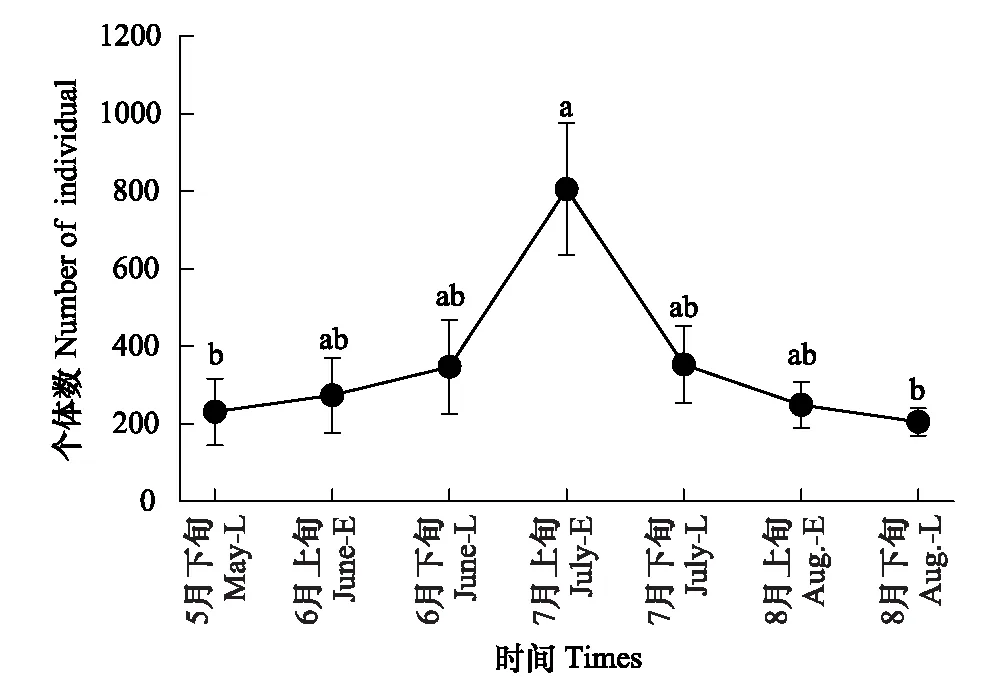
图2 地表甲虫个体数时间动态Fig.2 The temporal dynamics of individual number of litter-layer beetles
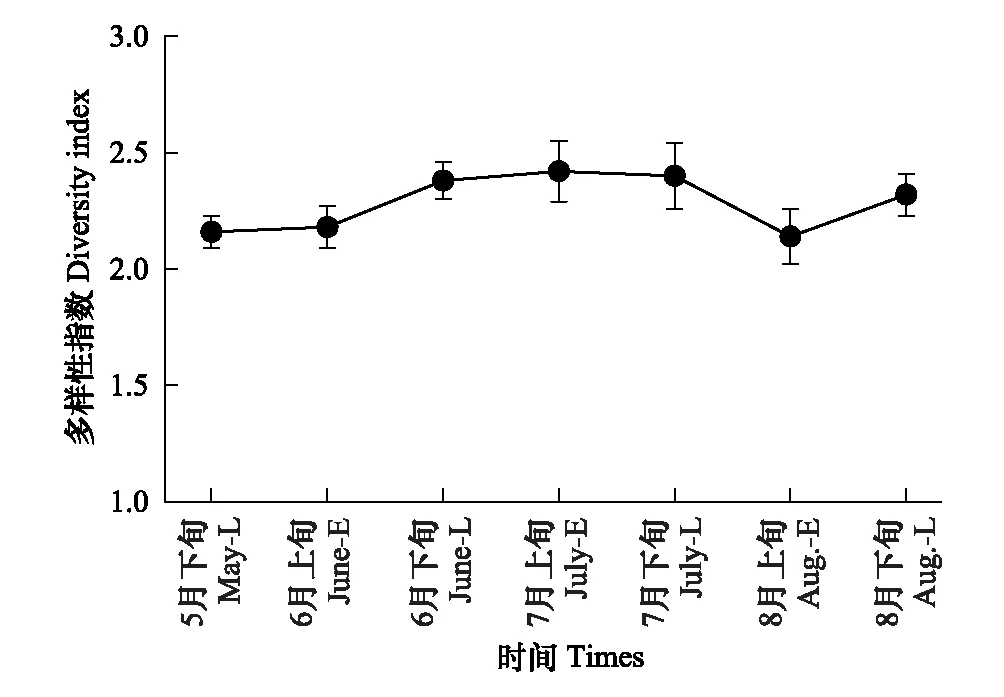
图3 地表甲虫多样性指数时间动态Fig.3 The temporal dynamics of diversity index of litter-layer beetles
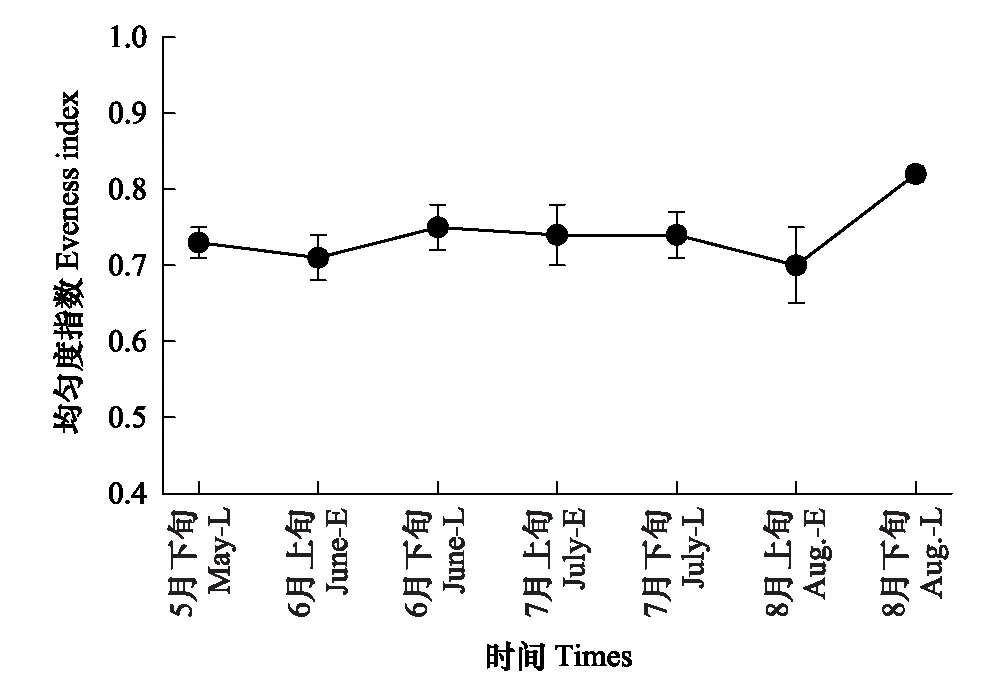
图4 地表甲虫均匀度指数时间动态Fig.4 The temporal dynamics of eveness index of litter-layer beetles
3.3 不同时间地表甲虫群落的相似性
相似性系数是一个只考虑种类而不考虑个体数量的指标,连续时间的相似性系数在一定程度上能够反映出物种活跃时间以及活跃期持续的时间,不同时间的地表甲虫相似性系数见表2。从表2可以看出,6月下旬与7月上旬相似性系数0.65最高,6月下旬与7月下旬、7月上旬与7月下旬间的相似性系数也较高,都达到中等相似水平。而其他各时间相似性相对较低,处在中等不相似水平,随时间间隔的增加地表甲虫的相似性都在逐渐降低,地表甲虫在各时间的相似性相对较高,成虫活跃期较长。
3.4 地表甲虫优势类群时间动态
步甲科、埋葬甲科和隐翅虫科为本次研究的优势类群,这3个优势类群的物种数和个体数的时间动态见图5和图6。
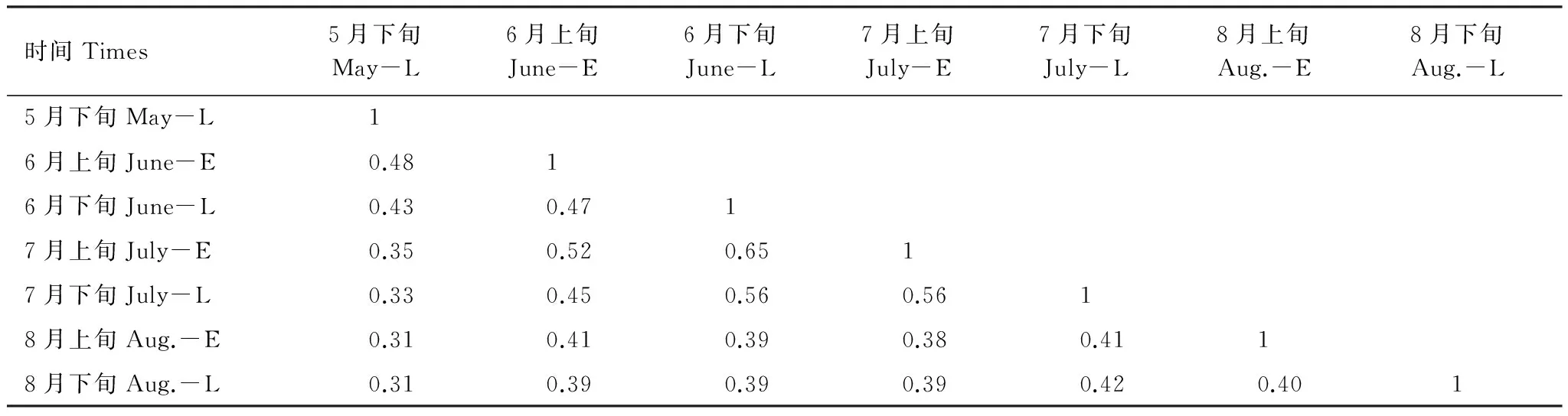
表2 不同时间地表甲虫相似性系数
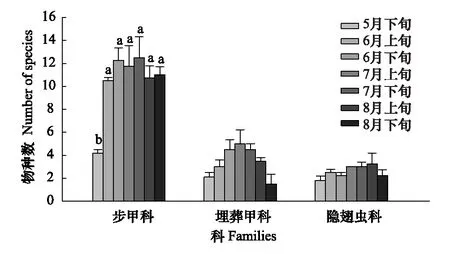
图5 步甲科、埋葬甲科和隐翅虫科物种数时间动态 Fig.5 The temporal dynamics of species number of Carabidae, Silphidae, Staphylinidae
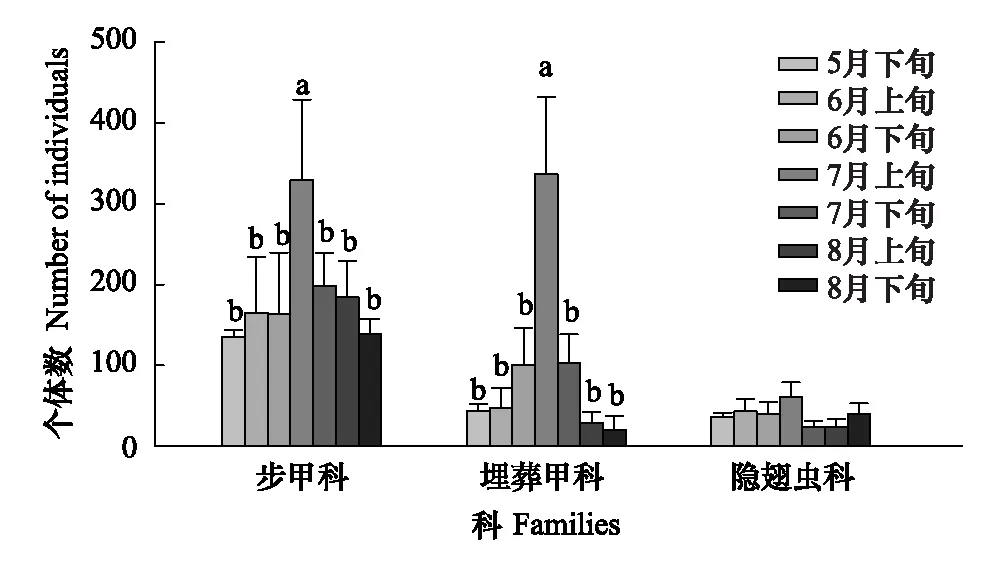
图6 步甲科、埋葬甲科和隐翅虫科个体数时间动态 Fig.6 The temporal dynamics of individual number of Carabidae, Silphidae, Staphylinidae
步甲科各时间物种数都高于其他两个优势类群,6月下旬至7月下旬物种数较多,5月下旬最少,显著少于其他各时间(Q(6,21)=15.752;P<0.05)。埋葬甲科物种数从5月下旬开始逐渐上升,到7月上旬达到最高峰,到8月下旬逐渐降到最低。隐翅虫科在各时间变化较小,5月下旬最低,8月上旬最高,其次是7月上旬和7月下旬,时间对埋葬甲科和隐翅虫科的物种数都没有显著影响(Q(6,21)=9.348;P>0.05)。
步甲科个体数在5月下旬最低,7月上旬最高,然后逐渐降低,时间对个体数影响显著(Q(6,21)=15.965;P<0.05)。埋葬甲科个体数量各时间变化较大,7月上旬达到高峰,显著高于其他各时间(Q(6,21)=17.570;P<0.01),8月下旬个体数最少。隐翅虫科个体数量最多集中在6月上旬至7月上旬,各时间差异不显著(Q(6,21)=8.598;P>0.05)。步甲科、埋葬甲科和隐翅虫科物种数两两间在各时间无显著的相关性(R<0.642,P>0.05),可见这3个类群在各时间变化具有差异。不同时间步甲科个体数与埋葬甲科个体数呈显著性正相关(R=0.845,P<0.05),步甲科个体数与隐翅虫科个体数呈显著性正相关(R=0.832,P<0.01)。埋葬甲科不同时间物种数与个体数呈显著性正相关(R=0.785,P<0.05)。
3.5 地表甲虫优势类群与时间对应分析
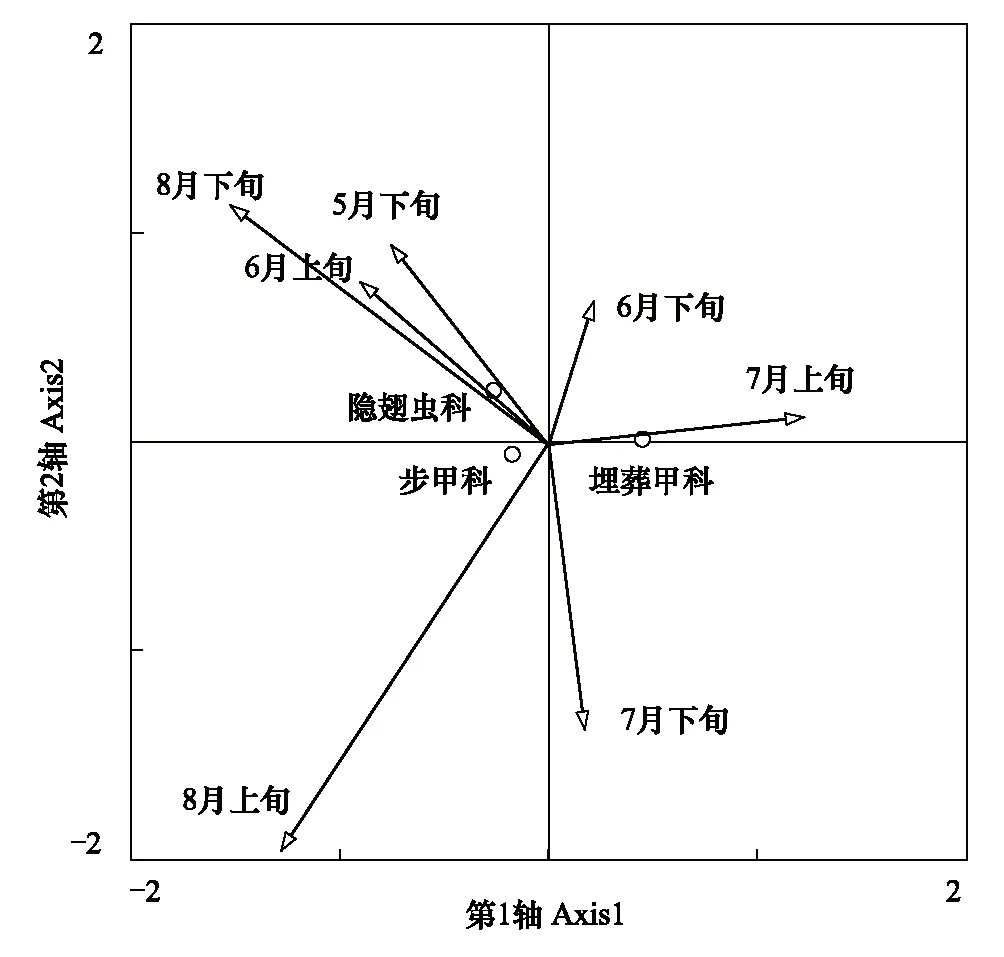
图7 步甲科、埋葬甲科、隐翅虫科与各时间对应关系 Fig.7 The correspondence analysis of Carabidae、Silphidae、Staphylinidae in different times
物种或类群与环境的对应关系在一定程度上能够反应物种或类群对环境的适应性或依赖性。步甲科、埋葬甲科、隐翅虫科的个体数与7个采集时间的对应分析见图7。从图7中可以看出,除5月下旬外,从6月上旬到8月下旬各时间按顺时针排列,时间箭头的长短和方向各不相同,显示出3个优势类群对不同时间适应能力的差异性。5月下旬、6月上旬和8月下旬对3个优势类群的影响比较相似,隐翅虫科相对于其他两个类群对上述3个时间的适应能力较强,其次是步甲科,而埋葬甲科的适应能力最弱。步甲科对8月上旬的适应能力强于其他类群,埋葬甲科和隐翅虫科对6月上旬的适应能力高于步甲科。7月上旬是环境条件较好和食物资源丰富的时间,埋葬甲科对这个时间的适应能力或依赖程度远高于步甲科和隐翅虫科。
4 结论与讨论
本研究通过在地表甲虫活跃期高频次的标本采集,查清了吉林省蛟河阔叶红松林中地表甲虫以及优势类群的时间动态,共采集9849头标本,隶属于22个科79种。时间对地表甲虫的个体数有显著影响,地表甲虫物种数、个体数的高峰期都出现在7月上旬,物种数和个体数表现出较低水平的相关性。由于试验地的地理位置、林分条件较为相似,使本次研究结果与小兴安岭阔叶红松林中地表甲虫的高峰期相一致[34];而与北京湿地甲虫个体数的高峰期出现在8月不同[35],这是由于森林和湿地环境差异较大,导致甲虫对时间变化的响应也有所不同,使得森林中甲虫的高峰期早于湿地中甲虫的高峰期。本研究地表甲虫个体数只在7月上旬出现一个高峰期。与一些研究部分甲虫在5月会出现一个小高峰期不同[35- 37],这是由于地表甲虫活动区域集中在地面,活动距离相对较小,使这些甲虫对地表温度的变化更加敏感,同时,5月以捕食性和腐食性的地表甲虫食物资源较少,使在温度相对较低的5月没有出现高峰期。
地表甲虫多样性指数在7月上旬最高,多样性指数与物种数、多样性指数与个体数没有显著的相关性,体现出个别地表甲虫种类对环境变化比较敏感,随环境条件的变化个体数量变化较大。均匀度8月下旬最高,与其他指标间具有较大的差异,这与国外的一些研究较为相似[38],主要是由于地表甲虫个别种类在不同时间个体数量变化较大,使得物种数、个体数和多样性较高的时间均匀度却较低。在连续的各采集时间,地表甲虫在6月和7月各时间相似性系数较高,这个时期物种的活跃期较长。
步甲科、埋葬甲科和隐翅虫科为本次研究的优势类群,与凉水阔叶红松林地表甲虫的优势类群相同[34],步甲科的物种数和个体数都占绝对优势。3个优势类群的个体数时间动态各不相同,这与湿地甲虫的研究结果相似[35],体现了各优势类群在时间变化上的多样化。与湿地中步甲的个体数高峰期在8月不同,步甲科个体数出现的高峰集中在7月上旬,并显著高于其他时间。与漠荒区拟步甲科物种数与个体数的时间动态相一致不同[39],步甲科个体数与物种数的时间动态变化不一致,反映出个别种类随时间的变化而个体数变化较大。埋葬甲科物种数与个体数的时间动态相一致,高峰期都出现在7月上旬,7月上旬埋葬甲科的个体数极显著高于其他时间。本次研究可以看出,埋葬甲科对时间变化的敏感程度高于其他两个优势类群,其时间动态不但和林内的环境条件有关,还可能是由于这个时期温度较高,同时雨量较多,地表可以取食的腐烂食物较多有关,使得采集到的细腿黑覆葬甲Nicrophorustenuipes、四星覆葬甲Nicrophorusquadripunctatus和日真葬甲Necrophila个体数骤增。随着时间推移和环境改变,使得其个体数量又迅速降低。隐翅虫科对时间变化的反映程度低于其他两个优势类群,这可能与其自身的生活习性以及主要以肉食性有关[40],使这个类群对时间的变化具有较强的适应能力。通过对应分析可以看出,步甲科对8月上旬的适应能力强于埋葬甲科和隐翅虫科,埋葬甲科和步甲科对7月下旬的环境条件适应能力高于隐翅虫科。
地表甲虫在各时间的组成与多样性,体现了各时间环境因子对其综合影响的结果,由于地表甲虫生活习性的特殊化,使得捕食性和腐食性地表甲虫活跃的高峰期与被捕食昆虫在各时期的数量有关,环境中其他昆虫的时间动态可能也会影响地表甲虫物种组成和多样性,地表甲虫与其他昆虫在环境中的变化关系有待进一步研究。
致谢:感谢中国科学院动物研究所梁红斌副研究员对部分步甲科标本的鉴定,感谢上海师范大学汤亮老师对隐翅虫标本的鉴定。
参考文献(References):
[1] 任国栋, 张润志, 石福明. 昆虫分类与多样性. 北京: 中国农业科学技术出版社, 2005: 133- 142.
[2] Irmler U. The spatial and temporal pattern of carabid beetles on arable fields in northern Germany (Schleswig-Holstein) and their value as ecological indicators. Agriculture, Ecosystems & Environment, 2003, 98(1/3): 141- 151.
[3] Butterfield J, Luff M L, Baines M, Eyre M D. Carabid beetle communities as indicators of conservation potential in upland forests. Forest Ecology and Management, 1995, 79(1/2): 63- 77.
[4] Noss R F. Indicators for monitoring biodiversity: a hierarchical approach. Conservation Biology, 1990, 4(4): 355- 364.
[5] Hanavan R P, Bosque-Pérez N A,Schotzko D J, Guy S O, Eigenbrode S D. Early-season aerial adult colonization and ground activity of pea leaf weevil (Coleoptera: Curculionidae) in pea as influenced by tillage system. Journal of Economic Entomology, 2008, 101(5): 1606- 1613.
[6] Jung J K, Kim S T, Lee S Y, Park C G, Park J K, Lee J H. A comparison of diversity and species composition of ground beetles (Coleoptera: Carabidae) between conifer plantations and regenerating forests in Korea. Ecological Research, 2014, 29(5): 877- 887.
[7] 陈又清, 李巧, 王思铭. 紫胶林-农田复合生态系统地表甲虫多样性——以云南绿春为例. 昆虫学报, 2009, 52(12): 1319- 1327.
[8] 李巧, 陈又清, 陈彦林, 严伟伟, 王思铭. 紫胶林-农田复合生态系统甲虫群落多样性. 生态学报, 2009, 29(7): 3872- 3881.
[10] 于晓东, 罗天宏, 杨建, 周红章. 卧龙自然保护区落叶松林不同恢复阶段地表甲虫的多样性. 动物学研究, 2006, 27 (1): 1- 11.
[11] 于晓东, 罗天宏, 周红章. 东灵山地区地表甲虫群落组成及季节变化. 昆虫学报, 2002, 45(6): 785- 793.
[12] 于晓东, 罗天宏, 周红章. 林业活动和森林片断化对甲虫多样性的影响及保护对策. 昆虫学报, 2006, 49(1): 126- 136.
[13] 于晓东, 罗天宏, 周红章. 四川蜂桶寨国家自然保护区地表甲虫物种多样性. 昆虫学报, 2003, 46(5): 609- 616.
[14] 于晓东, 周红章, 罗天宏. 云南西北部地区地表甲虫的物种多样性. 动物学研究, 2001, 22(6): 454- 460.
[15] 于晓东, 周红章, 罗天宏. 东灵山地区大步甲属物种分布和季节变化的多样性格局. 生态学报, 2002, 22(10): 1724- 1733.
[16] 于晓东, 罗天宏, 周红章, 杨建. 边缘效应对卧龙自然保护区森林-草地群落交错带地表甲虫多样性的影响. 昆虫学报, 2006, 49(2): 277- 286.
[17] 于晓东, 罗天宏, 周红章. 横断山区东部四种林型地表甲虫的物种多样性. 动物学研究, 2004, 25(1): 7- 14.
[18] 杨丽红, 郑发科. 四川小寨子沟自然保护区地表甲虫多样性. 四川动物, 2007, 26(4): 733- 737.
[19] 张倩, 郑发科, 钟志宇. 江西武夷山自然保护区地表甲虫多样性. 四川动物, 2008, 27(1): 3- 6.
[20] 潘林. 千岛湖片段化生境中地表甲虫类群多样性的研究[D]. 金华: 浙江师范大学, 2015: 42- 44.
[21] Sroka K, Finch O D. Ground beetle diversity in ancient woodland remnants in north-western Germany (Coleoptera, Carabidae). Journal of Insect Conservation, 2006, 10: 335- 350.
[22] 杭佳, 石云, 刘文惠, 贺达汉. 宁夏黄土丘陵区不同生态恢复生境地表甲虫多样性. 生物多样性, 2014, 22 (4): 516- 524.
[23] 王玉, 高光彩, 付必谦, 吴专. 北京野鸭湖湿地地表甲虫群落组成与空间分布格局. 生物多样性, 2009, 17(1): 30- 42.
[24] Magura T, Elek Z, Tóthmérész B. Impacts of non-native spruce reforestation on ground beetles. European Journal of Soil Biology, 2002, 38(3/4): 291- 295.
[25] Magura T, Tóthmérész B, Elek Z. Diversity and composition of carabids during a forestry cycle. Biodiversity & Conservation, 2003, 12: 73- 85.
[26] Magura T, Tóthmérész B, Molnár T. Changes in carabid beetle assemblages along an urbanisation gradient in the city of Debrecen, Hungary. Landscape Ecology, 2004, 19(7): 747- 759.
[27] Magura T, Tóthmérész B, Bordán Z. Effects of nature management practice on carabid assemblages (Coleoptera: Carabidae) in a non-native plantation. Biological Conservation, 2000, 93(1): 95- 102.
[28] 顾伟, 马玲, 刘哲强, 焦玥, 王利东, 张琛. 凉水自然保护区不同林型地表甲虫物种多样性. 东北林业大学学报, 2014, 42(1):131- 135.
[29] Lomolino M V. Elevation gradients of species. density: historical and prospective views. Global Ecology and Biogeography, 2001, 10(1): 3- 13.
[30] 王辉, 秦树林. 吉林省蛟河林业实验区管理局森林资源现状及可持续经营对策. 林业勘查设计, 2012, (2):2- 5.
[31] 刘生冬, 高文韬, 李燕, 施莹, 孟庆繁. 张广才岭南段不同林分天牛科昆虫物种多样性比较. 北京林业大学学报, 2015, 37(5): 110- 118.
[32] 戈峰. 昆虫生态学原理与方法. 北京:高等教育出版社, 2008, 254- 255.
[33] 马克平, 刘玉明. 生物群落多样性的测度方法Ⅰα多样性的测度方法(下).生物多样性,1994, 2(4): 231- 239.
[34] 朱纪元, 李景科, 程赛赛, 闫龙, 胡媛媛, 曹阳, 倪娟平, 刘俊, 王继富, 高梅香. 小兴安岭阔叶红松林局地尺度地表鞘翅目成虫群落结构. 东北林业大学学报, 2016, 44(12): 57- 63.
[35] 仲雨霞. 北京野鸭湖湿地自然保护区甲虫群落多样性及其动态分布的研究[D]. 北京: 首都师范大学, 2007.
[36] 刘生冬, 孟庆繁, 高文韬, 李燕. 张广才岭南段阔叶红松林天牛科昆虫物种多样性与成虫出现期时间动态. 林业科学, 2016, 52(2): 74- 81.
[37] 贾凤龙, 梁铬球, 陈振耀, 庞虹, 谢委才, 陈里娥, 叶桂栋. 梧桐山甲虫物种多样性. 生物多样性, 2000, 8(2): 169- 171.
[38] Aldhafer H M, Abdel-Dayem M S, Aldryhim Y N, Fadl H H, El-Torkey A M, Elgharbawy A A, Setyaningrum H. Diversity and composition of ground-dwelling beetle assemblages (Insecta: Coleoptera) in Rawdhat Khorim National Park, Kingdom of Saudi Arabia. Journal of Arid Environments, 2016, 127: 187- 191.
[39] 杨贵军, 贺海明, 王新谱. 盐池荒漠草地拟步甲昆虫群落时间结构和动态. 应用昆虫学报, 2012, 49(6): 1610- 1617.
[40] 谢喃喃. 中国罗霄山脉隐翅虫科区系特征及多样性初步研究[D]. 上海: 上海师范大学, 2015.
