支架或导管缓解恶性大肠梗阻的临床疗效对比研究
2018-05-16杨银山李林李玉雯李定坤赵玲
杨银山,李林,李玉雯,李定坤,赵玲
(云南省肿瘤医院微创介入医学科,云南 昆明 650118)
晚期癌症患者特别是由盆腔或腹部肿瘤导致的肠梗阻,称为恶性肠梗阻。临床上胃癌、结直肠癌及卵巢癌等均可引发恶性肠梗阻,目前国内外微创及盆腔手术后肠梗阻发病率呈逐年上升趋势,严重威胁了患者的身体健康及生命安全[1]。针对可实施根治术治疗的恶性大肠梗阻者,一期手术代替分期手术已成为当前主流,而术前的全身营养状况及肠黏膜水肿情况直接决定了一期手术是否可以吻合成功[2]。恶性肠梗阻的治疗方式的选择取决于梗阻的性质、类型、部位、程度及患者的全身状况,主要有保守疗法与手术两大类,其中保守疗法包括补液、禁食、胃肠道减压、抗炎等,手术有灌肠、经肛肠梗阻导管(transanal drainage tube,TDT)与自膨式金属支架(self-expanding metallic stent,SEMS)置入内镜架桥治疗等[3-4]。据报道,经内镜治疗对患者的肠梗阻症状具有一定的缓解作用,不但可以有效降低肠壁炎症水肿及肠腔压力,使经口肠道的准备通路恢复,而且还可以让患者获得肠内营养(enteral nutrition,EN)[5]。本研究旨在通过对比分析TDT与SEMS置入内镜架桥治疗在恶性大肠梗阻患者中的临床疗效,以期为恶性大肠梗阻患者的治疗提供一定的理论依据。
1 资料与方法
1.1 研究对象
回顾性分析2016年8月至2017年9月在云南省肿瘤医院接受诊治的72例恶性大肠梗阻患者的临床资料。入选标准:(1)大肠恶性肿瘤引发急性肠梗阻的患者;(2)临床资料完整者;(3)符合相关手术指征者。排除标准:(1)哺乳期或妊娠期女性患者;(2)合并重要脏器功能受损者;(3)不愿配合此次研究者。本研究经本院医学伦理委员会批准,患者家属知情同意此次研究并签署相关知情同意书。随机将入选者分成S组(SEMS治疗)和T组(TDT治疗)两组,每组36例。T组中男性22例,女性14例,平均年龄(63.3±14.7)岁;根据肿瘤进展情况分类,局部进展17例,复发5例,转移14例;根据狭窄部位分类,左半结肠19例,右半结肠4例,直肠5例,下行结肠8例。S组中男性20例,女性16例,平均年龄(64.2±15.1)岁,根据肿瘤进展情况分类,局部进展16例,复发4例,转移16例;根据狭窄部位分类,左半结肠17例,右半结肠2例,直肠4例,下行结肠13例。两组患者的一般资料无统计学意义(P>0.05),具有可比性。
1.2 研究方法
所有操作均由具有丰富操作经验的临床医师完成。治疗方法:(1)S组:选用由南京微创有限公司生产的MTN-CG型记忆钛镍合金肠道支架置入。肠道准备:对梗阻远端肠道进行充分地清洁灌洗处理;进镜方式:将内镜进至肿瘤狭窄部位(狭窄严重者则采用奥林巴斯公司生产的GIF-XP260型超细内镜),在内镜指引下放置斑马导丝,退镜并检测狭窄病灶的长度。根据肿瘤的狭窄程度及其对肠管侵犯的长度选择合适支架,借助导丝循内镜钳道把支架放置于狭窄部位。(2)T组:采用由大连库利艾特医疗制品有限公司生产的规格为18DBR3000TO G/W1.24mm(0.049”)3500 肠梗阻导管套件经鼻/肛插入。肠道准备工作及进镜方式与S组相同。置入肠梗阻导管直至气囊越过肿瘤狭窄部位。将灭菌蒸馏水注入气囊内,确保气囊停留在狭窄处近端。
观察指标:(1)两组患者的年龄、性别等一般资料。(2)两组患者的临床疗效,分别从操作成功率、术后并发症发生率及临床症状缓解情况三方面进行评价。(3)EN通路建立时长:腹胀及腹痛症状显著缓解,于肛门排气后口服营养补充(ONS),观察并记录至开放ONS所需时长;患者术后生活质量情况:采用卡氏功能状态量表(KPS)进行评估。(4)随访所有入选患者,随访内容包括单纯使用ONS或手术及化疗的治疗选择、术后吻合口瘘发生率等。
1.3 统计学分析
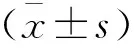
2 结果
2.1 手术相关指标
表1可见,两组患者的手术时机选择、吻合口瘘率及手术选择等手术相关指标无统计学意义(P>0.05)。
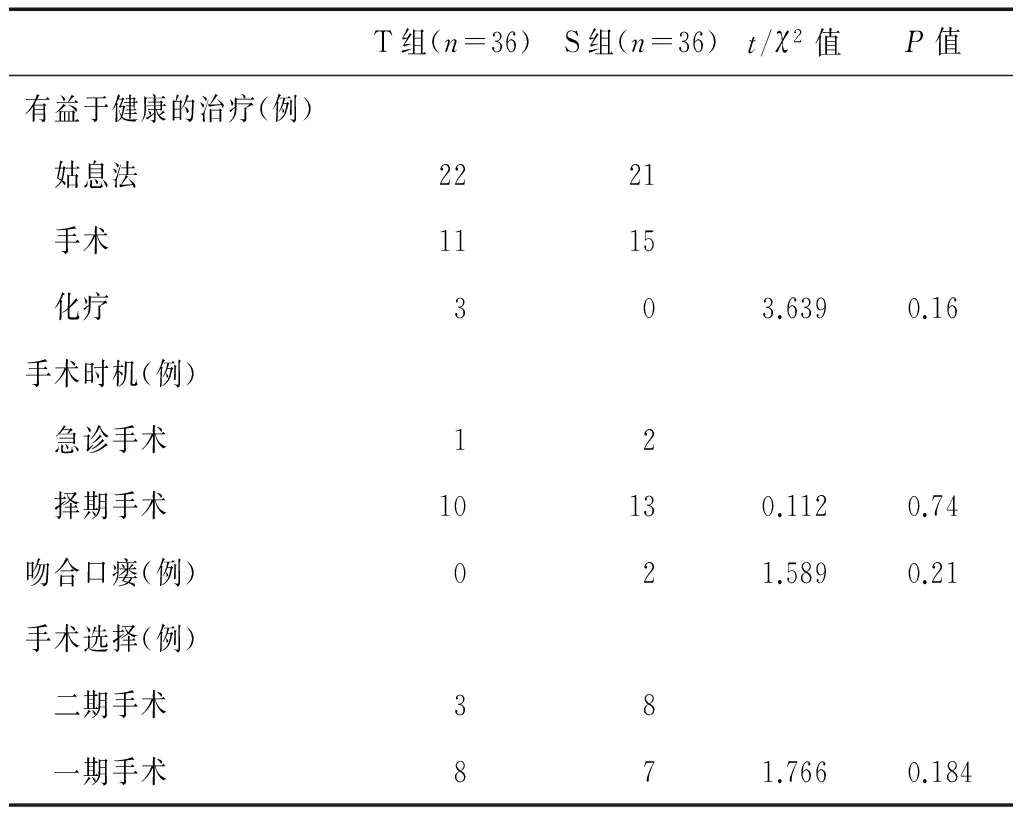
表1 两组患者的手术相关指标比较
2.2 临床疗效及不良反应
表2可见,两组患者的技术成功率均为100%;治疗后两组患者的临床症状缓解率及并发症发生率均无明显统计学差异(P>0.05),但T组患者恢复ONS时间明显短于S组,KPS评分明显高于S组(P<0.01)。
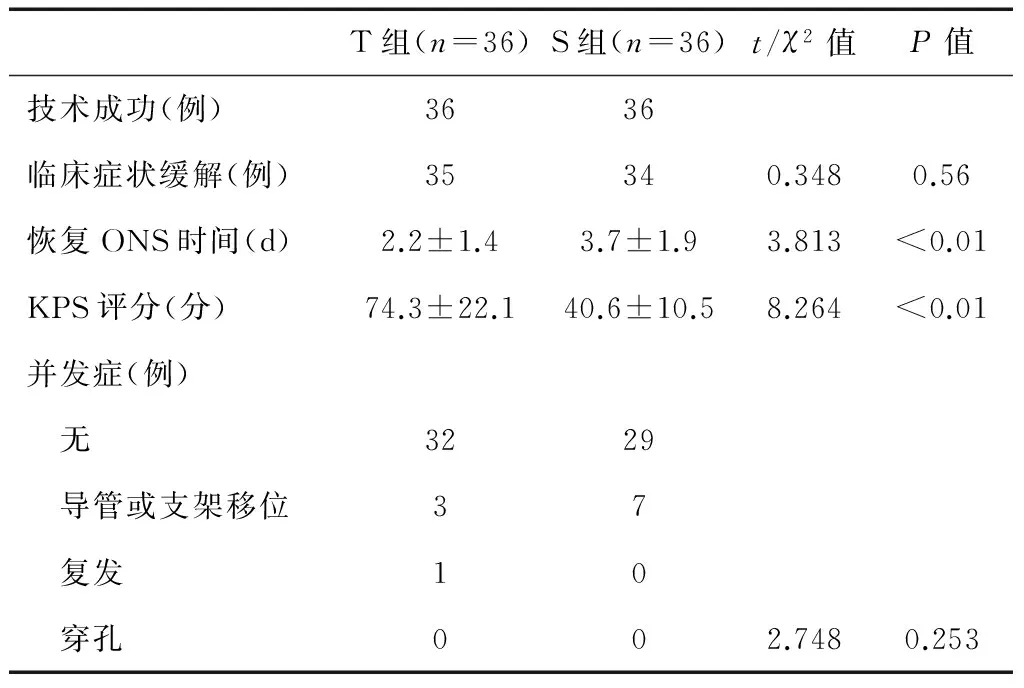
表2 两组患者临床疗效比较
3 讨论
结直肠癌晚期患者往往会出现大肠恶性梗阻现象,部分失去手术机会者会通过使肠道姑息性通畅及恢复EN的方法提高生活质量,而有手术机会者则可通过恢复肠道通畅及缓解肠壁水肿、开放EN通路等方式改善自身营养状况及增进肠功能,以便给一期手术创造良好环境[6]。目前SEMS与TDT置入是临床上治疗大肠恶性梗阻者的两种主要无创内镜技术,也是EN通路恢复的主要手段[7]。
本研究结果显示,两组患者的技术操作成功率均为100.0%,TDT组与SEMS组分别由97.2%、94.4%者通过开放通路治疗后临床症状(腹胀及腹痛等)显著缓解,经导管或者支架可排气排便。后续随访期间两组患者均未出现任何穿孔现象,T组与S组并发症发生率分别为8.3%、19.4%。
TDT以梗阻近端的侧孔将肠腔内容收集至引流袋,尽管冲洗及时,下消化道内的固体粪便也会在减压时堵塞管腔,因此导管护理尤为关键[8]。虽然SEMS固定球囊膨胀后一般不会出现脱出现象,但本研究中仍有部分患者导管移位。T组患者KPS评分明显高于S组(P<0.01),考虑原因可能是多数接受SEMS者惧怕导管滑脱,不愿尝试自行排便,同时活动量明显降低;此外,部分患者经肛置管治疗后肛周出现不适。肠梗阻导管因为是硅胶材料所以比金属支架对于肠道的损伤要小很多,而且放置的位置更远;支架仅仅解决最多十公分的狭窄,但是肠梗阻导管解决的更远,对于肿瘤性的狭窄一般范围比较广,所以常常需要双通道肠梗阻导管植入才能取得更好的效果[9-10]。
本研究结果显示,两组患者治疗后临床症状的缓解情况无明显统计学差异,此结果与以往的相关研究结果相似[11]。此外,T组患者在大肠梗阻解除后恢复ONS的时间明显短于S组;在进一步行手术治疗者中,我们发现S组行手术治疗者中有53.3%者由于黏膜水肿未能得到明显改善而选择分期手术,13.3%者术后发生吻合口瘘,说明围手术期及时予以ONS支持治疗尤为关键。大肠梗阻解除后需在最短时间内恢复EN支持,围手术期予以EN或者ONS治疗可明显改善患者的内环境稳态不平衡及糖代谢紊乱状况,减少术后死亡及并发症发生风险,故TDT在开放EN通路方面比SEMS优秀[12]。
总之,SEMS与TDT均是恶性大肠梗阻者的有效缓解手段,虽然TDT存在并发症发生风险,但是其对大肠梗阻的缓解效果及减压方面等均比SEMS优秀,针对可行根治性切除术者,TDT可以让患者获得围术期相应的营养支持治疗,减少了术后并发症发生风险。
参考文献
[1] Kim DH,Kim B,Choi JH,etal.Tumor characteristics associated with malignant large bowel obstruction in stage IV colorectal cancer patients undergoing chemotherapy[J].Int J Colorectal Dis,2016,31(11):1767-1774.
[2] Kelley KM,Myer BS,Berger JJ.Malignant Large Bowel Obstruction:A Rare Presentation of Metastatic Pancreatic Cancer[J].Am Surg,2016,82(8):206-208.
[3] Costa SMP,Palmela C,Ferreira R,etal.Self-Expandable Metal Stents for Colorectal Cancer:From Guidelines to Clinical Practice[J].GE Port J Gastroenterol,2016,23(6):293-299.
[4] Mikhail MA,Mohabbat AB,Ghosh AK.Perioperative Cardiovascular Medication Management in Noncardiac Surgery:Common Questions[J].Am Fam Physician,2017,95(10):645-650.
[5] Kobborg M,Broholm M,Frostberg E,etal.Short-term results of self-expanding metal stents for acute malignant large bowel obstruction[J].Colorectal Dis,2017,19(10):365-371.
[6] Canena J.Palliative Stenting for Malignant Large Bowel Obstruction:Stents for All?[J].GE Port J Gastroenterol,2017,24(3):110-113.
[7] Okafor PN,Stobaugh DJ,Wong KSLM,etal.Socioeconomic Inequalities in the Utilization of Colorectal Stents for the Treatment of Malignant Bowel Obstruction[J].Dig Dis Sci,2016,61(6):1669-1676.
[8] Venara A,Barbieux J,Colas PA,etal.Primary Surgery for Malignant Large Bowel Obstruction:Postoperative Nasogastric Tube Reinsertion is Not Mandatory[J].World J Surg,2017,41(7):1903-1909.
[9] Abelson JS,Yeo HL,Mao J,etal.Long-term Postprocedural Outcomes of Palliative Emergency Stenting vs Stoma in Malignant Large-Bowel Obstruction[J].JAMA Surg,2017,152(5):429-435.
[10] Arezzo A,Balague C,Targarona E,etal.Colonic stenting as a bridge to surgery versus emergency surgery for malignant colonic obstruction:results of a multicentre randomised controlled trial (ESCO trial)[J].Surg Endosc,2017,31(8):3297-3305.
[11] Heriot AG.Colonic stenting in malignant large bowel obstruction:an unanswered question[J].ANZ J Surg,2016,86(10):742-743.
[12] Matsuda A,Miyashita M,Matsumoto S,etal.Comparison between metallic stent and transanal decompression tube for malignant large-bowel obstruction[J].J Surg Res,2016,205(2):474-481.
