组蛋白去乙酰化酶抑制剂S25的代谢稳定性和表型研究
2018-05-16温琥玲田瑞敏文丹胥正敏
温琥玲,田瑞敏,文丹,胥正敏
(1.川北医学院附属医院核医学科;2.川北医学院药物研究所;3.川北医学院药学院,四川 南充 637000)
近年来,组蛋白酶去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)成为肿瘤靶向治疗研究领域的新热点。组蛋白去乙酰化酶通过去除组蛋白的乙酰基使DNA紧密的缠绕在组蛋白上,导致DNA不易被相应的基因转录因子接触;进而使受损细胞凋亡,周期阻滞、分化等相关的蛋白表达受到抑制,促进肿瘤的发生发展[1]。HDACI通过增加肿瘤细胞内组蛋白的乙酰化程度,改变细胞周期、细胞凋亡相关基因表达水平,诱导肿瘤细胞分化,抑制肿瘤增殖和(或)促进细胞凋亡,抑制肿瘤细胞侵袭、转移和肿瘤血管生成等;发挥肿瘤治疗或预防的作用[2-5]。依据HDACI结构不同,分为四类:脂肪酸、氧肟酸盐、环肽和苯酰胺类,S25是本实验室新合成的苯酰胺类HDACI[6]。新合成的化合物的代谢性质关系到整个化合物是否能够成药,并真正的运用到临床的重要影响因素。肝微粒体是药物代谢的主要场所[7],在本研究中,我们将通过体外构建的包括人在内的不同种属肝线粒体系统研究S25药物的代谢特征,为该药的进一步基础和临床研究奠定基础。
1 材料与方法
1.1 试剂与仪器
S25:由本实验室合成;大鼠肝微粒体(RLM)、人肝微粒体(HLM)、犬肝微粒体(DLM)、猴肝微粒体(MLM)、小鼠肝微粒体(MouLM)购自武汉普莱特生物医药技术有限公司,于-80 °C冷冻保存;NADPH发生系统:A液、B液,购自武汉普莱特生物医药技术有限公司,于-80 °C冷冻保存;去离子水:Milli-Q实验室自制;甲醇:色谱纯,批号166578,Fisher Scientific公司;乙腈:色谱纯,批号155174,Fisher Scientific 公司;甲酸:色谱纯,纯度99%,ACROS ORGANICS。
超高效液相色谱(UPLC)系统:SIL-30AC autosampler,LC-30AD chromatograph,CBM-20A communications bus module,CTO-20AC prominence column oven,购自SHIMADZU公司。三重四极杆质谱(MS):AB SCIEX QTRAP5500质谱仪。色谱柱:Waters Acquity UPLCTM BEH C18 column(2.1×50 mm,1.7 μm);Thermo Heraeus Fresco 17低温冷冻离心机(Thermo Scientific公司);230V-UK涡旋混合器(Labnet International公司);电子天平(赛多利斯仪器(北京)有限公司);移液枪(德国 Eppendorf公司)恒温水浴锅:DF-101S,购自北京市长风仪器仪表公司。
1.2 方法
1.2.1 对照品溶液配制 精密称取一定量的S25,用甲醇溶解成1 mg/mL的储备液,4 ℃保存,待用。精密称取一定量的内标苯酰胺类HDACI辛二酰苯胺异羟肟酸(Suberoylanilide Hydroxamic Acid,SAHA),用甲醇溶解成1 mg/mL的储备液,4 ℃保存,待用。
1.2.2 UPLC-MS/MS条件 (1)色谱条件:色谱柱Waters Acquity UPLCTM BEH C18 column(2.1×100 mm,1.7 μm);流速 0.3 mL/min;样品室温度15 ℃;柱温30 ℃;进样体积1 μL;流动相A 0.1%甲酸水,B 甲醇,梯度洗脱见表1。(2)质谱条件:电喷雾离子化(ESI)方式,检测离子为正离子,MRM模式;毛细管电压5 kV,离子源温度500 ℃,帘气 20 L/h, 去簇电压(DP)120 V。S25和内标化合物的MRM检测条件,见表2。

表1 S25流动相梯度洗脱条件
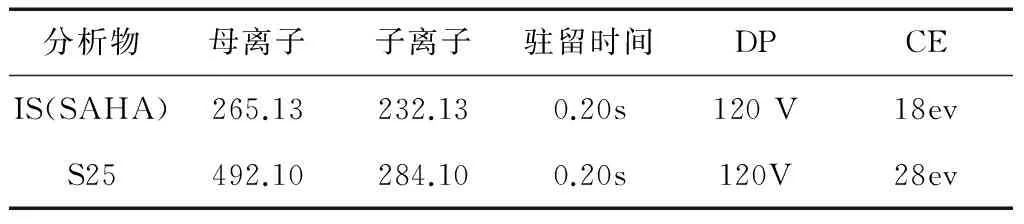
表2 F18和SAHA质谱参数优化
1.2.3 S25在不同种属肝微粒体中代谢稳定性 孵育体系总体积为100 μL,体系包括0.1M pH 7.4 的PBS 94 μL,A液 5 μL,B液 1 μL;在冰浴上加入1 μL S25溶液(浓度100 μM),37 ℃水浴预孵育5 min,分别加入2.5 μL各种属肝微粒体溶液,继续温孵0,5,15,30,45,60,60 min后加500 μL的含内标50 ng/mL的冰乙腈终止反应,涡旋混匀3 min,13 000 rpm离心15 min,取上清液,进样。上述每组样品均平行操作3份。
1.2.4 S25体外代谢动力学参数分析 以各孵育时间点的浓度与孵育0 min时间点S25的浓度相比得剩余百分量,将各时间点的剩余百分量的自然对数对孵育时间作线性回归,求算得斜率k,根据以下公式可以计算得到半衰期和清除率。其中人、大鼠、比格犬、猴、和小鼠的相关的理化参数如下: Liver (g) / BW (kg) 分别为22、40、33、33 和87.5;Microsomes (mg) / Liver (g)为45[8]。
t1/2=-0.693/k
1.2.5 S25在大鼠肝微粒体中代谢表型 按上述稳定性实验孵育体系,冰浴上加1 μL浓度为100 μM的S25,1 μL各选择性化学抑制剂,在37 ℃水浴中预热5 min,然后冰浴上加入2.5 μL的肝微粒体酶,轻轻混匀。37 ℃水浴中孵育60 min,反应完毕之后加入500 μL含SAHA浓度为50 ng/mL的乙腈溶液(4 ℃)终止反应。
另设定未发生反应样品为阴性对照组(不加NADPH发生系统,不加抑制剂,只加入等量甲醇);设定完全发生反应为阳性对照组(加入NADPH发生系统,但不加抑制剂,只加入等量甲醇)。采用UPLC-MS/MS方法检测S25原形剩余含量,考察不同选择性抑制剂对S25代谢的影响。用待测物的消除速率表示待测物在微粒体孵育体系中的代谢速率;用Excel、Graphpad prism 5.0和SPSS statistics17.0软件数据处理系统进行数据处理和制图。

2 结果
2.1 专属性
按照“1.2.5”项条件,分别制备实验肝微粒体温孵液样品加内标,灭活肝微粒体空白液样品,再进行LC-MS分析该方法的专属性[9-10]。S25和内标SAHA达到基线分离,分离度良好,二者的保留时间分别是2.61 min和3.10 min,提示该方法专属性良好(图1)。

2.2 准确度、精密度和基质效应测定
于灭活肝微粒体中加入S25,分为低、中、高3个质量浓度标准液:31.25、125、400 ng/mL,每个质量浓度5个平行样品;分析计算各质量浓度样品回收率,表示准确度。同样方法制备系列质控样品,日内分别进3次,连续3 d各进样1次,计算日内、日渐精密度,用相对标准偏差(RSD%)表示。由表3可见,该药回收率99.41%~106.42%,日内和日间精密度均小于15%,表明该方法具有较好的精密度和准确度。同样用测定准确度和精密度的方法制得S25质控样品,同时配制相同质量浓度的S25对照品溶液,LC-MS分析检测到峰面积分别为A和B,抑制抑制率为=(1-A/B)×100%,基质效应表示为=A/B×100%。其机制抑制率1.09%~6.81%(表3),小于15%,提示该提取方法无基质效应。
2.3 S25在不同种属肝微粒体中的代谢稳定性
由S25在人、大鼠、小鼠、犬和猴肝微粒体中孵育时间和底物剩余百分比作散点图可见,S25在这5种属肝微粒体中均有明显代谢;并将S25剩余百分数的自然对数和孵育时间用线性回归分析(图2),S25在各种属肝微粒体中0~60 min均呈现良好线性关系。其代谢动力学参数见表4,S25在人、小鼠两种属肝微粒体中代谢较快且较相近,半衰期T1/2不足1 h,分别在45 min和43.31 min,在大鼠、猴和犬肝微粒体中代谢半衰期时间较长,2~4 h,与人肝微粒体中代谢时间相差较大;在人和小鼠两个种属中的代谢清除率也半衰期一样接近。
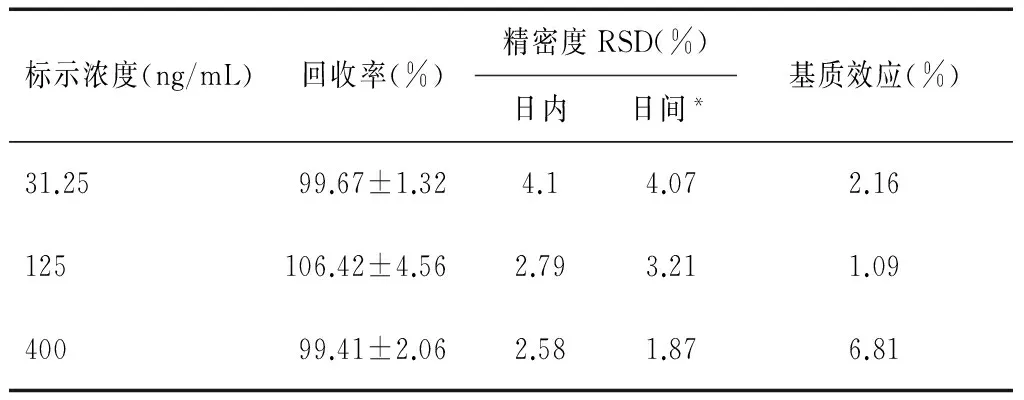
表3 S25的准确度、精密度和基质效应测定结果(n=5)
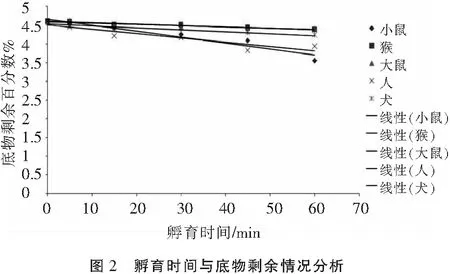
表4 S25在人、小鼠、大鼠、犬和猴肝微粒体中代谢稳定性测定结果
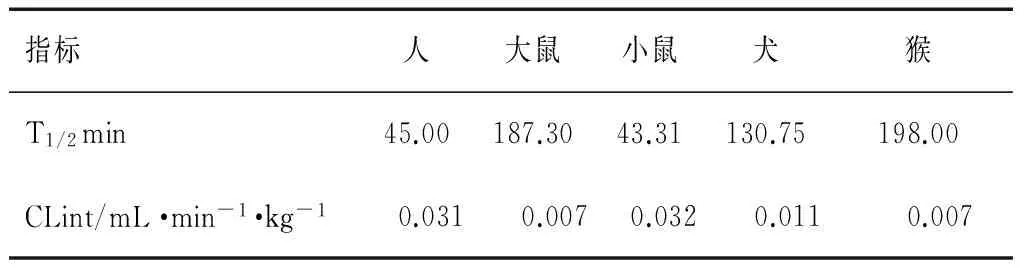
指标人大鼠小鼠犬猴T1/2min45.00187.3043.31130.75198.00CLint/mL·min-1·kg-10.0310.0070.0320.0110.007
2.4 S25在人肝微粒中代谢表型的确定
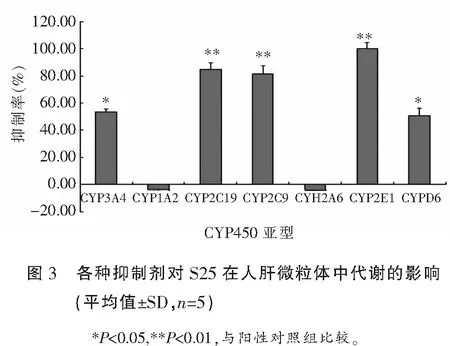
人肝微粒体中各选择性P450化学抑制剂对S25的代谢酶活性的影响见表5和图3。二乙基二硫代氨基甲酸钠(CYP2E1特异性抑制剂) ,盐酸塞氯匹定(CYP2C19特异性抑制剂) 和抑制剂磺胺苯吡唑(CYP2C9抑制剂)对人肝微粒体中S25的代谢酶活性抑制率分别是99.99%、84.64%和81.43%,与不加化学抑制剂的阳性对照组相比,代谢酶活性差异均有统计学意义(P<0.01);其他抑制剂如α-奈黄酮(CYP1A2)和毛果芸香碱(CYP2A6)对人肝微粒体中S25的代谢酶活性抑制与不加化学抑制剂的阳性对照相比代谢酶活性无统计学意义(P>0.05);表明CYP2E1,CYP2C19和CYP2C9可能是主要参与代谢S25的酶表型。
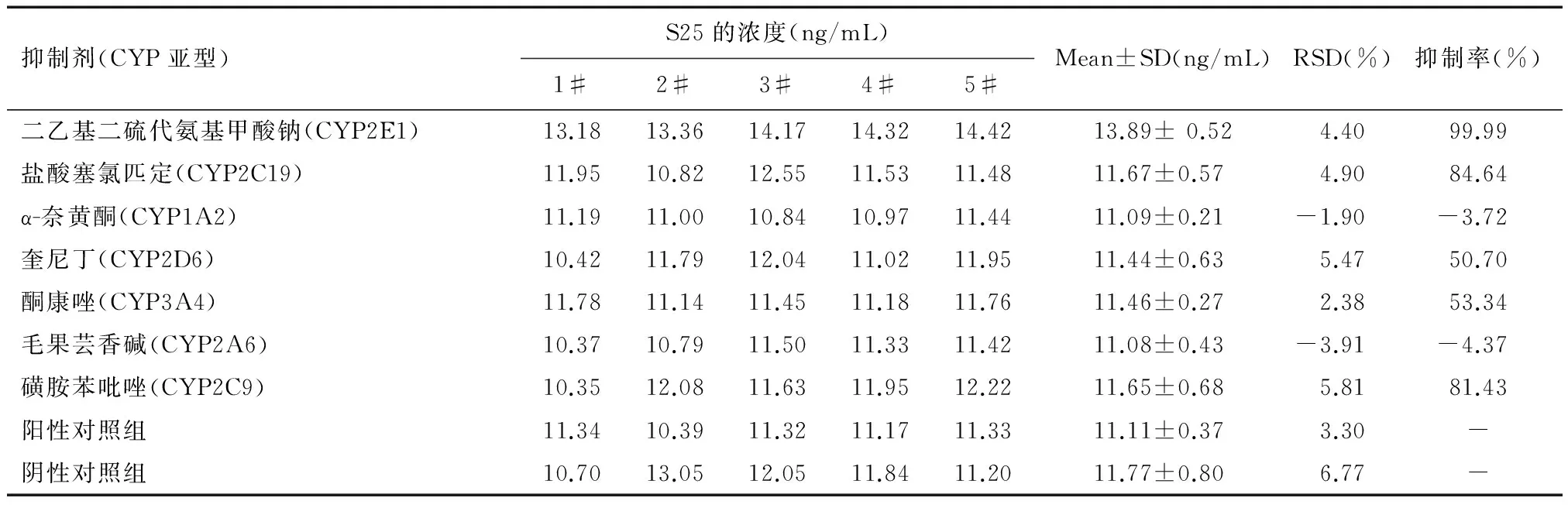
表5 各抑制剂对人肝微粒中S25代谢的影响
3 讨论
组蛋白乙酰化使染色体构型发生改变而变得疏松,有利于DNA与转录因子结合。正常状态下组蛋白乙酰化和去乙酰化转移酶处于相对平衡状态。当细胞发生转化后,去乙酰化酶活性增强,调控细胞周期和增殖凋亡的基因表达失控,从而使细胞发生异常增殖而恶变。HDACI能使抑癌基因活化,重新调控细胞周期,诱导肿瘤细胞凋亡而具有潜在的临床意义[11]。目前,已有部分HDACI运用于临床治疗乳腺癌、肺癌等实体肿瘤,也有用于血液系统肿瘤如急性早幼粒细胞白血病(APL)和急性髓性白血病(AML)等[12]。由此可见组蛋白去乙酰化酶抑制剂是抗肿瘤药物研究的热点。
S25系本实验室合成的新型组蛋白去乙酰化酶抑制剂,目前还没有其作为新药运用前的代谢动力学方面的研究。因此本实验建立了人肝微粒体中S25的UPLC-MS/MS检测方法,其线性、准确度、精密度、基质效应和专属性均符合生物样品的测定标准。由本实验的代谢稳定性实验结果可见,S25在人和小鼠中的代谢半衰期较短,而与其它3种种属中代谢半衰期相比差异较大。由此可见,药物动物实验和临床前实验数据推测临床给药方案时,要注意种属或个体的代谢速率差异。
候选化合物在不同种属的肝微粒体中的代谢稳定性和代谢表型研究对于化合物体内的代谢性质有很好的预测作用,是药物开发前期评估候选化合物的有效手段[13]。代谢稳定性的结果提示小鼠与人的代谢性质比较接近,大鼠、犬和猴的代谢性质和人差异比较大,后期实验动物的选择可以通过这个结果来做出比较好的判断;代谢表型的实验结果表明肝微粒体中主要参与S25的代谢酶可能有: CYP2E1,CYP2C9,和 CYP2C19,;而CYP1A2和CYP2A6对S25则没有明显的代谢作用。S25有多种酶代谢,这将降低由于体内某种酶被特异性抑制或诱导而导致的严重不良反应的风险。本研究确定了该药物在人肝微粒体中的代谢稳定性以及该药物的代谢表型,为今后对该药物进行进一步的代谢机制方面的研究奠定了基础。
参考文献
[1] Bereshchenko OR,Gu W,Dalla-Favera R.Acetylation inactivates the transcripitional repressor BCL6[J],Nature Genetics,2002,32(4):606-613.
[2] Smith BC,Denu JM.Chemical mechanisms of histone lysine and arginine modifications[J].Biochim Biophys Acta,2009,1789(1):45-57.
[3] Yoshida M,Kijima M,Akita M,etal.Potent and specific inhibition of mammalian histone deacetylase both in vivo and in vitro by trichostatin A[J].J Biol Chem,1990,265(28):17174-17179.
[4] Sanchez R,Zhou MM.The role of human bromodomains in chromatin biology and gene transcription[J].Curr Opin Drug Discov Devel,2009,12(5):659-665.
[5] Gregoretti IV,Lee YM,Goodson HV.Molecular evolution of the histone deacetylase family:functional implications of phylogenetic analysis[J].J Mol Biol,2004,338(1):17-31.
[6] WangH,LimZY,ZhouY,etal.Acylurea connected straight chain hydroxamates as novel histone deacetylase inhibitors:Synthesis,SAR,and in vivo antitumor activity[J].Bioorganic & Medicinal Chemistry Letters,2010,20(11):3314-3321.
[7] Jang Su Jeon,Soo Jin Oh,Ji-Yoon Lee,etal.Metabolic characterization of meso-dihydroguaiaretic acid in liver microsomes and in mice[J].Food and Chemical Toxicology,2015,76:94-102.
[8] Yan Z,Caldwell GW.Metabolism profiling,and cytochrome P450 inhibition & induction in drug discovery[J].Current topics in medicinal chemistry,2001,1(5):403-425.
[9] Chang LC,Gerhauser C,Song L,etal.Activity-guided isolation of constituents of Tephrosia purpurea with the phase enzyme, quinone reductase[J].J Nat Prod,1997,60(9):869.
[10] 张曼,孟志云,朱晓霞,等.毛喉鞘蕊花提取物福司可林的体外代谢研[J].药学学报,2013,48 (3):383-389.
[11] Stephen S,Andy IC,Craig O,etal.A phase I/II study of vorinostat(SAHA),cladribine(2-CdA), and rituximab shows significant activity in previously untreated mantle cell lymphoma[J],Blood,2011,118:441.
[12] Prine HM,George DJ,Pamaik A,etal.Phase study of oral LBH589,a novel deacetylase(DAC) inhibitor in advanced solid tumors and Non-Hodgkin’s lymphoma[J].J Clin Oncol,2007,25(Suppl):18s.
[13] Tucker GT,Houston JB,Huang SM.Optimizing drug development:strategies to assess drug metabolism/transporter interaction potential-toward a consensus[J].Pharm Res,2001,18(1):107-117.
