奥希替尼治疗晚期非小细胞肺癌35例
2018-05-16祝金龙秦侨西
祝金龙,卫 星,于 洋,秦侨西,张 坤,王 红
非小细胞肺癌(non small cell lung cancer, NSCLC)占肺癌的75%~80%[1],30%~40%亚裔人群非小细胞肺癌中存在表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变[2-4]。《中国晚期原发性肺癌诊治专家共识》指出:EGFR基因敏感突变并且不存在耐药基因的晚期NSCLC患者推荐使用表皮生长因子受体络氨酸激酶抑制药(epidermal growth factor receptor tyrosine kinase inhibitors ,EGFR-TKI)一线治疗[5]。大部分患者在治疗1~2年均产生耐药[6-8],其中60%的耐药为T790M突变引起[9]。奥希替尼为三代不可逆的具有T790M突变选择性的EGFR-TKI,用于T790M突变阳性EGFR-TKI耐药的晚期非小细胞肺癌患者[10,11]。 本研究探讨使用奥希替尼治疗晚期非小细胞肺癌患者的临床疗效。
1 临床资料
1.1 一般资料 选择2015-01至2016-12来军事医学科学院附属医院就诊为晚期NSCLC并使用奥希替尼的患者。(1)纳入标准:①经组织学或细胞学检查确诊为晚期NSCLC,经一线或多线治疗(使用过一代EGFR-TKIs)进展后使用奥希替尼;②ECOG体力状况评分>2;③年龄18岁以上;④经CT或MRI扫描有可测量病灶;⑤脑转移经治疗或稳定无症状者纳入其中。(2)排除标准:①合并其他肿瘤;②在使用奥希替尼前使用过其他针对T790M突变的靶向药物。共搜集35例患者,男16例(45.7%),女19例(54.3%);年龄43~75岁,平均(58.1±8.2)岁。PS评分:1分31例(88.6%),2分4例(11.4%);病理类型:腺癌34例,腺鳞癌1例;脑转移23例,无脑转移12例。T790M突变状况:阳性25例,阴性3例,未检测7例。T790M阳性合并脑转移共17例,无脑转移患者8例。
1.2 治疗方法 口服奥希替尼(AstraZeneca AB)80 mg,1/d,3周为一疗程。6周后进行疗效评价,治疗期间定期检查患者肝肾功能、血常规、心电图及CT,观察评价不良反应。
1.3 观察指标疗效评价标准 依据RECIST1.1标准,分为完全缓解 (CR)、部分缓解 (PR)、稳定(SD)、进展(PD),计算客观缓解率(ORR),疾病控制率(DCR),无进展生存期(PFS)为首次用药至疾病进展的时间。T790M检测采用数字PCR、AMARS、二代测序等方法。不良反应采用WH0抗癌药物急性及亚急性毒性反应分级标准。
1.4 统计学处理 采用SPSS 22.0软件进行分析,计量资料采用t检验,等级资料采用秩和检验,计数资料用卡方检验,生存曲线绘制采用Kaplan-Meier法,检验水准 α= 0.05。
1.5 结果 35例中,PR 16例(46%),SD 12例(34%),PD 7例(20%),客观缓解率46%,疾病控制率80%。T790M 突变阳性25例,其中使用组织行基因检测13例,使用液体行基因检测12例(包括血液11例,胸水1例); T790M阴性3例;治疗前未检测7例。T790M阳性患者与未行基因检测患者的疗效比较,差异有统计学意义(表1);T790M阳性脑转移患者的疗效差异无统计学意义(表2);液体活检与组织检测患者疗效比较差异无统计学意义(表3)。
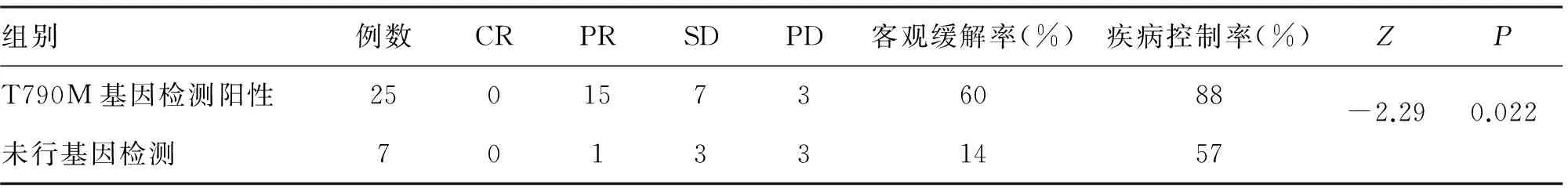
表1 T790M阳性患者与未行基因检测患者的疗效比较
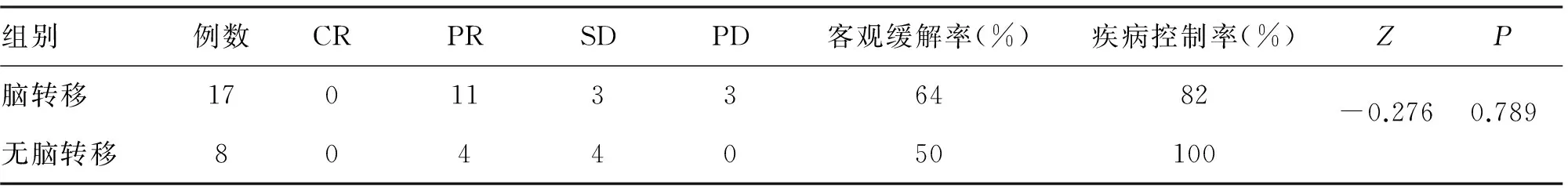
表2 T790M阳性有无脑转移患者的疗效比较
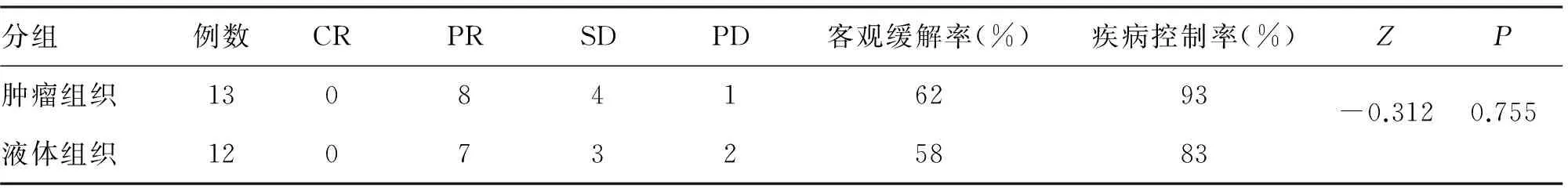
表3 液体活检与组织检测患者的疗效比较
本研究末次随访时间为2017-04,随访未超过6个月的患者4例,随访超过6个月的患者21例,其中反应持续时间超过6个月者占66%。发生血小板降低1例,患者因持续血小板降低而停药;皮疹10例(29%),腹泻7例(20%),瘙痒6例(17%),便秘4例(11%),贫血3例(9%),口腔溃疡2例(6%),肝功能损伤1例(3%),中性粒细胞减少1例(3%),心电图Q-T时间延长1例(3%);总不良反应发生率66%(23/35)。
EGFR T790M突变占一代EGFR-TKI治疗后耐药的60%。AURA1临床研究中,T790M阳性患者客观缓解率为61%,疾病控制率为95%,PFS9.9个月;T790M阴性患者客观缓解率为21%,疾病控制率为61%,PFS2.8个月。本研究中T790M阳性患者客观缓解率为61%,疾病控制率为95%,与之相似;3例T790M阴性院外自行服用奥希替尼患者,其中一线EGFR-TKI耐药后即刻使用的患者2例,疗效均为PD,1例一线EGFR-TKI耐药后经2线含铂两药化疗再次耐药后使用奥希替尼,疗效评价SD。这些结果均不建议在T790M阴性患者中使用奥希替尼。PFS数据尚不完整,随访超过6个月的患者21例,其中PFS大于6个月的患者占66.6%(14/21)。同时,化疗在T790M阳性患者中客观缓解率为39%,PFS5.3月[12,13]。初步的数据表明奥希替尼在T790M阳性患者中疗效可靠,优于T790M阴性患者,优于化疗。
2 讨 论
AURA1研究显示,T790M阴性患者EGFR-TKI耐药后立即使用奥希替尼的客观缓解率只有11%,其可能原因为EGFR-TKI的间歇效应[14]。本研究中共有7例患者一线EGFR-TKI耐药后不经基因检测直接服用奥希替尼,其客观缓解率为14%,疾病控制率为57%,明显劣于T790M阳性的患者,提示一线EGFR-TKI耐药后需进行T79OM检测,不建议直接服用奥希替尼。分析奥希替尼在T790M阳性脑转移患者中的疗效,与无脑转移的患者相比,差异无显著性,说明奥希替尼在脑转移患者中也有很好疗效[15]。另一研究表明,奥希替尼一线用于EGFR敏感突变及T790M突变患者中的ORR达77%,PFS19.3个月,与一线一、二代EGFR-TKI耐药后使用奥希替尼的总PFS一致[16]。目前,液体活检评估EGFR基因突变状态已成为选择EGFR-TKI治疗的补充手段。本研究中,液体活检与组织活检结果对比,临床疗效无差异,与Oxnard等[17]的研究结果一致。
综上所述,奥希替尼治疗T790M阳性EGFR-TKI耐药的晚期NSCLC患者临床效果显著,治疗效果优于T790M阴性患者,且不良反应发生率低,对脑转移患者也有良好效果,液体活检可作为不能行组织基因检测患者的补充手段。
【参考文献】
[1] Travis W D, Brambilla E, Muller-Hermelink H K. Pathology and genetics of tumors of the lung,pleura,thymus and heart World Health Organization classification of tumors[M]. Lyon:IARC Press,2004: 9-67.
[2] Paez J G, Jänne P A, Lee J C,etal. EGFR mutations in lung cancer: correlation with clinical response to gefitinibtherapy[J]. Science,2004(304):1497-1500.
[3] Lynch T J, Bell D W, Sordella R,etal. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med,2004(350):2129-2139.
[4] Shigematsu H, Lin L, Takahashi T,etal. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J]. J Natl Cancer Inst,2005(97):339-346.
[5] 石远凯,孙 燕,于金明,等. 中国晚期原发性肺癌诊治专家共识(2016版)[J].中国肺癌杂志, 2016,19(1):1-15.
[6] Maemondo M, Inoue A, Kobayashi K,etal. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med,2010(362):2380-2388.
[7] Rosell R, Carcereny E, Gervais R,etal. Erlotinib versus standard chemotherapy asfirst-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol,2012(13):239-246.
[8] Hu X, Han B, Gu A,etal. A single-arm, multicenter, safety-monitoring, phase IV study of icotinib in treating advanced non-small cell lung cancer (NSCLC)[J]. Lung Cancer,2014,86(2):207-212.
[9] Yu HA, Arcila M E, Rekhtman N,etal. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers[J]. Clin Cancer Res,2013(19):2240-2247.
[10] Jänne P A, Yang J C, Kim D W,etal. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J]. N Engl J Med,2015,372(18):1689-1699.
[11] Goss G, Tsai C M, Shepherd F A,etal. Osimertinib for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2): a multicentre, open-label, single-arm, phase 2 study[J]. Lancet Oncol,2016(14): S1470-2045.
[12] Chong C R, Jänne P A. The quest to overcome resistance to EGFR-targeted therapies in cancer[J]. Nat Med,2013(19): 1389-1400.
[13] Soria J, Kim S, Wu Y,etal. Gefitinib/chemotherapy vs chemotherapy in EGFR mutation-positive NSCLC resistant to first-line gefitinib: IMPRESS T790M subgroup analysis[J]. J Thorac Oncol,2015(10): S207.
[14] Oh I J, Ban H J, Kim K S,etal. Retreatment of gefitinib in patients with non-small-cell lung cancer who previously controlled to gefitinib: a single-arm, open-label, phase Ⅱstudy[J]. Lung Cancer,2012(77):121-127.
[15] Ballard P,Yates J W,Yang Z,etal. Preclinical Comparison of Osimertinib with Other EGFR-TKIs in EGFR-Mutant NSCLC Brain MetastasesModels, and Early Evidence of Clinical Brain Metastases Activity[J]. Clin Cancer Res,2016,22(20):5130-5140.
[16] Ramalingam S, Yang J C, Lee C K,etal. LBA_PR: Osimertinib as first-line treatment for EGFR mutation-positive advanced NSCLC: updated efficacy and safety results from two Phase I expansion cohorts[J]. J Thorac Oncol,2016,11(4 Suppl):S152.
[17] Oxnard G R, Thress K S, Alden R S,etal. Association between plasma genotyping and outcomes of treatment with osimertinib (AZD9291) in advanced non-small-cell lung cancer[J].J Clin Oncol,2016,34(28):3375-3382.
