3.0T磁共振扩散加权成像在前列腺癌诊断与鉴别诊断中的应用
2018-05-16常国庆夏兆云
常国庆,夏兆云
前列腺癌已成为老年男性最常见的恶性肿瘤之一,准确诊断对早期治疗,提高前列腺癌的治愈率至关重要[1,2]。近年来,磁共振弥散加权成像(diffusion weighted imaging,DWI)技术在前列腺癌影像诊断中得到了广泛认可。在此基础上,笔者进一步探讨利用超高磁场磁共振DWI分析前列腺癌、前列腺炎与良性前列腺增生(benign prostatic hyperplasia,BPH)的表面弥散系数(apparent diffusion coefficient,ADC)值的变化,以评价其在前列腺癌诊断与鉴别诊断中的应用价值。
1 对象与方法
1.1 对象 2016-07至2017-12在我院就诊的临床资料和病理结果完整的65例前列腺患者,其中前列腺癌患者21例,均经穿刺活检病理证实,未经任何治疗,年龄53~78岁,平均(65.8±7.5)岁,T-PSA 3.60~379.20 ng/ml,中位数28.21 ng/ml;前列腺炎组19例,均经穿刺活检证实,年龄45~82岁,平均(65.4±10.4)岁,T-PSA 0.60~56.20 ng/ml,中位数9.48 ng/ml;BPH组25例,均经随访或经尿道前列腺电切除手术证实,年龄53~78岁,平均(64.6±5.8)岁,T-PSA 1.30~29.20 ng/ml,中位数8.35 ng/ml。穿刺活检为超声引导下经职场穿刺,采取五分区(13针)或六分区法,并有操作医师绘图记录活检部位。
1.2 数据采集 采用 GE 3.0T HDxt磁共振成像仪,以体线圈为射频发射线圈,腹部相控阵线圈为接收线圈。对前列腺局部行轴位和冠状位压脂FSE T2WI扫描,TR 3500 ms,TE 85 ms,回波链长度19,层厚4 mm,层间距0 mm,FOV 24 cm×24 cm,NEX 4,矩阵320×256;并行前列腺局部轴位T1WI,TR 450 ms,TE 12 ms,层厚5 mm,层间距0 mm,FOV 24 cm×24 cm,NEX 2,矩阵256×192。(2)DWI为单次激发EPI序列,在前列腺和精囊范围内行轴位扫描,参数:扩散敏感系数值采用0 s/mm2与1500 s/mm2,取层面选择、频率编码、相位编码3个方向; TR 3000 ms,TE 76.7 ms, FOV 24 cm×24 cm,矩阵128×128,层厚4 mm,层间距0 mm。
1.3 图像分析 由2名医师采用盲法共同诊断,若意见不同经协商达成一致。分别分析T2WI、DWI图像对病变的位置、信号特点、范围及是否与周围侵犯、转移等方面进行评价;DWI图像经Functool 2软件进行自动后处理,生成ADC伪彩图,参照T2WI、DWI及病理检测位置,对前列腺病变区进行测量。在病灶最大层面手工描绘感兴趣区,兴趣区呈椭圆形,均位于病灶中心且未超过病灶边缘,同时避开尿道、钙化、囊变坏死灶等,每个病灶测3次ADC值并取平均值。同样方法测量BPH患者外周带和中央腺体的ADC平均值。
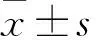
2 结 果
2.1 常规MRI表现 21例前列腺癌中,10例病灶位于外周带,6例位于中央腺体,5例同时累及周围带及中央腺体;病灶于T2WI上形态不规则,边界不清,呈低信号结节或肿块(图1A);临床分期B期8例,C期10例,D期3例。19例前列腺炎患者,13例前列腺外周带于T2WI上呈局限性或弥漫性低信号(图1D),6例表现正常。25例BPH患者中,前列腺中央带于T2WI上出现单发或多发高低不等混杂信号结节,增生结节周围见低信号假包膜,外周带受压不同程度变薄,呈均匀高信号(图1G)。

图1 前列腺癌与非前列腺癌MRI形态与信号特点
A~C.同一患者,前列腺癌。A.平扫压脂T2WI示前列腺右侧外周带低信号,累及中央腺体,边界欠清,局部包膜不连续;B.病灶DWI上呈明显高信号;C.ADC图示病灶为明显低信号,兴趣区ADC值为0.60×10-3mm2/s;D~F.同一患者,前列腺炎。D.平扫压脂T2WI前列腺左侧外周带多发片状低信号,外周带与中央腺体界限仍存在;E.病灶DWI呈不均匀高信号;F.ADC图示病灶为低信号,兴趣区ADC值为0.90×10-3mm2/s;G~I.同一患者,良性前列腺增生(BPH)。G.平扫压脂T2WI前列腺外周带与中央腺体界限清楚,中央带明显增生,呈高、低混杂信号,外周带受压变薄,呈均匀高信号;H.前列腺增生腺体DWI呈稍高信号,外周带DWI呈均匀等信号;I.ADC图示增生腺体兴趣区ADC值为1.20×10-3mm2/s;外周带兴趣区ADC值左侧为1.62×10-3mm2/s,右侧为1.75×10-3mm2/s
2.2 DWI表现及ADC值 前列腺癌病灶在DWI上均表现为明显高信号,与周围带分界不清,癌区ADC值为(0.74±0.10)×10-3mm2/s(图1B、C)。前列腺炎病灶在DWI上表现为稍高信号,ADC值为(0.98±0.07)×10-3mm2/s(图1E、F)。前列腺增生外周带呈均匀等信号,ADC值(1.38±0.14)×10-3mm2/s;中央带呈稍高、低混杂信号,ADC值为(1.21±0.09)×10-3mm2/s(图1H、1I)。四组ADC值符合正态分布(P>0.05),方差齐性检验均具有齐性(P>0.05)。ANOVA检验显示四组ADC值总体均数有统计学差异(P<0.001),L-S-D法进行两两比较,均具有统计学差异(P<0.001)。癌与炎症ADC值比较,t=7.26,P=0.00;癌与增生ADC值比较,t=15.00,P=0.00;炎性反应与增生比较,t=7.03,P=0.00;BPH外周带与中央带比较,t=5.75,P=0.00。
2.3 ADC值的ROC分析 将正常组与炎性反应组合并为非癌组,与癌组进行ROC分析,曲线下面积为0.995,P<0.001。临界点取0.95×10-3mm2/s时,敏感性为92.8%,特异性为100%(图2)。
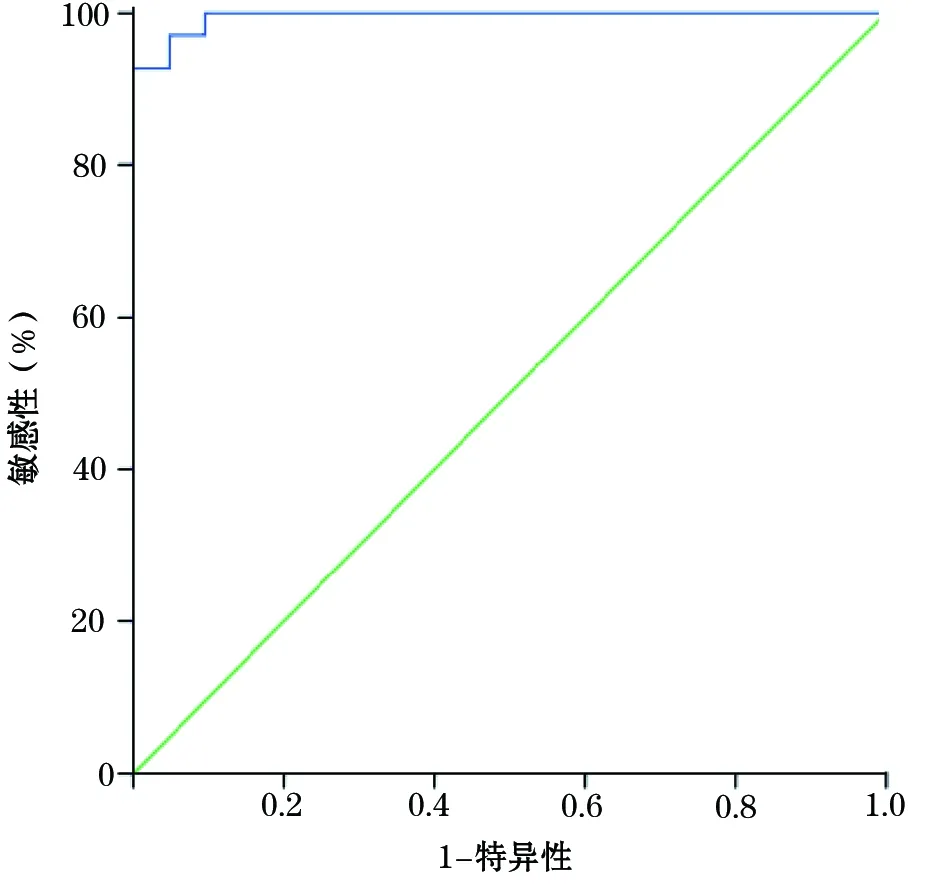
图2 癌组与非癌组ADC值的ROC曲线
ROC曲线显示曲线下面积为0.995,前列腺癌组与非癌组ADC值有显著性差异(α= 0.05,P<0.01)
3 讨 论
MRI检查具有优越的软组织分辨率、多方位、多参数成像等优点,已成为前列腺癌诊断最佳影像学方法[3]。3.0T MRI场强高、信号均匀,具有较高的信噪比(signal noise ratio,SNR),常规的T2WI平扫能较好地显示前列腺的组织结构,当前列腺外周带出现低信号结节时,应怀疑前列腺癌的可能。但是,T2WI上出现低信号并不是前列腺癌的特异性表现,慢性前列腺炎、内分泌治疗后及放疗后同样会出现前列腺外周带的T2WI低信号改变[4],因此容易误诊。再者,发生于中央腺体的前列腺癌与良性增生结节具有相似的T2WI表现,常规MRI鉴别较困难。因此,笔者利用DWI检查和ADC值定量分析对前列腺癌、前列腺炎及BPH进行鉴别诊断。
DWI能够无创地检测活体组织扩散运动能力,水分子在活体组织内的扩散与组织的空间结构有关[5]。本研究中前列腺癌在DWI上表现为明显高信号,这是由于前列腺癌组的病灶部位存在大量紧密堆积的腺体,有少量间质,正常含水的腺泡结构被肿瘤组织替代,恶性腺体内部的结构改建等[6];前列腺炎组病灶主要是因为炎症导致水分子扩散低于正常组织,但细胞数量无明显增加,因此水分子扩散受限程度低于癌组织[7];BPH组病灶呈稍高信号,主要原因也是病灶间质密度增高。
对于前列腺DWI检查b值的选择,目前尚无统一标准。大部分研究中,学者选取b值800 s/mm2或1000 s/mm2,得到了较好的诊断效果,但是部分中央腺体的增生结节等良性病灶呈高信号,与癌灶难以分辨[8,9];张琨等[10]报道,b=3000 s/mm2超高b值DWI的诊断效能高于T2WI和常规DWI,但是b值越高,SNR越低。因此,在综合考虑诊断效能与SNR后,本研究b值选取1500 s/mm2。
本研究发现,前列腺癌的ADC值明显低于前列腺炎组及BPH组,这与陈志强等[11]研究结果一致;Liu等[12]也认为,移行带基质增生良性结节的ADC值低于前列腺癌。但本研究数值与其他文献报道存在差异,可能是因为在病例选择、MRI设备、b值设定以及ROI选取等方面不同所致。根据ADC值绘制诊断前列腺癌的ROC曲线,曲线下面积为0.995,接近于1,说明诊断准确性很高;当ADC值为0.95×10-3mm2/s时,诊断敏感性为92.8%,特异性为100%。本研究结果与刘晓东等[13]提出的超高b值对前列腺癌检查的敏感性、特异性较高的结论一致;同时,前列腺癌组与BPH组的ADC测量值没有明显重叠,与陈志强等[11]研究结果不符,这可能与本研究中前列腺癌组包含的恶性程度低的肿瘤较少,且ROI选取的是弥散受限最明显的区域有关。
本研究还存在以下局限性:(1)入组病例并未根据临床分级进行研究,使得研究出现误差;(2)取得ROI只是参照病理穿刺结果,未对应明确的穿刺点;(3)本研究样本量较少,尤其是前列腺癌组,且样本中包含恶性程度低的前列腺癌病例较少,BPH的不同病理类型也不够全面,可能使研究结果出现误差。
总之,通过研究表明,磁共振DWI和ADC值在前列腺癌的诊断和鉴别诊断中具有较高的敏感性、特异性,能指导临床选择治疗方案。
【参考文献】
[1] Zhang HM, Yan Y, Wang F,etal. Ratio of prostate specific antigen to the outer gland volume of prostate as predictor for prostate cancer[J]. Int J Clin Exp Patho, 2014,7(9):6079-6084.
[2] Ferlay J, Soerjomataram I, Dikshit R,etal. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer 2015,136(5):359-386.
[3] Hricak H, Choyke PL, Eberhardt SC,etal. Imaging prostate cancer: a multidisciplinary perspective[J].Radiology,2007,243(1):28-53.
[4] Turkbey B, Albert P S, Kurdziel K,etal. Imaging localized prostate cancer: current approaches and new developments [J]. AJR, 2009,192(6):1471-1480.
[5] 杨光华, 病理学[M]. 5版. 北京:人民卫生出版社,2003,80-121.
[6] 冯光耀. 磁共振扩散加权成像在诊断与鉴别诊断早期前列腺癌临床分析[J].临床医学,2016,36(5):92-94.
[7] 王化敏,夏黎明,金红花,等.磁共振DWI结合T2WI在前列腺疾病诊断中的价值[J].放射学实践,2010,25(12):1384-1387.
[8] 闫晨宇, 程敬亮, 高雪梅,等. 3.0T 磁共振平扫和DWI在前列腺癌诊断中的应用[J]. 实用放射学杂志, 2013, 29 (1):72-76.
[9] 张 莹, 苗华栋, 陈丽娟,等. 3.0T MR扩散加权成像与表观扩散系数诊断前列腺癌的比较[J]. 中国医学影像学射学杂志, 2013,21(8):602-605.
[10] 张 琨, 张晓晶,钟 燕,等. 超高b值扩散加权成像对前列腺中央腺体癌的诊断价值[J]. 中华放射学杂志, 2016, 50 (5):357-361.
[11] 陈志强, 杨文君, 郭玉林,等. 磁共振扩散加权成像在前列腺癌诊断和鉴别诊断中的价值[J]. 中华老年医学杂志, 2011, 30 (3):216-219.
[12] Liu X H, Zhou B N, Zhou LP,etal. Differentiation of prostate cancer and stromal hyperplasia in the transition zone with histogram analysis of the apparent diffusion coefficient[J]. Acta Radiologica,2017,58(12):1528-1534.
[13] 刘晓东, 唐 桑, 周美红,等. 1.5T MR超高b值DWI对前列腺癌的诊断价值[J]. 实用放射学杂志, 2017, 33(8):1290-1293.
