动物源性食品中性激素检测方法的比较分析
2018-05-15周秋玲娄婷婷王素英张宏宇
周秋玲,娄婷婷,王素英,张宏宇,*
(1.天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津300134;2.天津出入境检验检疫局,天津300461)
动物源性食品包括可食用的动物组织及其高附加值的附属产物,是日常膳食的重要组成部分。在规模效益和速度效率的催生下,获得动物源性食品的自然周期被打破。激素可以有效降低成本,改善产品性状。为了缩短饲养动物的生长和繁殖周期、提高饲料转化率、改善动物源性食品性状以及降低成本,多种人工激素在饲料中被无节制的使用,虽然动物源性食品产量大增,但是严重的激素残留问题直接影响着人类的安全[1]。特别是目前使用最多的性激素,对人类健康危害极大,控制和禁止激素在养殖业中的使用及相关法律法规的建设已引起各方面的关注[2]。
近年来,食品安全事件屡见报端,性激素残留的动物源性食品更使消费者谈虎色变。所以,动物源性食品的安全已引起全社会的广泛关注。从20世纪80年代开始,美国和日本等国家或组织就致力于通过立法禁止或限制在性激素类药物在食用性动物饲养中的使用[3-8]。我国农业部176号公告明确规定,禁止饲料和动物饮用水中添加己烯雌酚、雌二醇等雌性激素,炔诺醇、左炔诺孕酮、炔诺酮等孕激素,并在235号公告规定了己烯雌酚、醋酸甲羟孕酮、甲基睾丸酮、群勃龙、玉米赤霉醇等外源性激素物质在动物性食品中的最高残留限量为不得检出[9-10]。尽管如此,由于商业利益驱动,这些禁药依然不断地通过动物源性食品进入体内,最终会对人类的健康产生不利的影响。因此,探讨和开发动物源性食品中性激素的检测方法,对于食品安全的综合管理,有效保障食品安全具有重要的指导意义。
1 动物源性食品中性激素的来源
性激素是由动物性腺分泌或人工合成的一类甾体激素的总称,分子量低,亲脂性强,对动物体的生理及代谢起着重要的调节作用。性激素大都具有甾族化合物的母核结构,包括雌激素(雌二醇、雌三醇、雌酮)、孕激素(孕酮、甲羟孕酮、美仑孕酮)和雄激素(脱氢表雄酮、硫酸脱氢表雄酮、二氢睾酮、甲睾酮、美雄酮、去甲雄三烯醇酮、去氢睾酮、去甲睾酮、脱氢表雄酮、雄烯二酮和表睾酮以及人工合成的酯化、甲氧基化或氟取代的衍生物)三大类[11-12]。根据来源和化学结构,性激素可分为人工合成类固醇激素(丙酸睾酮、甲烯雌醇、苯甲酸雌二醇、醋酸群勃龙等)、人工合成的非类固醇激素(己烯雌酚、己烷雌酚等)、内源性性激素(睾酮、孕酮、雌酮、17β-雌二醇)三大类[3]。
由于性激素在预防和治疗家畜疾病方面具有显著效果,且可以促进其生长、泌乳以及肌肉脂肪的分配,因此性激素会被用来育肥家畜,但是,通过口服或注射的性激素会残留于动物体内而污染其制品[13-14]。
2 动物源性食品中性激素残留的危害及相关检测标准
性激素稳定性较高,正常的烹调加工均不能将其破坏,可通过食物链进入人体,在人体内积累的量超过人体正常水平时,就会破坏机体的正常生理平衡,从而产生一系列不良反应,其中以甲基睾酮、己烯雌酚和雌二醇较为典型。所以,大部分国家禁止性激素用于促进动物生长,不允许在食品中检出,我国现行的动物源性食品中性激素的检测标准见表1。
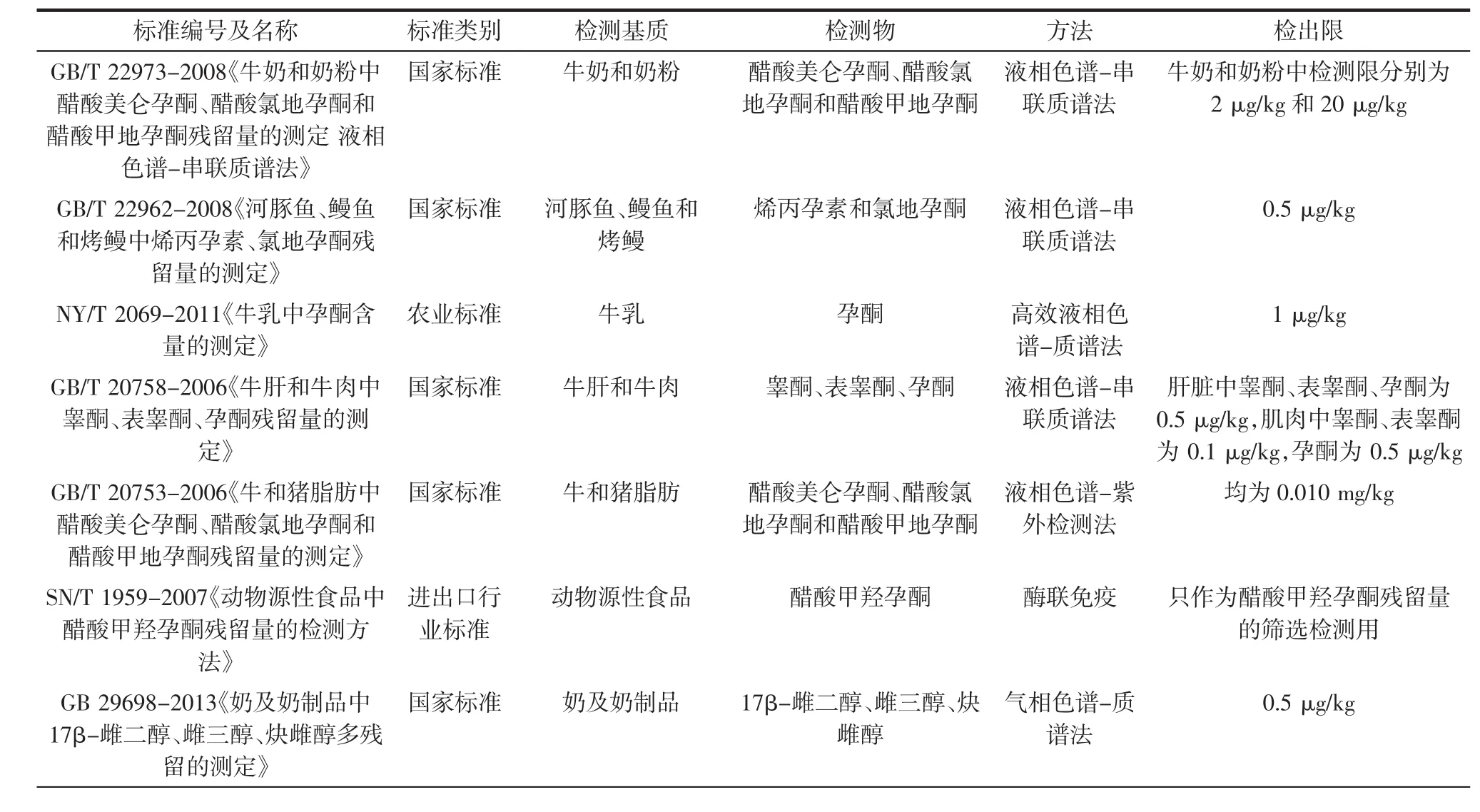
表1 我国现行的动物源性食品中性激素检测方法的标准Table1 The standardsof detectionmethods for gonadalhormones in anim alderived food in China
甲基睾酮是由人工合成的性激素,由于其具有提
高产量和控制性别等作用,所以在动物养殖中被大量使用。但是,其在动物体内的代谢缓慢,即使极小的残留会对人类健康造成巨大的潜在危害,包括美国、欧盟、日本等多个国家及组织已限制或禁止水产品中使用此激素并已立法[15]。我国农业部于2002年实施的行业标准NY5070-2002《无公害食品水产品中渔药残留限量》中明确规定不允许使用甲基睾酮等激素类药物,2003年农业部发布的235号公告《动物性食品中兽药最高残留限量》中也规定其为禁止使用兽药,在所有动物可食组织中不得检出。
己烯雌酚具有促进蛋白合成,加快动物增重和骨骼钙化的作用,可作为牛、羊的生长促进剂,减少饲料的使用量[16]。但是,己烯雌酚会残留于动物源食品中,其不但会扰乱激素平衡,更严重的还会诱发女性乳腺癌、卵巢癌等疾病,农业部已明确规定禁止使用该性激素[17]。
雌二醇不但具有加速动物生长、繁殖的作用,而且可以提高畜禽瘦肉比例,在养殖业中得到广泛应用[18]。但是雌二醇会在动物源食品中形成残留,长期食用还会造成不育症、女性早熟、男性女性化、男性生殖系统发育异常,使女性乳腺癌和子宫内膜异位症发病率上升[19]。为此,早在1991年,美国已明确规定了雌二醇棕榈酸在家禽的可食用部分的最高残留限量为0.002mg/kg,而韩国规定牛肉中苯甲酸雌二醇最高限量是0.000 12mg/kg,欧盟早在1996年已立法并禁止该类性激素在食品动物养殖中使用,在我国,包括苯甲酸雌二醇等19种性激素及其盐、酯等也禁止在食品动物养殖中使用[20]。
3 动物源性食品中性激素残留的检测研究进展
由于动物或动物源性食品基质具有一定的复杂性,性激素种类的多样性以及低检出水平的要求,而且样品提取和净化的过程比较复杂,导致回收率不高,使得性激素多残留分析检测具有一定的难度[21-23]。因此,如何对样品进行预处理以富集、净化待测组分并消除基体干扰,同时保证预处理过程中目标物性激素的损失最小,是一个必须解决的问题。另一方面要利用高灵敏度和高选择性的检测分析技术,尽量降低检测限。
3.1 样品的提取及净化
动物源性食品中部分激素以水溶性较强的结合物形式存在。为了使其能溶于有机溶剂,需对样品进行粉碎、冷冻干燥和均质化,通过酶解将结合态的性激素解离出来,然后用有机溶剂进行提取和富集[24]。为了获得更加纯净的待分析物,动物组织中性激素的提取溶剂包括甲醇、乙腈、二乙醚、叔丁基甲醚、水-甲醇、水-丙酮、乙腈-偏磷酸、氯仿-甲醇等[25]。可采用液液萃取、固相微萃取、超临界流体萃取、冷冻离心除脂、加压液体萃取等多种方法进行净化处理,进一步方便目标性激素的检测[26-29]。净化的目的是去除生物基质中的脂肪、蛋白等杂质,从而降低干扰,提高分析灵敏度。为了达到更好的纯化效果,也可将几种方法或柱子结合使用。动物源性食品中几种常见净化方法优劣比较见表2。
3.2 动物源性食品中性激素的检测和评价方法的比较
根据国内外对动物源性食品中兽药残留的规定,又因食品基质相对复杂,兽药残留量极低,因此对兽药残留的检测方法、灵敏度等均有较高要求。分析检测食品基质中性激素的传统方法有紫外分光光度法、荧光光度法、酶联免疫法(Enzyme linked immunosorbentassays,ELISA)、薄层色谱法、气相色谱法(Gas chromatography,GC)、液相色谱法(High performance liquid chromatography,HPLC)、气相色谱-质谱联用法(Gas chromatography-mass spectrometry,GC-MS)、液相色谱-质谱联用法(Liquid chromatography-mass spectrometry,HPLC-MS)、液相色谱-串联质谱法(Liquid chromatography-tandem mass spectrometry,HPLCMS/MS)、气相色谱-串联质谱法(Gas chromatographytandem mass spectrometry,GC-MS/MS)等,具体信息及其在应用中的优缺点见表3。

表3 动物源性食品中性激素检测方法的比较Table3 Comparison of theadvantagesand disadvantagesof the detectionmethodsofanimalderived food
4 色谱-质谱法在动物源性食品性激素检测中的研究进展
4.1 气相色谱—质谱法
气相色谱—质谱法包括气相色谱—质谱联用(GC-MS)和气相色谱-串联质谱法(GC-MS/MS)。气相色谱—质谱法集聚了色谱的高效分离及质谱在检测和确认化合物的优点,气相色谱—质谱法成为性激素检测分析中常用的技术。气相色谱—质谱法的灵敏度、准确度、回收率均较好,分析过程简便快捷,适用于同时检测性激素多组分残留。但是,性激素对热不稳定且不易挥发,用气相色谱—质谱法分析,首先要用硅烷化试剂和酰基化试剂将性激素衍生化,获得热稳定性及挥发性都较好的衍生化物质。
黄冬梅等[30]将雌二醇D2作为内标定量,通过GCMS建立了水产品中雌二醇残留量的检测方法,采用葡糖苷酸酶酶解样品,正己烷去除脂肪和色素等杂质,用乙酸乙酯提取,浓缩后衍生化,然后进行检测。邹龙等[31]以氘代同位素为内标,测定了不同鱼贝类肌肉组织中雌二醇残留量。首先在样品中加入内标和乙酸钠缓冲溶液并均质,然后用乙腈多次超声提取,利用正己烷脱脂除杂质,利用C18固相萃取柱净化和柱前三甲基硅烷化后,进行GC-MS分析。根据雌二醇和内标衍生物定量离子质量色谱图的峰面积比值,内标标准曲线法定量,最低定量检测限为2μg/kg。曾东平等[32]采用固相萃取小柱净化衍生后,利用GC-MS对猪肌肉中甲睾酮等多种性激素残留进行检测,当浓度为2.5μg/kg~50μg/kg时,其线性关系较好,相关系数均大于0.97,回收率和灵敏度较好,可在水产品性激素残留检测中大力推广。宫向红等[33]用乙酸乙酯对鳗鱼和虾中性激素己烯雌酚进行提取,正相固相萃取小柱净化、衍生后进行GC-MS分析,当添加水平在0.5μg/kg~1.0μg/kg时,回收率大于75%,相对标准偏差为0.9%~2.7%,线性相关系数为0.999。
湛嘉等[34-35]采用GC-MS分别对黄鳝和猪肉中的性激素残留开展了检测,采用葡糖苷酸酶对黄鳝提取物进行水解,用叔丁基甲醚提取,用正己烷脱脂,再经C18小柱和NH2小柱净化,用七氟丁酸酐进行衍生化,基于外标法,利用GC-MS进行检测,检出限在0.50μg/kg~1.00μg/kg,平均回收率范围为56%~103%,平均相对标准偏差范围为3.1%~29.5%,且对不同批次样品的重复性也较好;对猪肉中l6种性激素多残留检测结果显示,检出限在0.25μg/kg~1.0μg/kg之间,平均回收率分别为83.7%~107.9%,重复性好。
Scarth等[36]利用GC-MS/MS测雄性激素和孕激素,检测限为 10.9 pg/mL~160.7 pg/mL。Rambaud 等[37]采用GC-MS/MS同时测定了动物毛发中的28种同化激素,用甲醇提取基质中的药物,分别得到雌性激素与雄性激素和孕激素,检测限为0.1μg/kg~10μg/kg。
但是,气相色谱法要求分析物有较低的沸点和很好的挥发性,由于激素个体性质的差异常需要对其进行多种衍生处理,虽然气相色谱分析法也能实现对物质的定性和确证分析,但需要衍生处理而太耗时,不能满足快速分析的需要,有的激素也不容易通过衍生得到很好的极性和热稳定性,制约了其在多残留检测中的应用。
4.2 液相色谱—质谱法
高效液相色谱法以液体作为流动相,可同时检测多种类固醇激素,不受样品挥发性和热稳定性的限制,不需要衍生化,只要适当应用各种试剂及净化方法,再结合一定的检测器,可实现对多种物质的检测分析。液相色谱-质谱法包括高效液相色谱-质谱联用法(HPLC-MS)、液相色谱-串联质谱(HPLC-MS/MS)和超高效液相色谱-串联质谱法(Ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS),目前液相色谱-质谱法是分析食品中性激素多组分残留的有效方法之一。
杨敏等[38]通过高效液相色谱法对鱼、虾中己烯雌酚残留进行定量检测,最低检测限为2.5μg/kg,其回收率和线性关系良好。周建科等[39]采用高效液相色谱法成功建立了中老年奶粉中性激素的监测分析方法。Yang等[40]经Helix pomatia水解,甲醇提取,石墨化碳黑固相萃取,再过NH2柱,利用液相色谱方法检测肉、奶、肝脏中50种激素残留的含量。检出限达到0.04 μg/kg~20 μg/kg。
但是,液相色谱的紫外检测器存在一定的局限性,如果液相色谱结合三重四极杆、离子阱、飞行时间等质谱检测器,可大大提高准确度,可实现多残留的同时检测分析。高效液相色谱-质谱法集高效分离和多组分定性定量于一体,可提供待测样品完整的准分子、离子,如采用超高效液相色谱还可以进一步改善样品的分离度、分析速度和灵敏度。
万巧玲等[41]利用HPLC-MS/MS定量分析雌酮、17β-雌二醇和17α-乙炔基雌二醇,检测限分别为0.5、0.4、0.1 ng/L。Vanhaecke 等[42]利用超高效液相色谱-串联质谱法检测34种合成类固醇激素(包括10种雌性激素、14种雄性激素、10种促孕激素)在牛肉中的残留,检测限与定量限分别为0.04μg/kg~0.88μg/kg和0.12μg/kg~1.9μg/kg。该方法检测到所有的自然的、合成的类固醇,实验重现好,相对标准偏差<20%,线性相关系数在0.991~0.999之间。Xu等[43]利用LC/ESIMS/MS检测动物肌肉中10种激素残留含量,检出限达到 0.06μg/kg~0.22μg/kg,定量限达到 0.12μg/kg~0.54μg/kg。Blasco等[44]均质后经 SubtilisinA 降解,甲醇提取,过C18和NH2柱,乙腈洗脱,对肉制品中22中激素残留进行了分析,检出限小于0.5μg/kg。刘桂华等[45]开展了深圳市售猪肉、牛肉、鸡蛋和牛奶中激素残留情况的多组分同时测定,用乙腈提取待测样品并用正己烷脱脂,然后利用HLB-NH2柱串联固相萃取净化,采用HPLC-MS/MS电喷雾电离,多反应监测模式检测,内标法定量,20种目标性激素的方法定量限为0.5μg/kg~1.0μg/kg,方法平均回收率60.4%~118.2%,相对标准偏差2.5%~16.2%,该方法可用于猪肉、牛肉、鸡蛋和牛奶中20种游离态性激素的检测。
综上所述,食品基质中性激素多残留检测的现行标准多采用液相色谱-质谱法,而且归因于其较高的准确性和灵敏度,以液相色谱-质谱法来测定动物源性食品中性激素残留的标准将不断得到更新。
5 总结与展望
近几年来,随着科技的发展及生活水平的提高,食品中性激素多组分残留的检测要求越来越高,因此发展低检出限高灵敏度的多组分残留同时检测方法越来越受到重视。目前,主要采用色谱与高灵敏度的检测系统一质谱相结合来实现。但是在气相色谱-质谱法使用过程中,很难做到一种衍生试剂可以将所有的性激素进行衍生,限制了多残留的同时检测;而且在衍生化过程中产生的副产物会对目标待测物产生干扰,使检测的准确性和灵敏度降低。而采用液相色谱—质谱法适合分析热稳定性和热挥发性差的化合物,可避免上述问题,而且随着多种质谱检测器的应用,还可以确定一些未知激素进行定性和定量分析。
参考文献:
[1]李宁,林小莉,董艳峰,等.饲料中非法添加激素类药物检测方法研究[J].黑龙江畜牧兽医,2016(8):166-168
[2]赵春娟,高文惠.饲料及畜产品中激素残留检测方法研究进展[J].饲料博览,2015(1):9-14
[3]沈诚,徐昆龙,代佳和,等.甲基睾酮在动物源性食品中残留危害及检测方法的研究进展[J].黑龙江畜牧兽医,2017(7):70-73
[4]王强,王旭峰,黄珂,等.酶联免疫吸附法测定水产品中甲基睾酮残留[J].现代食品科技,2015(5):303-308
[5]杜赛,高何刚,王若燕,等.动物源食品中雌激素检测方法研究进展[J].中国卫生检验杂志,2016(12):1822-1824
[6]张学亮.色谱串联三重四极杆质谱对禁限药多残留的检测方法研究[D].北京:北京工业大学,2015:37-55
[7]尤亮亮,魏巍,刘海燕,等.固相萃取-高效液相色谱串联质谱测定牛奶中9种性激素残留[J].中国测试,2016,42(5):46-49
[8]高旭东,黄鑫,郝宝成,等.浅析动物源性食品中性激素残留危害及其残留检测方法[C].中国畜牧兽医学会兽医药理毒理学分会会员代表大会暨第十三次学术讨论会与中国毒理学会兽医毒理专业委员会第五次学术研讨会,2015:167
[9]佚名.农业部、卫生部、国家药品监督管理局联合发布《禁止在饲料和动物饮用水中使用的药物品种目录》(农业部公告第176号)[J].内蒙古畜牧科学,2002(3):46-47
[10]程坚.我国与CAC动物源性产品中药物残留限量的对比分析[J].安徽农业科学,2015(9):89-91,101
[11]TOKARZ J,M LLERG,ANGELISM H D,et al.Steroids in teleost fishes:A functionalpointofview[J].Steroids,2015,(103):123-144
[12]LITWACKG.Chapter 16-Steroid Hormones[M]//Human Biochemistry.Boston:Academic Press,2018:467-506
[13]李佩佩,郭远明,张小军,等.高效液相色谱-串联质谱法测定动物源食品中同化激素的研究进展[J].理化检验(化学分册),2014(11):1476-1480
[14]张晓娜,杨镒峰,常彤,等.雌激素、雄激素在卵泡发育中的作用及应用[J].特产研究,2017,39(3):50-54
[15]沈诚,徐昆龙,代佳和,等.甲基睾酮在动物源性食品中残留危害及检测方法的研究进展[J].黑龙江畜牧兽医,2017(7):70-73
[16]隆雪明,匡光伟,陈福华,等.高效液相色谱法测定饲料中雌二醇、炔雌醇和己烯雌酚的含量[J].饲料研究,2017(2):27-29
[17]易鸣,朱志强,曾智.水产品中氯霉素和己烯雌酚快速检测方法初探[J].渔业致富指南,2017(13):57-61
[18]原林.用于检测雌二醇的酶热传感技术研究[D].北京:中国人民解放军军事医学科学院,2015:9-12
[19]白宇,胡景炎,张井.食源性雌二醇残留检测技术研究进展[J].食品与发酵工业,2017,43(12):253-261
[20]刘建青.核糖体展示Anticalin模拟抗体库的构建及其在雌二醇、百草枯模拟抗体筛选中的应用[D].天津:天津大学,2012:8-12
[21]卢杰.亚临界R134a萃取技术在水产品性激素多残留分析中的应用研究[D].青岛:中国海洋大学,2014:3-25
[22]M RTA Z,BOB LY B,FEKETE J,etal.Simultaneous determination of thirteen different steroid hormones usingmicro UHPLC-MS/MS withon-line SPEsystem[J].JournalofPharmaceuticaland BiomedicalAnalysis,2018,150:258-267
[23]TAN X-T,LIZ-M,DENG L-G,et al.Analysis of 13 kinds of steroid hormones in raw milk using modified QuEChERSmethod combined with UPLC-QTOF-MS[J].Journal of Integrative Agriculture,2016,15(9):2163-2174
[24]胡雪玲,李莹.动物源性食品中残留前处理技术及检测方法研究进展[J].现代食品,2017(12):13-15
[25]赵子佳,张宇,孙佳明,等.动物源性食品中残留前处理技术及检测方法研究进展[J].吉林中医药,2017,37(1):55-57
[26]蓝航镇.新型固相微萃取涂层的研制及其应用于食品中雌激素残留的分析研究[D].宁波:宁波大学,2015:3-80
[27]曹江平,邸宏伟,周继梅,等.分散液液微萃取技术的研究进展[J].分析测试学报,2016,35(7):913-921
[28]赵超敏,岳振峰,吴晖,等.液相色谱-串联质谱法测定牛奶中4种雌激素残留[J].现代食品科技,2014,30(6):244-249
[29]项玮.PLE萃取-GPC净化-LC-MS/MS法测定沉积物中8种性激素[J].现代化工,2017,37(9):206-210
[30]黄冬梅,钱蓓蕾,惠芸华.GC-MS测定水产品中雌二醇残留量[J].分析试验室,2008,27(s2):153-156
[31]邹龙,林洪,江洁.氘代同位素内标气相色谱-质谱法测定鱼贝类肌肉中β-雌二醇残留[J].分析化学,2007,35(7):983-987
[32]曾东平,林翠萍,曾振灵,等.气相色谱-质谱法检测猪肌肉中8种性激素的残留[J].中国农业科学,2008(9):2776-2782
[33]徐英江,张秀珍,宫向红,等.使用液相色谱荧光法测定水产品中己烯雌酚残留量的方法.101718755B[P].2013-06-12
[34]湛嘉,俞雪钧,李佐卿,等.黄鳝肌肉中11种性激素的气质联用检测方法[J].分析测试学报,2007,26(5):642-646
[35]湛嘉,李佐卿,俞雪钧,等.猪肉中16种性激素的多残留检测方法[J].宁波大学学报(理工版),2007,20(4):520-525
[36]SCARTH J,CLARKEA,HANDSJ,etal.Validation of a quantitativemulti-residue urinary assay for the detection of androgen,oestrogen and progestagen abuse in the bovine[J].Chromatographia,2010,71(3/4):241-252
[37]DUFFY E,RAMBAUD L,LE B B,etal.Determination of hormonal growth promoters in bovinehair:comparison of liquid chromatography-mass spectrometry and gas chromatography-mass spectrometry methods for estradiol benzoate and nortestosterone decanoate[J].Analytica Chimica Acta,2009,637(1/2):165-172
[38]杨敏,仲娜.鱼、虾中己烯雌酚残留的高效液相色谱法测定研究[J].中国卫生检验杂志,2011(8):1878-1879
[39]周建科,张前莉,韩康,等.中老年奶粉中双酚A和己烯雌酚的反相高效液相色谱测定[J].食品工业科技,2007(2):233-234
[40]YIY,BINGS,JINGZ,etal.Determination of the residuesof50 anabolic hormones in muscle,milk and liver by very-high-pressure liquid chromatography–electrospray ionization tandem mass spectrometry[J].JournalofChromatography B,2009,877(5/6):489-496
[41]万巧玲,阳春,张智,等.响应曲面法在类固醇雌激素HPLCMS-MS定量分析中的应用[J].重庆大学学报 (自然科学版),2011,34(5):105-111
[42]SCARTH JP,KAY J,TEALEP,etal.A review ofanalytical strategies for the detection of'endogenous'steroid abuse in food production[J].Drug Testing&Analysis,2012,4(S1):40-49
[43]XUC L,CHU XG,PENGCF,etal.Developmentofa faster determination of 10 anabolic steroids residues in animalmuscle tissues by liquid chromatography tandem mass spectrometry[J].Journal of Pharmaceutical&BiomedicalAnalysis,2006,41(2):616-621
[44]BLASCOC,VAN PC,VAN PC.Analysis ofmeat samples for anabolic steroids residues by liquid chromatography/tandem mass spectrometry[J].JournalofChromatography A,2007,1154(1/2):230
[45]刘桂华,秦伟,刘红河,等.LC-MS/MS同时测定动物源性食品中20种游离态性激素残留[J].卫生研究,2013,42(1):66-71
