脑白质疏松症患者情感淡漠与同型半胱氨酸水平的关系
2018-05-15刘玉洁高春岭徐磊王竞达谭华
刘玉洁,高春岭,徐磊,王竞达,谭华
(西南医科大学附属医院 神经内科,四川 泸州 646000)
脑白质疏松症(Leukoaraiosis,LA)又称脑白质病变,于1986年由HACHINSKI等提出,指在CT上脑室周围及皮层下的低密度带、病变弥漫及边缘模糊不清[1]。而情感淡漠则是一种原始动机的缺乏,为LA的常见伴发表现[2]。同型半胱氨酸(total homocysteine,tHcy)因其可能增加血管疾病、认知障碍等风险已受到广泛关注[3]。有研究发现LA患者血清tHcy水平增高,但有实验提示两者无相关性[4-5]。目前关于tHcy与情感淡漠的报道偏少,故本文拟对3者关系进行研究,以期为诊断、治疗及预防提供部分思路。
1 资料与方法
1.1 一般资料
选取2015年1月-2016年4月于西南医科大学附属医院神经内科收治的LA患者44例作为LA组。纳入标准:①头颅MRI提示脑室周围或半卵圆中心区的斑点、斑片状或相互融合阴影,边缘模糊不清的等或长T1、长T2信号(但应排除Binswanger病);②有一定的LA危险因素,并需除外特异性脑白质疾病;③神经系统查体无确切局灶体征;④如实提供个人信息,能配合完成相关影像、实验室及神经心理等检查。排除标准:①年龄>60岁;②有神经系统疾病史(如卒中、CO中毒、代谢性脑病、帕金森病、阿尔茨海默病、多发性硬化、癫痫发作、颅内感染及颅脑外伤等);③具有精神病病史,或近半年有服用特殊药物病史(抗精神病药、抗抑郁药、镇静药及酒精依赖等);④患有可能影响情绪、认知的全身性疾病如严重肝肾功能异常、慢性阻塞性肺疾病、心力衰竭、甲状腺功能异常、睡眠呼吸暂停综合征、贫血及恶性肿瘤等;⑤伴有严重听力、视力疾患不能配合完成神经心理检查者;⑥拒绝或不能配合完成相关检查者。选取一般资料与观察组相匹配且头颅MRI未见异常的本院门诊或健康体检者44例作为对照组。
1.2 方法
1.2.1 基线资料收集搜集患者的年龄、性别、受教育年限、吸烟、饮酒、有无合并高血压、糖尿病、心脏病、三酰甘油及总胆固醇水平。
1.2.2 LA分组据AHARON-PERETZ等提出的分级方法按部位将LA分为4级[6]。LA1:侧脑室前角或后角可见低密度区;LA2:侧脑室前角和后角均可见低密度区;LA3:沿侧脑室周围可见连续的低密度区;LA4:侧脑室周围及放射冠可见低密度区。将LA1作为轻度LA组,LA2、3作为中度LA组,LA4作为重度LA组。见图1~4。

图1 轻度LA患者MRI图
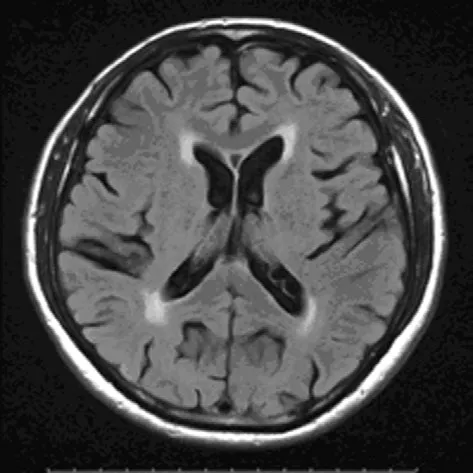
图2 中度LA患者MRI图

图3 重度LA患者MRI图
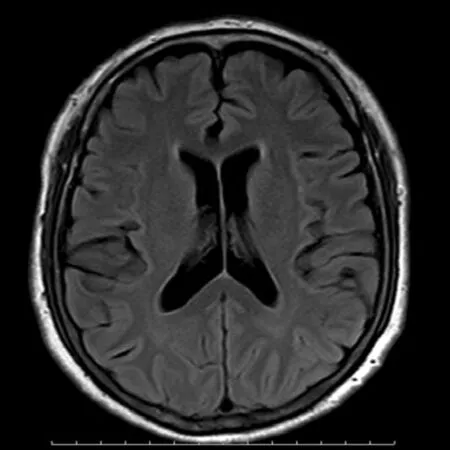
图4 对照组患者MRI图
1.2.3 血清标本采集及测定所有患者于24 h内采肘正中空腹静脉血3 ml,立即送于西南医科大学附属医院检验科,应用美国DADE Behring公司全自动生化分析仪进行tHcy水平测定。
1.2.4 量表评定由经过培训的神经内科医师使用修订版情感淡漠评定量表对入组病例进行测评,该量表共有14个项目,分值范围在0~42分,以14为界限,≥14分提示存在情感淡漠,分值越高情感淡漠越严重[7]。本研究对照组纳入伴情感淡漠者7例;LA组又再分为伴情感淡漠组16例和不伴情感淡漠组28例。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验;计数资料以率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
两组患者在年龄、性别、教育年限、吸烟、饮酒、糖尿病、高血压病、心脏病、TC及TG水平比较,差异无统计学意义(P>0.05),具有可比性。两组患者血清tHcy比较,差异有统计学意义(P<0.05)。见表1。
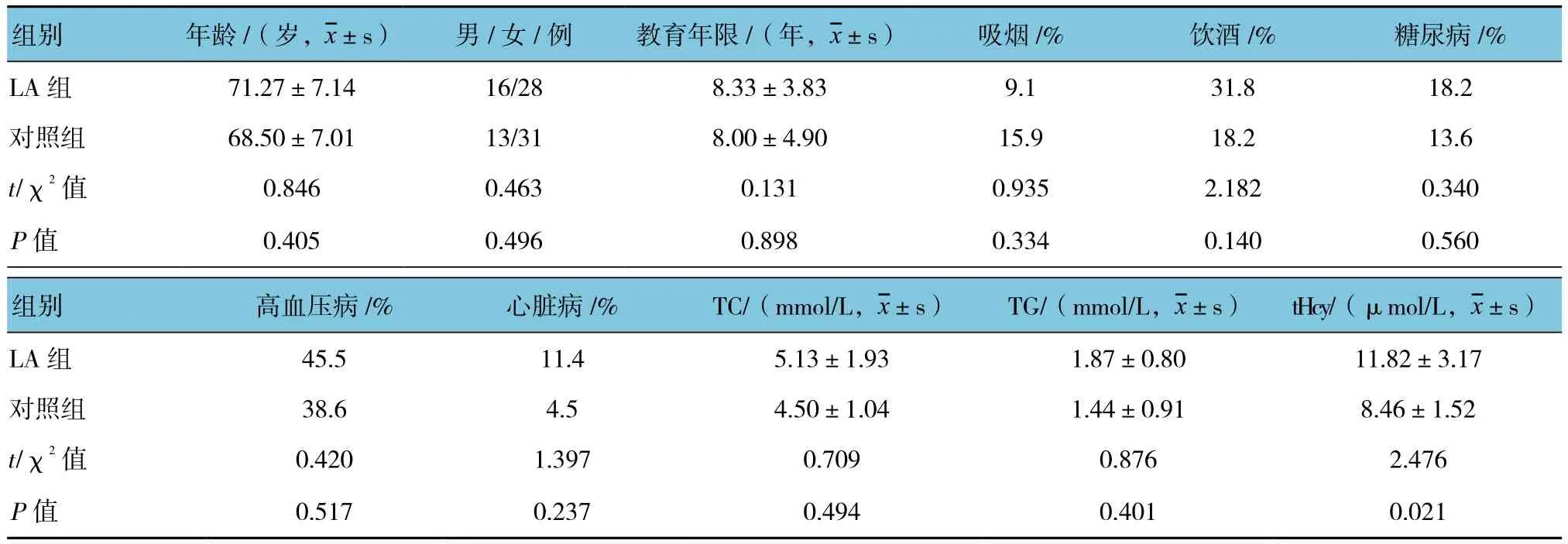
表1 两组患者基线资料比较 (n =44)
2.2 不同程度LA组患者tHcy水平比较
轻、中及重度LA组患者各有22例、17例及5例,因重度LA组患者较少,故将其与中度组患者合并与轻度LA组作比较。结果提示中、重度LA组患者血清tHcy水平为(13.48±2.73)μmol/L,轻度LA组患者为(10.16±2.78)μmol/L,两组比较,差异有统计学意义(t=2.558,P=0.021)。
2.3 两组患者情感淡漠发生率比较
LA患者情感淡漠发生率为36.4%,对照组患者为15.9%,两组比较,差异有统计学意义(χ2=4.768,P=0.029)。
2.4 LA伴与不伴情感淡漠患者的临床资料比较
LA伴情感淡漠组与不伴情感淡漠组患者的年龄、性别、高血压及糖尿病比较,差异无统计学意义(P>0.05)。两组患者血清tHcy水平比较,差异有统计学意义(P<0.05)。见表2。
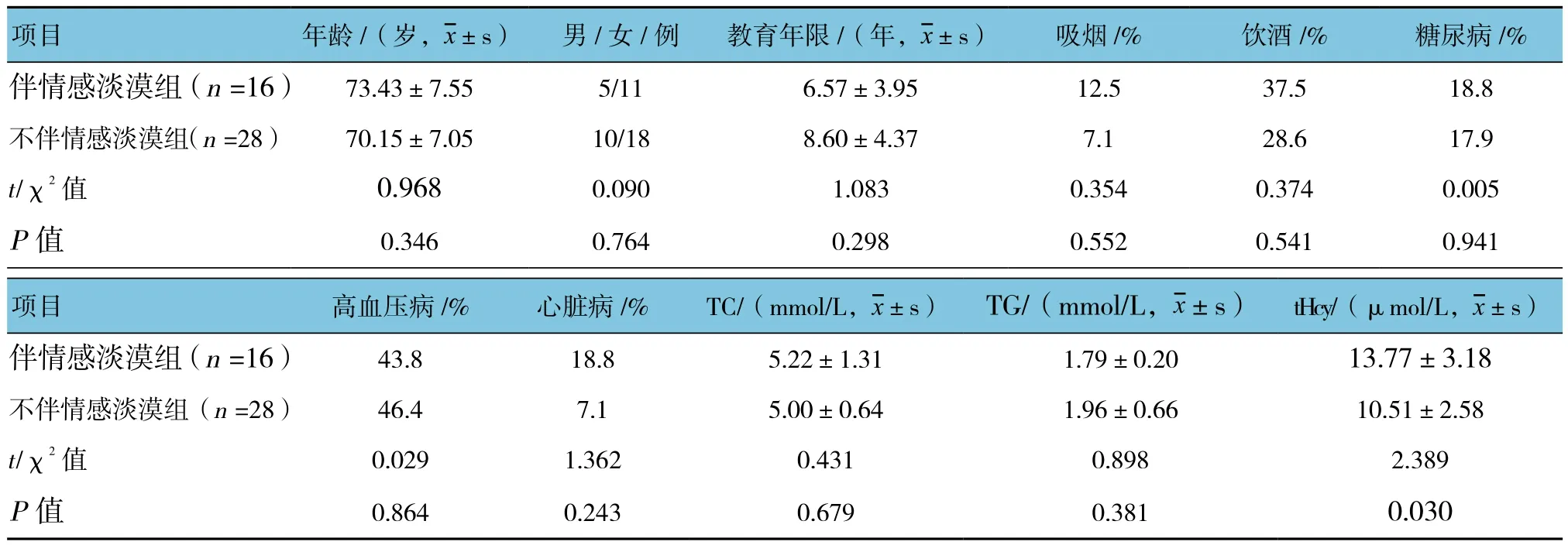
表2 LA伴与不伴情感淡漠患者的临床资料比较
3 讨论
随着人口老龄化的加剧及影像检测技术的发展,目前LA的发病率及检出率日益增高,也使其成为国内外研究热点。大量研究提示一些血管危险因素如年龄、吸烟、高血压及糖尿病等均可能与LA的发生有关[8]。而大脑低灌注与长期慢性缺血缺氧可能是其主要病因,目前其具体发病机制、病理生理基础等仍无定论[9]。tHcy是半胱氨酸的异种,在旁链部分硫醇基(-SH)前包含1个额外的亚甲基(-CH2-),研究认为tHcy在LA发生过程中起着重要作用[10]。先前有研究提出血清tHcy与LA的发生发展在独立于其他血管危险因素的情况下仍密切相关[11]。SACHDEV等[12]研究发现tHcy是中年男性脑白质病变的独立危险因素,并可造成卒中、轻度认知功能障碍甚至痴呆等严重后果,以此提出早期控制血清tHcy水平可能缓解其对大脑造成的不同程度损害。而tHcy导致脑白质病变的机制较为复杂,早在1969年,MCCULLY等[13]就提出高tHcy血症可能导致动脉粥样硬化性血管性疾病的假说,而其他可能致病机制包括:促进脂质过氧化、损伤血管内皮细胞、促凝、促进血小板活化、增加氧自由基释放、降低动脉对收缩刺激反应及促进血管壁平滑肌细胞增殖等过程,均可导致脑小血管损害引起慢性缺血缺氧,从而促进脑白质病变发生。而脑白质病变可伴发情感淡漠、抑郁及认知障碍等多种临床表现,增加患者不良预后及照顾者和社会负担,其中脑白质病变与情感淡漠关系研究较少,tHcy与情感淡漠相关性报道更是鲜见,故本文以期了解脑白质病变患者情感淡漠发生情况及tHcy与LA和情感淡漠的关系。情感淡漠作为常见的神经精神症状因对患者预后及生活质量等方面产生的负面影响已受到越来越多的关注,其发病基础主要是前额叶皮层与基底节及其他皮层下结构的纤维网络连接的破坏,故提出白质特别是额叶病变患者可能因上述纤维环路受损而易出现情感淡漠。虽然脑白质病变与情感淡漠的研究报道相对较少,但两者的相关性早已得到证实。HOLLOCKS等[14]利用弥散张量成像技术进行基于体素的分析,得出情感淡漠与脑白质(主要是前脑区但也包括颞叶、顶叶等)的各向异性分数及平均弥散系数均呈相关性。GROOL等[15]发现情感淡漠患者有明显额叶白质病变及顶叶白质体积缩小。多项研究均提示额叶白质病变患者更易发生情感淡漠,且一项连续3年的纵向研究指出额叶的白质病变进展较其他脑叶更为迅速[16]。GAO等[17]通过对急性缺血性卒中患者研究显示tHcy水平与LA的发生相关,且高血清tHcy血症患者的脑白质病变主要波及额叶及脑室周围。由此认为高tHcy血症患者可能更易发生情感淡漠。同时有研究提出情感淡漠的患者可能存在一定程度与大脑奖赏系统相关的多巴胺系统功能障碍[18]。tHcy则可能通过导致一碳化合物代谢功能失调从而使多巴胺合成受阻导致情感淡漠发生,且本文提及tHcy所致脑白损害主要发生在额叶等,恰好该部位为情感淡漠发病的解剖基础。因此tHcy水平可能与情感淡漠发生发展存在某种联系。CHEN等[19]通过对阿尔茨海默病患者研究发现,在控制年龄、智能状态、抑郁等影响因素后,情感淡漠患者有着增高的血清tHcy水平,但该结论存在性别差异,即在女性中更为明显,这可能与老年女性的大脑更容易受到tHcy水平的影响有关。本研究显示在LA患者中,伴情感淡漠者血清tHcy水平较不伴情感淡漠者增高,但未发现两组间存在性别差异,还需进一步研究。
LA患者血清tHcy水平增高,且情感淡漠发生率较健康老年人增加,同时tHcy水平愈高脑白质病变程度愈重。而LA伴随情感淡漠的患者较不伴情感淡漠者血清tHcy水平有所增加。因此tHcy作为LA的危险因素且可加重其情感淡漠等相关临床症状,应引起医务工作者的广泛重视。但需要进一步大样本量及长期随访研究以证实该结论可靠性、稳定性。
参 考 文 献:
[1]HACHINSKI V C, POTTER P, MERSKEY H.Leuko-araiosis:an ancient term for a new problem[J].Can J Neurol Sci, 1986, 13(4):533-534.
[2]MARIN R S.Differential diagnosis and classification of apathy[J].Am J Psychiatry, 1990, 147(1):22-30.
[3]SACHDEV P.Homocysteine, cerebrovascular disease and brain atrophy[J].J Neurol Sci, 2004, 226(1-2):25-29.
[4]MA Y, ZHAO X, ZHANG W, et al.Homocysteine and ischemic stroke subtype:a relationship study in chinese patients[J].Neurol Res, 2010, 32(6):636-641.
[5]SESHADRI S, WOLF P A, BEISER A S, et al.Association of plasma total homocysteine levels with subclinical brain injury:cerebral volumes, white matter hyperintensity, and silent brain infarcts at volumetric magnetic resonance imaging in the framingham offspring study[J].Arch Neurol, 2008, 65(5):642-649.
[6]AHARON-PERETZ J, CUMMINGS J L, HILL M A.et al.Vascular dementia and dementia of the alzheimer type.cognition,ventricular size, and leuko-araiosis[J].Arch Neurol, 1988, 45(7):719-721.
[7]STARKSTEIN S E, MAYBERG H S, PREZIOSI T J, et al.Reliability, validity, and clinical correlates of apathy in parkinson’s disease[J].J Neuropsychiatry Clin Neurosci, 1992, 4(2):134-139.
[8]ZHANG S, KANG X.Investigation of the risk factors for leukoaraiosis (La) [J].Asia Pac J Public Health, 2013, 25(4):64-71.
[9]PANTONI L, GARCIA J H.Pathogenesis of leukoaraiosis:a review[J].Stroke, 1997, 28(3):652-659.
[10]WRIGHT C B, PAIK M C, BROWN T R, et al.Total homocysteine is associated with white matter hyperintensity volume:the northern manhattan study[J].Stroke, 2005, 36(6):1207-1211.
[11]VERMEER S E, VAN DIJK E J, KOUDSTAAL P J, et al.Homocysteine, silent brain infarcts, and white matter lesions:the rotterdam scan study[J].Ann Neurol, 2002, 51(3):285-289.
[12]SACHDEV P, PARSLOW R, SALONIKAS C, et al.Homocysteine and the brain in midadult life:evidence for an increased risk of leukoaraiosis in men[J].Arch Neurol, 2004,61(9):1369-1376.
[13]MCCULLY K S.Vascular pathology of homocysteinemia:implications for the pathogenesis of arteriosclerosis[J].Am J Pathol, 1969, 56(1):111-128.
[14]HOLLOCKS M J, LAWRENCE A J, BROOKES R L, et al.Differential relationships between apathy and depression with white matter microstructural changes and functional outcomes[J].Brain, 2015, 138(12):3803-3815.
[15]GROOL A M, GEERLINGS M I, SIGURDSSON S, et al.Structural mri correlates of apathy symptoms in older persons without dementia:ages-reykjavik study[J].Neurology, 2014,82(18):1628-1635.
[16]GOUW A A, VAN DER FLIER W M, FAZEKAS F, et al.Progression of white matter hyperintensities and incidence of new lacunes over a 3-year period:the leukoaraiosis and disability study[J].Stroke, 2008, 39(5):1414-1420.
[17]GAO Y, WEI S, SONG B, et al.Homocysteine level is associated with white matter hyperintensity locations in patients with acute ischemic stroke[J].PLoS One, 2015, 10(12):DOI:10.1371/journal.pone.0144431.
[18]LANCTOT K L, HERRMANN N, BLACK S E, et al.Apathy associated with alzheimer disease:use of dextroamphetamine challenge[J].Am J Geriatr Psychiatry, 2008, 16(7):551-557.
[19]CHEN C S, YEH Y C, CHANG Y S, et al.Plasma homocysteine level and apathy in alzheimer’s disease[J].J Am Geriatr Soc,2011, 59(9):1752-1754.
