红菜薹离体再生体系的建立
2018-05-14王晨璐陈龙正
王晨璐 陈龙正
摘要 [目的]为建立红菜薹的离体再生体系,提高红菜薹的生物技术育种效率。[方法]以红菜薹带柄子叶为外植体,选用TDZ、NAA两种激素,进行离体组织培养。[结果]以带柄子叶在1/2MS+TDZ 3.0 mg/L +NAA 0.1 mg/L培养基上诱导效果最好,诱导率达9.8%,以MS+NAA 0.2 mg/L培养基诱导生根效果最好。[结论]该研究为在生物技术育种层面上的研究奠定基础。
关键词 红菜薹;离体再生;建立
中图分类号 S634文献标识码 A文章编号 0517-6611(2018)34-0030-03
菜薹(Brassica campestris L.)又名菜心,是芸薹属芸薹种白菜亚种的菜薹变种[1],原产于我国南部地区,是两广地区及海南、台湾等地主要特菜之一。离体再生体系的建立在作物种质创新中具有重要作用,随着转基因技术、基因编辑技术的日益发展,离体高效率的再生体系显得尤为重要。但是,蔬菜作物的离体再生相对困难,因此建立一套简便实用的离体再生体系对种质创新、生物技术育种具有重要意义。
许多研究者采用菜薹的带柄子叶、原生质体、游离小孢子等进行培养,均取得了一定的成果[2-4]。张鹏等[5]研究认为菜薹以子叶-子叶柄为外植体,不定芽诱导率最高。而何晓明等[6]则认为菜薹再生能力在不同品种间差异很大,Zhang等[7]指出大白菜的基因型对它的再生能力影响极大,虽然一些菜薹品种已经可以进行再生,但是由于材料的专一性强,许多未研究过的品种在基因工程技术方面的应用还是会受到限制。因此,笔者以未报道的红菜薹为研究对象,以带柄的子叶为外植体,探讨TDZ、NAA等不同激素浓度对再生体系的影响,旨在为其在生物技术育种层面上的研究奠定基础。
1 材料与方法
1.1 材料 红菜薹材料为TKD20170 种子由江苏省农业科学院蔬菜研究所提供。
1.2 无菌苗的获取
将种子放到无菌水中浸泡15~20 min;取出种子,用75%的酒精处理40 s,無菌水冲洗3次;最后放到30%双氧水中浸泡15 min,再用无菌水冲洗5次,无菌滤纸吸干表面水分等待播种。将种子接种于MS培养基中。25 ℃下黑暗中萌发2 d,然后移至16 h/d光照,3 000 lx 光强条件下培养。
1.3 分化培养
以5 d苗龄的幼苗为外植体材料。从中挑选健壮的幼苗,切取长0.5 cm左右带柄子叶放入培养皿中,每个处理接种16~20个外植体。每个处理重复3次。接种后放置在25 ℃、2 500 lx光照强度、12 h/d光照时间的环境下进行培养。7 d后统计各处理的出芽数,计算分化率。
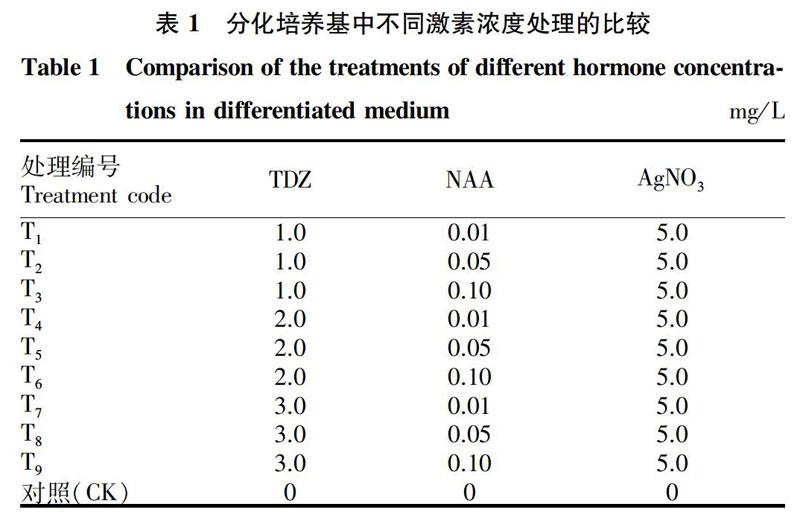
分化培养基:1/2MS培养基为基本培养基,添加不同浓度的TDZ、NAA等植物激素,形成不同的处理条件。T1~T9处理的激素添加的种类及用量见表1。
1.4 组培苗的生根培养
将外植体上分化出的不定芽剪切下来,转到MS基本培养基上培养。待组培苗生长到5~6 cm,并且长出2到3片幼叶时,将其分别转到0、0.1、0.2 mg/L NAA浓度的生根培养基中,促不定根萌发。30 d后取出与CK(0 mg/L)进行比较,筛选出合适的NAA浓度,用于诱导生根。
1.5 组培苗的移栽
组培苗接到生根培养基30~35 d后,待组培苗已长出不定根,用流水冲洗净组培苗根系上的培养基,将其栽入已灭菌的基质中,其上覆盖塑料膜,保持适合其生长的温度、湿度、光照,10 d左右移栽大田,10 d后观察其成活与否。
2 结果与分析
2.1 红菜薹在不同激素配比的分化培养基上的诱导效果
将带柄子叶接到T1~T9处理的分化培养基中,7 d后分别观察不同处理的幼苗诱导数。观察发现T1~T5处理只有愈伤产生,并无芽点形成。T6~T9处理中部分带柄子叶有不定芽产生(图1)。
T6、T7、T8处理尽管可以分化出不定芽,但分化率很低。T6处理分化率为1.79%、T7处理的分化率为2%、T8处理的分化率为3.85%。T9处理分化率可达9.80%,表明T9处理激素比例是最佳配比(表2)。
2.2 红菜薹生根培养基的选择
将外植体分化获得的芽接种到MS基本培养基上培养(图2A),10~20 d后可发育成小植株(图2B)。获得的无菌苗接到不同NAA浓度的培养基中进行生根培养(图2C)。根据图2D可知,含有0.2 mg/L NAA的培养基中长出的根数目最多,根细长、粗壮,植株生长势最好。因此,红菜薹无菌苗以0.2 mg/L NAA培养基诱导,最利于红菜薹生根,并最终生长成苗(图2E)。
3 结论与讨论
许会会等[4]对麻叶薹菜研究发现,最适培养基为MS+BA 5 mg/L+ZT 2 mg/L+NAA 0.7 mg/L,分化率为67.8%。在此基础上,笔者尝试了十几种在菜薹、菜心、不结球白菜、大白菜上已经报道的配方,这些配方在红菜薹TKD201701上均未得到再生芽(数据未发表),推测这个红菜薹基因型可能属于顽拗型基因型。尽管比较难再生,但在该研究中,在培养基1/2MS+TDZ 3.0 mg/L +NAA 0.1 mg/L上,红菜薹仍然得到9.8%的分化率。在分化率统计上,许多研究利用再生的芽数/外植体数来计算,这样比例很高。该研究利用试验中能够再生不定芽的外植体数/总外植体数来计算,客观的反应一个基因型的难易程度。虽然,该研究中红菜薹分化率不高,但是仍然为红菜薹在基因工程方面的后续研究奠定了基础。
在诱导菜薹不定芽分化的培养基上,尽管T1处理与T7处理、T2与T8处理、T3与T9处理的培养基都添加了等量的硝酸银与萘乙酸,但是T1、T2、T3生理培养基上却没有芽再生,由此可见TDZ在芽的再生上起较大的作用。而随着TDZ浓度的升高,再生率也变高,这同样验证了TDZ的重要性。低浓度的TDZ培养基中,不同浓度的NAA并不能起到提高再生率的作用。但是在高浓度TDZ培养基上,随着NAA浓度的提高,其芽再生率也在变高。由此可见TDZ、NAA在诱导菜薹带柄子叶的再生上都起到了一定的作用,但是TDZ的作用更关键。
参考文献
[1]李曙轩,李树德,蒋先明,等.中国农业百科全书·蔬菜卷[M].北京:农业出版社,1990:33-34.
[2]叶志彪,李汉霞.红菜薹原生质体培养植株再生[J].园艺学报,1993,20(4):405-406.
[3]王涛涛,李汉霞,张继红,等.红菜薹游离小孢子培养与植株再生[J].武汉植物学研究,2004,22(6):569-571.
[4]许会会,赵美爱,钤泰琳,等.薹菜再生体系的建立[J].西北农业学报.2010,19(8):198-201.
[5]张鹏,凌定厚.提高菜心离体植株再生频率的研究[J].植物学报,1995,37(11):902-908.
[6]何晓明,潘瑞炽.薹菜组织培养和植株再生研究[J].上海农业学报,200 17(2):34-40.
[7]ZHANG F L,TAKAHATA Y,XU J B.Medium and genotype factors influencing shoot regeneration from cotyledonary explants of Chinese cabbage(Brassica campestris L.ssp.pekinensis)[J].Plant Cell Rep,1998,17(10):780-786.
