超声辅助水热法提取牛骨油工艺参数优化
2018-05-13刘文媛张春晖郑乾坤李元亮张兆静
刘文媛,贾 伟,李 侠,张春晖,※,郑乾坤,李元亮,李 敏,张兆静
(1. 中国农业科学院农产品加工研究所,北京 100193;2. 得利斯集团有限公司,潍坊 262216;3. 山东凤祥股份有限公司,聊城 252000)
0 引 言
骨占动物总质量的20%~30%,是肉类工业的主要副产物。中国每年产生的骨头约1 200多万t,资源非常丰富[1]。骨中富含蛋白质、脂肪和矿物质等营养成分[2-5],张春晖[1]阐述了系列骨源食品,包括骨素、骨泥、骨蛋白、骨糖及骨油产品的生产及应用,Jia等[6]在牦牛骨中检测出共轭亚油酸。长期以来,中国对骨副产物的精深加工和高值化利用比例不足 10%,骨资源未被充分有效地利用,造成资源浪费和环境污染[1]。因此,将骨副产物转化为高附加值产品,提高其经济价值并减少对环境的危害已成为人们关注的焦点。
常用的动物脂质提取方法有有机溶剂法、超声辅助法、酶法、酸碱法和蒸煮法等[7-12]。有机溶剂法提油效率较高,但存在耗时长、健康危害高、溶剂残留等问题。超声辅助法应用超声波产生的空化作用以及伴随空化作用产生的次级效应,如热效应、机械效应等,能够有效地加速油脂成分的扩散和溶出[13-14]。酶法提油速率快但分离不易,后续加工困难且成本较高。酸碱法提油速率较快,但受酸碱液的浓度影响较大,且容易对原料中的蛋白造成损伤。蒸煮法在生产实践中以高温高压蒸煮为主,伴随分离、浓缩和纯化等过程。但该法的提取率较低,高温高压的操作条件使得生产成本较高,且可能对油脂的一些成分造成损害,此外残留油脂还会影响其他组分的分离和提取效率。对于骨中脂质的提取(或去除),热碱法及酶解法在鱼骨油的提取中应用较多,蒸煮法在鸡骨和猪骨的油脂提取中应用较为广泛[5,12,15]。
蒸煮法提取动物骨中油脂在食品企业中应用广泛,但提取温度高,耗时长,且油脂的提取率低。目前尚未发现将超声波与蒸煮提油联用的相关文献或工艺的公开报道或应用。针对超声波的作用,本研究拟采用超声辅助水热提取法提取牛骨中的油脂,依据食品企业骨副产物加工工艺生产实践和生产成本、经济效益的考量,设定超声辅助水热提取牛骨油的工艺参数,通过单因素试验探究各因素对牛骨油提取率的影响,同时结合响应面分析法对超声辅助水热提取牛骨油工艺进行优化并确定最佳工艺,提高骨油提取率并保持骨油品质,降低生产成本。
1 材料和方法
1.1 材料与试剂
原料骨:随机选取山东泗水县地区自然放牧条件下2~3岁的发育正常的健康公牛6头,屠宰后取其股骨(不含软骨)剔除碎肉、筋等杂质,晾干后将其粉碎得到3~5 mm的骨颗粒于-80℃保存备用。
标准品及试剂:37脂肪酸甲酯混标(FAME Mix 37,Sigma);十一碳酸甘油三酯(Glyceryl triundecanoate,≥98%,Sigma,内标);甲醇和正己烷均为色谱纯,分别购自赛默飞世尔科技公司和北京迈瑞达科技有限公司;其它试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
FW 100高速万能粉碎机:天津泰斯特仪器有限公司;HH-6数显恒温水浴锅:常州智博瑞仪器制造有限公司;Allegra X-12R型冷冻离心机:美国Beckman Coulter有限公司;配有氢火焰离子化检测器的气相色谱仪GC-FID,Varian 450:安捷伦科技中国有限公司;自动进样器 CP 8400,CP-Sil 88毛细管柱(100 m×0.25 mm×0.2 μm):安捷伦科技中国有限公司;SER148脂肪测定仪:意大利VELP公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;YQ1001C 超声清洗器:上海易净超声波仪器有限公司。
1.3 方 法
1.3.1 超声辅助水热提取牛骨油工艺流程
牛骨→剔除筋膜、肉等杂质→粉碎→与蒸馏水以一定的料液比混合→超声处理→水热提取→离心分离→收集油脂。牛骨油提取率计算如公式(1)。
牛骨油提取率(R1)= 提取的牛骨油质量/牛骨中脂肪总质量×100% (1)
总脂肪质量分数测定:按照GB5009.6-2016《食品安全国家标准 食品中脂肪的测定》,采用索氏抽提法测定鲁西黄牛股骨中脂肪质量分数。
1.3.2 单因素试验
超声辅助水热提取牛骨油过程中影响牛骨油提取率的因素较多,如超声功率、超声时间、超声温度、热提温度、热提时间、料液比等。首先采用单因素试验考察这些因素对牛骨油提取率的影响,每个单因素水平重复3次测定。
1)超声功率对牛骨油提取的影响
固定超声波频率28 kHz、超声时间30 min、超声温度90 ℃、热提温度115 ℃、热提时间30 min、料液比(质量比,下同)1∶2,考察不同超声功率(200、300、400、500、600 W)对牛骨油超声辅助水热提取的提取率的影响,同时设立对照组进行比较,对照组为水浴时间30 min、水浴温度90 ℃、热提温度115 ℃、热提时间30 min、料液比1∶2。
2)超声时间对牛骨油提取的影响
固定超声波频率28 kHz、超声功率300 W、超声温度90 ℃、热提温度为115 ℃、热提时间30 min、料液比1∶2,考察不同超声时间(0、20、30、40、50、60 min)对提取率的影响。
3)超声温度对牛骨油提取的影响
固定超声波频率28 kHz、超声功率300 W、超声时间30 min、热提温度115 ℃、热提时间30 min、料液比1∶2,考察不同超声温度(60、70、80、90、100 ℃)对提取率的影响。
4)热提温度对牛骨油提取的影响
固定超声波频率28 kHz、超声功率300 W、超声时间30 min、超声温度为90 ℃、热提时间30 min、料液比1∶2,考察不同热提温度(105、110、115、120、125 ℃)对提取率的影响。
5)热提时间对牛骨油提取的影响
固定超声波频率28 kHz、超声功率300 W、超声时间30 min、超声温度90 ℃、热提温度115 ℃、料液比1∶2,考察不同热提时间(10、30、50、70、90 min)对提取率的影响。
6)料液比对牛骨油提取的影响
固定超声波频率28 kHz、超声功率300 W、超声时间30 min、超声温度90 ℃、热提温度115 ℃、热提时间30 min,考察不同料液比(1∶3、1∶2.5、1∶2、1∶1.5、1∶1)对提取率的影响。
1.3.3 响应面法设计试验
在单因素试验的基础上,依据 Box-Behnken 试验设计要求,以超声功率(A)、超声时间(B)、超声温度(C)、热提温度(D)、热提时间(E)和料液比(F)为考察变量,结合单因素试验结果、实验室仪器设备的局限和生产成本及经济效益的考量,选取各因素适宜的高低水平,采用六因素三水平的响应曲面分析方法,以牛骨油提取率R1(%)为评价指标,应用Design-Expert 8.0软件设计响应面试验,寻找最佳提取率工艺下各因素的最佳水平。Box-Behnken试验因素与水平设计如表1所示。
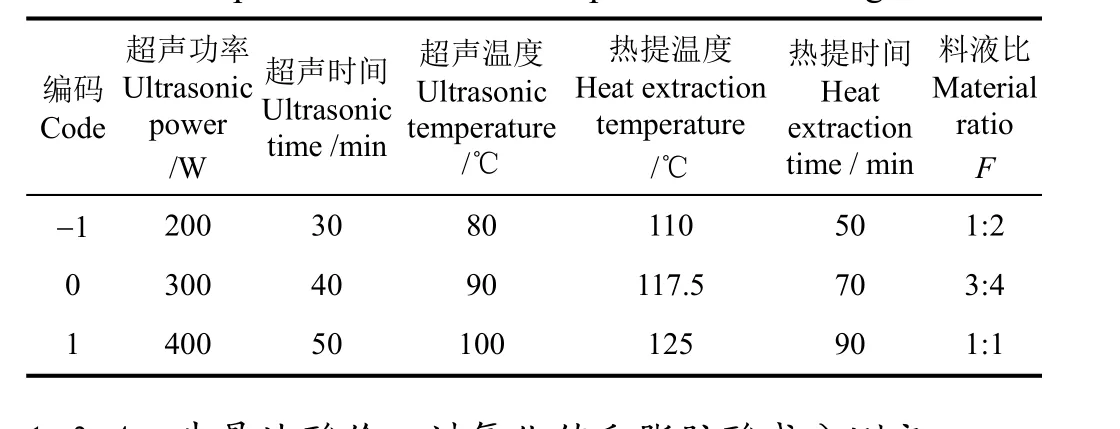
表1 超声辅助水热提取牛骨油响应面分析因素水平编码表Table 1 Coded values of corresponding actual values of independent variables in response surface design
1.3.4 牛骨油酸价、过氧化值和脂肪酸成分测定
酸价:参照 GB 5009.229-2016[16]《食品安全国家标准 食品中酸价的测定》;
过氧化值:参照 GB 5009.227-2016[17]《食品安全国家标准 食品中过氧化值的测定》;
脂肪酸甲酯化:采用乙酰氯-甲醇法[6]对骨油甲酯化处理并进行气相色谱分析。
2 结果与分析
经测定鲁西黄牛股骨中脂肪质量分数为25 g/100 g。
2.1 单因素试验结果与分析
2.1.1 超声功率、超声时间和超声温度对牛骨油提取的影响
超声辅助水热提取牛骨油过程中超声功率、超声时间和超声温度对牛骨油提取率的影响见图1。
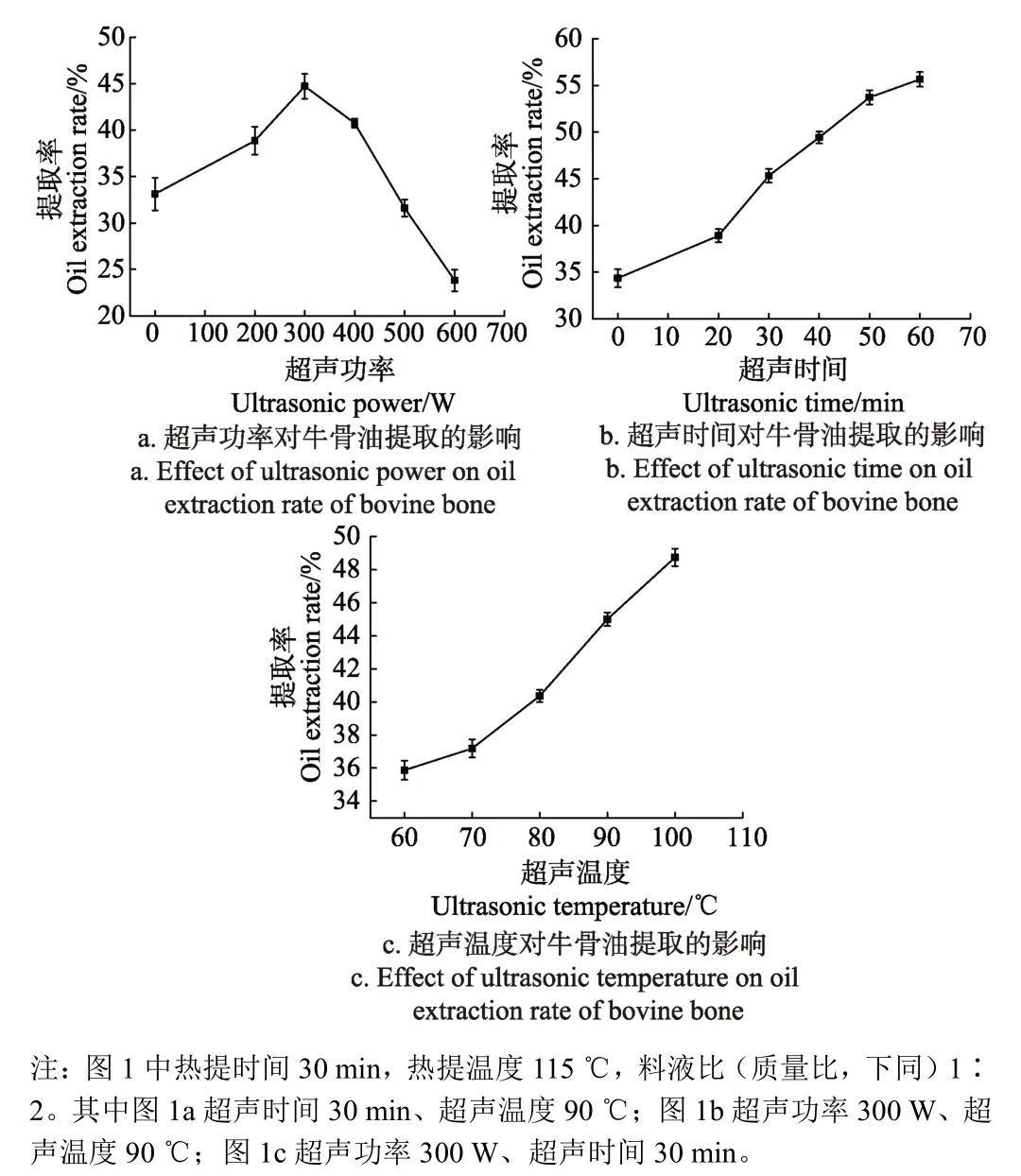
图1 超声功率、超声时间和超声温度对牛骨油提取的影响Fig.1 Effect of ultrasonic power, ultrasonic time and ultrasonic temperature on oil extraction rate of bovine bone
从图 1a可以看出,与对照组相比,当超声功率在200~500 W时,超声后热提有助于牛骨油提取率的提升,而当超声功率在500~600 W时,超声后热提提取率低于水浴后热提的提取率。当超声功率在200~300 W时,随着超声功率的增大,空化效应和机械振动增强从而促进分子的扩散速度,同时提高了传质速率[18-19],促进骨中油脂的溶出。此外超声波与料液作用产生大量的泡沫,而大量泡沫破碎后产生的局部瞬间压力形成冲击波,该能量能促使细胞破裂也有利于油脂的抽提[20],因此从牛骨中释放油脂的效率得到了改善。当超声功率超过300 W时,提取率开始下降。这可能是由于随着超声功率的不断增强,溶液中产生自由基,自由基对油脂有破坏作用[18],并且超声功率过高将导致超声局部瞬间温度增加,油脂发生变化产生损耗[21-23],从而导致提取率的下降。当超声功率为300 W时,牛骨油的提取率最高,为44.72%。
从图1b可以看出,提取率随超声时间的延长呈上升趋势。在超声时间为20~50 min时,提取率随超声时间迅速提高,而在50~60 min内,提取率增加趋势变缓。超声波的作用是从牛骨颗粒表面开始逐步向内部扩散,扩散区域逐渐减少的同时距离增加,从而扩散率相应减少[24]。因此当达到一定的超声处理时间后,提取率增加趋势减缓。并且当超声波的作用完全抵达牛骨颗粒内部时,继续延长时间则不会再对牛骨颗粒产生影响。依据生产实际和成本考虑,本研究设定的超声时间范围为0~60 min。在本研究的超声时间范围内,提取率随超声时间的延长一直呈现上升的趋势,当超声时间为60 min时,提取率达到了最高值55.65%。
从图1c可以看出,提取率随着超声温度的提高而逐渐升高。当超声温度为60~70 ℃时,提取率上升趋势较缓,而当超声温度从70 ℃上升到100 ℃,提取率上升趋势较大。高温下的蒸汽压利于气泡的形成,而超声处理温度能够影响料液中生成的气泡数量和气泡内水蒸气的含量,含有蒸汽的气泡破裂形成的冲击波的能量有助于油脂的溶出[21],因而提取率随超声温度的提高呈现上升趋势。但同时气泡破裂产生的缓冲效应也会削弱空化效应[18,25],因此当升高至一定温度后,超声波的作用将被富含水蒸气的气泡中和,从而提取率将保持不变或降低趋势。依据生产实际和成本考虑,本研究设定的超声温度范围为 60~100 ℃。在本研究的超声温度范围内,提取率随超声温度的提高一直呈现上升趋势,当超声温度为100 ℃时,提取率达到最高为48.74%。
2.1.2 热提温度和热提时间对牛骨油提取的影响
热提温度和热提时间对提取率的影响见图2。
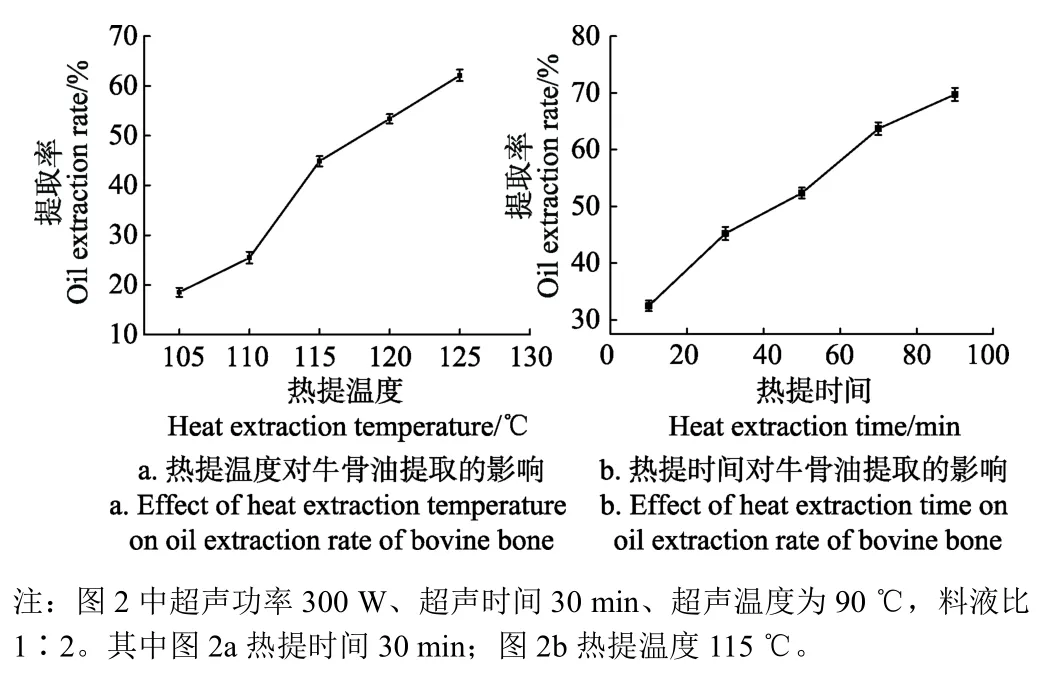
图2 热提温度和热提时间对牛骨油提取的影响Fig.2 Effect of heat extraction temperature and time on oil extraction rate of bovine bone
从图2a可以看出,提取率随着热提温度的提高呈上升趋势且提高幅度较大,当热提温度为110~115 ℃时提取率上升趋势最大。提取温度的升高增加了水分子和油脂分子的动能,促进了扩散运动的进行,提取率增加[26]。高温形成的蒸汽压促进气泡的形成,而热提温度影响料液中气泡数量和气泡内水蒸气含量,含有蒸汽的气泡破裂形成的冲击波的能量也有助于油脂的溶出[21]。当热提温度为125 ℃时提取率达到最高为62.13%。但研究表明,热提温度过高也可能会引起油脂组分的分解从而导致提取率的降低[27]。由于试验设备的限制及生产实践中热提温度的参考,本研究设定的热提温度为105~125 ℃,牛骨油提取率随热提温度的升高呈持续上升趋势。
从图 2b可以看出,在本研究设定的热提时间范围内,提取率随着热提时间的延长呈上升趋势且上升幅度较大,其中当热提时间为10~30 min时提取率上升幅度最大,当热提时间为 90 min时提取率达到最高为69.73%。
2.1.3 料液比对牛骨油提取的影响
料液比对提取率的影响见图3。料液比为1∶3~1∶1.5时,提取率随着料液比的增大(溶剂质量减小)呈上升趋势。这一现象遵循质量传递原则,当溶剂与原料的比例增加时,随着浓度梯度的增大促使传质推动力的增加[18,28-30]。在料液比为 1∶1.5时提取率达到最高为54.39%。而料液比继续增大(1∶1.5~1∶1)提取率逐渐呈现下降趋势。
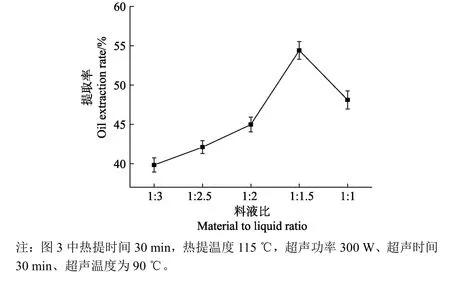
图3 料液比对牛骨油提取的影响Fig.3 Effect of ratio of material to liquid on oil extraction rate of bovine bone
2.2 响应面法优化超声辅助水热提取牛骨油工艺
2.2.1 Box-Behnken试验设计与结果
响应面试验共54个试验点,其中48个为析因点,6个零点试验以估计误差。响应面试验结果如表 2所示,R1表示提取率(%)。
通过 Design-Expert 8.0软件对数据进行多元回归拟合分析,提取率(R1)与超声功率(A)、超声时间(B)、超声温度(C)、热提温度(D)、热提时间(E)和料液比(F)之间建立二次回归模型如公式(2)。

2.2.2 回归方程显著性分析
为了考察模型的拟合度,寻找主效应显著性以及各因素之间的相互作用,对回归方程进行 ANOVA方差分析,其结果如表3所示。
从表 3中可以看出,该模型的 P<0.000 1,F值为47.463 7,说明所选模型极显著。方差结果表明该模型与试验的拟合度高,回归方程可以很好地准确分析和预测各因素与提取率之间的关系。通过P值的检验结果发现,该模型一次项B、C、D、E、交互项DE的P值小于0.000 1,对模型贡献大,因此其对骨油提取率影响极显著,而一次项A、二次项A2的P值小于0.05,表明其对骨油提取率影响显著。此外,交互项AD、BC、BE、二次项D2、E2的P值小于0.15,是影响骨油提取率的重要因子。由F检验可以得出因子贡献率为热提温度>热提时间>超声时间>超声温度>超声功率>料液比,其中热提温度和热提时间对骨油提取率的影响显著大于其他因素,料液比对骨油提取率的影响较小。
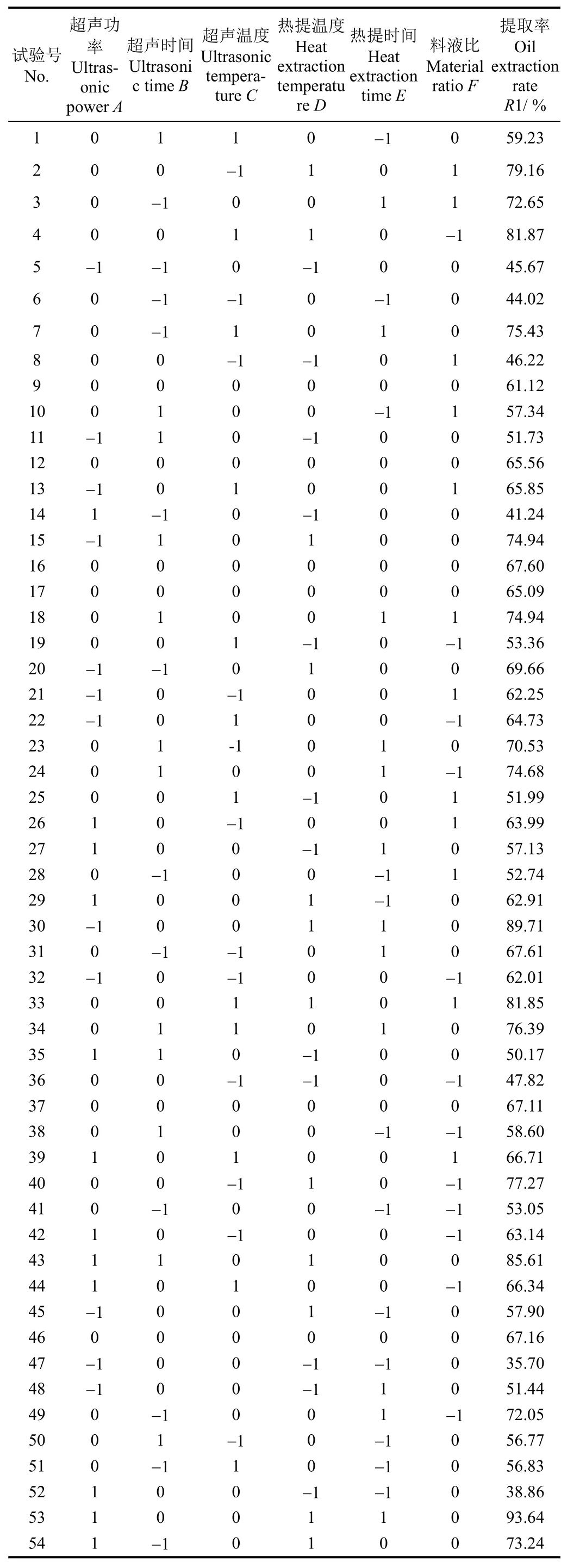
表2 超声辅助水热提取牛骨油响应面分析试验设计及结果Table 2 Experimental design for response surface analysis and corresponding experimental data
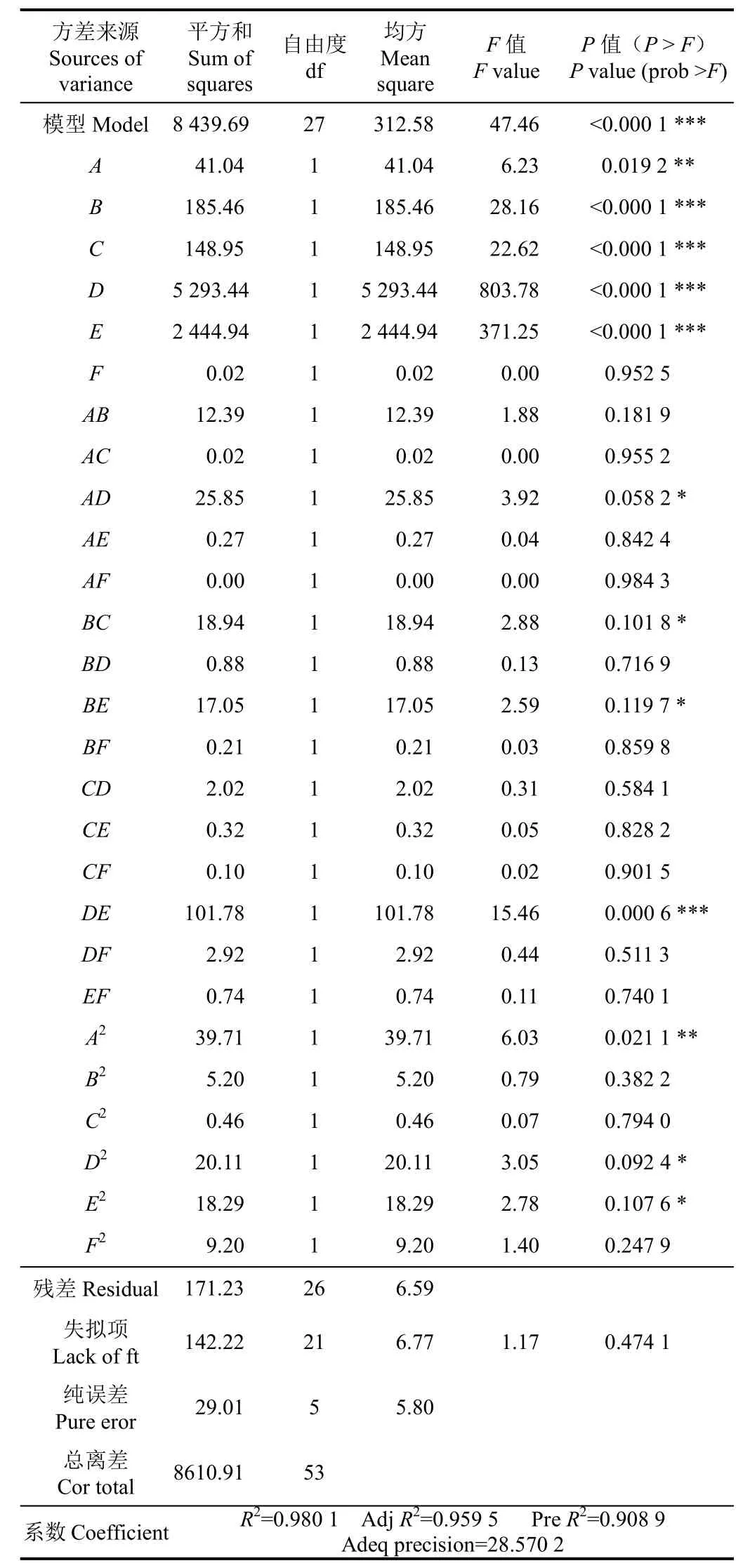
表3 方差分析表Table 3 Analysis of variance table
2.2.3 响应曲面分析
依据各因素对骨油提取率的影响,选择A、B、C、D和E 5个因素,根据回归拟合函数,每2个因素对骨油提取率画出响应面和等高线图,考虑到定性分析各因素对骨油提取率的关系,固定另外4个因素时,均作“0”水平处理。图4为AD、BC、BE、DE交互作用响应面图。
由图 4可知,对牛骨油提取率影响显著的因素,表现为曲线较陡,响应值变化较大;对牛骨油提取率影响不显著的因素,响应曲面较为平滑,响应值变化较小。分析响应曲面图,AD、BC、BE、DE的交互作用对牛骨油提取率的影响较显著。
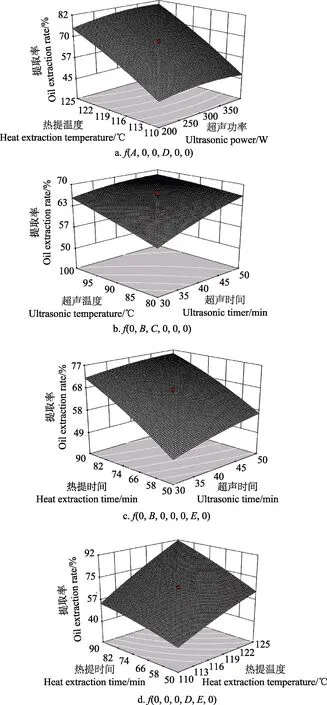
图4 AD、BC、BE、DE交互作用对牛骨油提取率的影响Fig.4 Effect of the interaction of various factors of AD, BC, BE and DE on oil extraction rate of bovine bone
对A、B、C、D和E 5个因素的两两交互作用进行权重分析,由权重得分(见表4)得出各因素两两交互对牛骨油提取率的影响 DE>AD>BC>BE>AB>CD>BD>CE>AE>AC。这与响应曲面结果互相验证。
2.2.4 响应面优化超声辅助水热提取牛骨油工艺
利用Design-expert软件对所得到的回归方程进一步分析,优化工艺条件,选取最佳的超声辅助水热提取工艺参数为:超声功率329.58 W、超声时间49.94 min、超声温度99.17 ℃、热提温度124.97 ℃、热提时间89.86 min、料液比 1∶1,模型预测在此超声辅助水热提取条件下的理论提取率为95.32%。考虑到实际操作的便利、成本等因素,修正超声辅助水热提取工艺参数为:超声功率300 W、超声时间50 min、超声温度100 ℃、热提温度125 ℃、热提时间90 min、料液比为1∶1,进行验证试验。使用上述优化超声辅助水热提取条件进行 3次重复的验证试验,得到实际牛骨油提取率为98.86%,高于理论提取率95.32%,验证值与预测值的相对误差为3.71%,误差较小,表明验证值与模型所得到的预测值基本接近,优化结果具有可靠性。
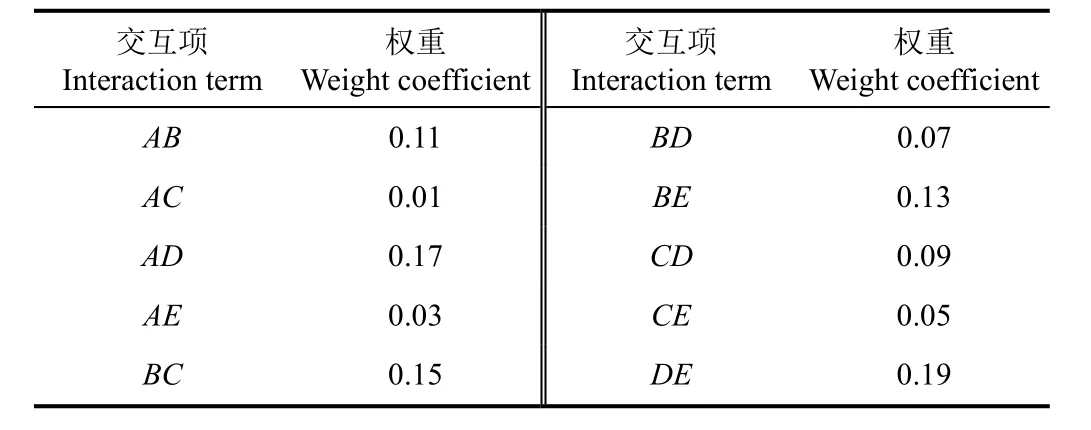
表4 各因素交互作用权重分析Table 4 Weight analysis of interaction of various factors
2.3 牛骨油品质分析
对优化超声辅助水热提取工艺得到的牛骨油和水浴-热提取工艺得到的牛骨油(对照组)进行品质分析,其中,水浴-热提取工艺为:水浴时间50 min、水浴温度100 ℃、热提温度125 ℃、热提时间90 min、料液比为1∶1;检测结果见表5。
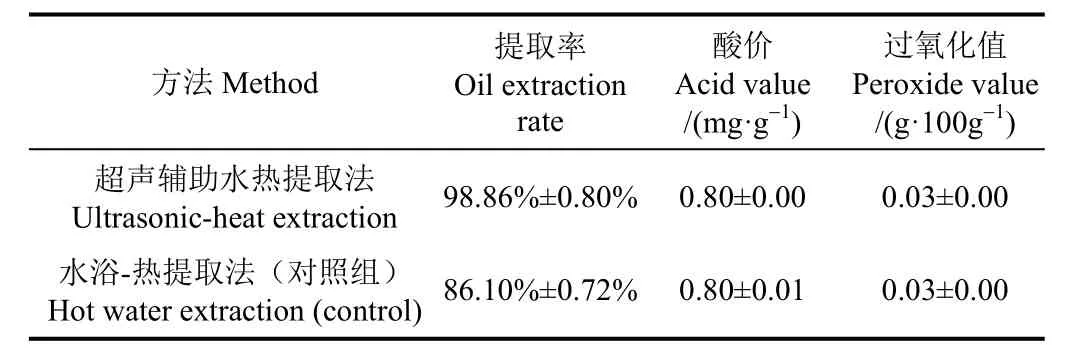
表5 不同方法提取的牛骨油品质分析Table 5 Comparison of bovine bone oil by different extraction methods
由表5可以看出,2种工艺得到的牛骨油酸价、过氧化值结果相同,均远小于GB 10146-2015规定(酸价<2.5 mg/g;过氧化值<0.20 g/100g)。由表6可看出牛骨油中共检测出17种脂肪酸,主要在C10~C21之间。其中饱和脂肪酸(saturated fatty acid, SFA)达11种,质量分数占总脂肪酸的 49%。牛骨油中单不饱和脂肪酸占不饱和脂肪酸(unsaturated fatty acid, UFA)总量的94%。C18:1n9c、C16:0和C18:0是牛骨油的主要脂肪酸,三者之和达总脂肪酸85%左右,其中C18:1n9c达总脂肪酸43%左右。牛骨油中SFA与UFA比值在1:1左右,UFA略高于SFA。此外,牛骨油中检测出反式脂肪酸C18:1n9t的存在,含量为3.36 g/100g油。由于反刍动物瘤胃微生物和酶的氢化作用,其UFA容易被氢化而以SFA和反式脂肪酸的形式由肠道吸收并沉积在组织中,因而牛骨油中 SFA和UFA含量差异较小[31-32]。
由表6可看出2种工艺得到的牛骨油脂肪酸组成相同,但与对照组相比,超声辅助水热提取得到的牛骨油中 C10:0,C14:0,C15:0,C16:0,C17:0,C18:0,C18:1n9c,C18:2n6c,C20:1和C21:0共10种脂肪酸及SFA和总脂肪酸的质量分数显著较高。且超声辅助水热提取工艺的提取率(98.86%)显著高于水热提取工艺(86.10%)。

表6 不同方法提取的牛骨油脂肪酸质量分数Table 6 Comparison of fatty acid in bovine bone oil by different extraction methods /(g·100g-1)
3 结 论
1)采用超声辅助水热提取技术对牛骨中的脂质进行提取,试验分析结果显示各因素对牛骨油提取率的影响顺序为:热提温度>热提时间>超声时间>超声温度>超声功率>料液比,其中热提温度和热提时间对骨油提取率的影响远远大于其他因素,料液比对骨油提取率的影响很小。
2)根据单因素试验结合响应面分析法,得到超声辅助水热提取牛骨油的最佳工艺条件为超声波频率28 kHz、超声功率300 W、超声时间50 min、超声温度100 ℃、热提温度125 ℃、热提时间90 min、料液比为1∶1,在此工艺条件下,牛骨油提取率为98.86%,较对照组牛骨油提取率提高约12%。
3)对优化工艺条件后得到的牛骨油进行品质分析,结果显示牛骨油的酸价、过氧化值均小于GB10146-2015规定。对牛骨油脂肪酸成分分析发现C18∶1n9c、C16∶0和 C18∶0是牛骨油的主要脂肪酸,分别达总脂肪酸44%、23%和19%左右,牛骨油中饱和脂肪酸(saturated fatty acid, SFA)与不饱和脂肪酸(unsaturated fatty acid,UFA)比值约为1∶1,UFA略高于SFA。
经优化后超声辅助水热提取工艺在保证骨油品质的同时提高牛骨油得率,为企业的工业化生产提供了参考。
[参 考 文 献]
[1] 张春晖. 骨源食品加工技术[M]. 北京:科学出版社,2015.
[2] John P. The structure and components of collagen containing tissues [C]// Ward A G, Cours A. The Science and Technology of Gelatin. London: Academic Press, 1977, 31-72.
[3] Eastridge M L. Major advances in applied dairy cattle nutrition[J]. J Dairy Sci, 2006, 89(4): 1311-1323.
[4] Parfitt A M. The cellular basis of bone turnover and bone loss a rebuttal of the osteocytic resorption-bone flow theory[J].Clin Orthop Relat Res, 1977(127): 236-247.
[5] Wang Jinzhi, Dong Xianbin, Yue Jianying, et al. Preparation of substrate for flavorant from chicken bone residue with hot-pressure process[J]. J Food Sci, 2016, 81(3): 578-586.
[6] Jia Wei, Liu Wenyuan, Mi Si, et al. Comparison of six methylation methods for fatty acid determination in yak bone using gas chromatography[J]. Food Anal Method, 2017,11(10): 3496-3507.
[7] 孙丽霞,杨红,张丽芳,等. 不同方法提取罗非鱼内脏油脂中脂肪酸的 GC-MS比较分析[J]. 食品科技, 2015,40(5):260-264.Sun Lixia, Yang Hong, Zhang Lifang, et al. Gas chromatography-mass spectrometry analysis of fatty acids in tilapia offal oil with different extraction methods[J]. Food Science and Technology, 2015, 40(5): 260-264. (in Chinese with English abstract)
[8] 高娟,楼乔明,杨文鸽,等. 超声辅助提取鱿鱼肝脏油脂及其脂肪酸组成分析[J]. 中国粮油学报,2014,29(2):53-56.Gao Juan, Lou Qiaoming, Yang Wenge, et al.Ultrasonic-assisted extraction of oil from squid liver and analysis of fatty acid composition[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(2): 53-56. (in Chinese with English abstract)
[9] 曹璇,申铉日. 超声波辅助稀碱水解法提取金鲳鱼骨油的工艺优化与脂肪酸组成分析[J]. 食品科学,2017,38(18):280-285.Cao Xuan, Shen Xuanri. Optimization of ultrasonic-assisted dilute alkali extraction of trachinotus ovatus bone oil and analysis of its fatty acid composition[J]. Food Science, 2017,38(18): 280-285. (in Chinese with English abstract)
[10] 邱澄宇. 酶解法所获鳗骨油品质的研究[J]. 水生生物学报,2003,27(2):161-163.Qiu Chengyu. The characters of oil extracted from eel bone by enzyme hydrolysis[J]. Acta Hydrobiologica Sinica, 2003,27(2): 161-163. (in Chinese with English abstract)
[11] 邱朝坤,范露,李蕊江. 猪骨油的提取及碱炼工艺研究[J].安徽农业科学,2013,41(19):8307-8309.Qiu Zhaokun, Fan Lu, Li Ruijiang. Research on process of extraction and alkali refining of pig bones oil[J]. Journal of Anhui Agricultural Sciences, 2013, 41(19): 8307-8309. (in Chinese with English abstract)
[12] 郇兴建,胡序建,冯立斌,等. 制备猪骨天然提取物的高压蒸煮工艺优化[J]. 食品科学,2012,33(8):15-17.Huan Xingjian, Hu Xujian, Feng Libin, et al. Optimization of high pressure cooking process for preparation of natural extract of pig bones[J]. Food Science, 2012, 33(8): 15-17.(in Chinese with English abstract)
[13] 左笑,张东翔. 超声波在油脂提取中的应用[J]. 粮油加工,2007,(11):70-73.
[14] 罗登林,丘泰球,卢群. 超声波技术在油脂工业中的研究进展[J]. 粮油加工与食品机械,2005(3):48-50.
[15] 岳鉴颖,王金枝,张春晖,等. 提取时间对鸡骨蛋白凝胶特性和蛋白二级结构的影响[J]. 中国农业科学,2017,50(5):903-912.Yue Jianying, Wang Jinzhi, Zhang Chunhui, et al. Effect of extraction time on characteristics of gelatin and secondary structure of chicken bone protein[J]. Scientia Agricultura Sinica, 2017, 50(5): 903-912. (in Chinese with English abstract)
[16] 国家卫生和计划生育委员会. 食品中酸价的测定,GB5009.229-2016 [S]. 北京:中国标准出版社.
[17] 国家卫生和计划生育委员会. 食品中过氧化值的测定GB5009.227-2016 [S]. 北京:中国标准出版社.
[18] Lou Zaixiang, Wang Hongxin, Zhang Ming, et al. Improved extraction of oil from chickpea under ultrasound in a dynamic system[J]. J Food Eng, 2010, 98(1): 13-18.
[19] 罗秋水,上官新晨,蒋艳,等. 超声波辅助提取紫红薯糖蛋白工艺的优化[J]. 中国食品学报,2013,13(3):110-114.Luo Qiushui, Shangguan Xinchen, Jiang Yan, et al.Optimization on ultrasonic-assisted extracting glycoprotein from the purple sweet potato [J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(3): 110-114. (in Chinese with English abstract)
[20] Hemwimol S, Pavasant P, Shotipruk A. Ultrasound-assisted extraction of anthraquinones from roots of Morinda citrifolia[J]. Ultrason Sonochem, 2006, 13(6): 543-548.
[21] Toma M, Vinatoru M, Paniwnyk L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J]. Ultrason Sonochem, 2001, 8(2): 137-142.
[22] Athanasios C, Nikolas G S, Dimitra J D, et al. Comparison of distillation and ultrasound-assisted extraction methods for the isolation of sensitive aroma compounds from garlic (Allium sativum)[J]. Ultrason Sonochem, 2006, 13(1): 54-60.
[23] Pingret D, Fabiano-Tixier A S, Chemat F. Degradation during application of ultrasound in food processing: A review[J]. Food Control, 2013, 31(2): 593-606.
[24] Zhao S, Kwok K C, Liang H. Investigation on ultrasoundassisted extraction of saikosaponins from Radix Bupleuri[J]. Sep Purif Technol, 2007, 55(3): 307-312.
[25] 孟春玲,王建中,王丰俊,等. 响应面法优化超声波辅助提取沙棘籽油的工艺研究[J]. 北京林业大学学报,2008,30(5):118-122.Meng Chunling, Wang Jianzhong, Wang Fengjun, et al.Optimization of ultrasound-assisted extraction technique of seabuckthorn seed oil by response surface methodology [J].Journal of Beijing Forestry University, 2008, 30(5): 118-122. (in Chinese with English abstract)
[26] 许晖,孙兰萍,李善菊,等. 超声波辅助提取亚麻籽油的工艺条件优化[J]. 中国粮油学报,2009,24(7):64-68.Xu Hui, Sun Lanping, Li Shanju, et al. Optimization of ultrasonic-assisted extraction technology of oil from flaxseeds [J]. Journal of the Chinese Cereals and Oils Association, 2009, 24(7): 64-68. (in Chinese with English abstract)
[27] 易军鹏,朱文学,马海乐,等. 牡丹籽油超声波辅助提取工艺的响应面法优化[J]. 农业机械学报,2009,40(6):103-110.Yi Junpeng, Zhu Wenxue, Ma Haile, et al. Optimization on ultrasonic-assisted extraction technology of oil from paeonia suffruticosa andr. seeds with response surface analysis [J].Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(6): 103-110. (in Chinese with English abstract)
[28] 于修烛,李志西,杜双奎. 苹果籽油超声波辅助浸提及产品理化特性研究[J]. 农业工程学报,2005,21(9):155-159.Yu Xiuzhu, Li Zhixi, Du Shuangkui. Ultrasonic extraction of apple seed oil and its physical-chemical properties [J].Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2005, 21(9): 155-159. (in Chinese with English abstract)
[29] Tian Y, Xu Z, Zheng B, et al. Optimization of ultrasonic-assisted extraction of pomegranate (Punicagranatum L.) seed oil[J]. Ultrason Sonochem, 2013, 20(1):202-208.
[30] Špela S H, Hadolin M, Škerget M, et al. Solvent extraction study of antioxidants from Balm (Melissa officinalis L.)leaves[J]. Food Chem, 2003, 80(2): 275-282.
[31] Harfoot C G. Lipid metabolism in the rumen[J]. Prog Lipid Res, 1978, 17(1): 21-54.
[32] Kepler C R, Hirons K P, Mcneill J J, et al. Intermediates and products of the biohydrogenation of linoleic acid by butyrinvibrio fibrisolvens[J]. J Biol Chem, 1966, 241(6):1350-1354.
