2-(3-(二甲氨基)丙基)-6-((2-硝基苯基)氨基)-1H-苯并[de]异喹啉-1,3(2H)- 二酮的合成
2018-05-12王盼攀浙江工业大学药学院浙江杭州310014
王盼攀(浙江工业大学药学院,浙江 杭州 310014)
0 前言
萘二甲酰亚胺衍生物作为荧光探针[1]、荧光传染器[2]、抗肿瘤药物[3-6]被广泛研究。Amonafide,elinafide和bisnafide是三个相对成功的萘二甲酰亚胺衍生物,在临床试验中作为具有潜力进入不同阶段的药物抗癌剂。 萘甲酰亚胺优于大多数抗肿瘤药物,且并未受多重耐药性的影响。 但是,由于其剂量限制性毒性,迄今没有萘二甲酰亚胺衍生物进入抗肿瘤市场。 因此,对萘酰亚胺进行更多的研究是有意义和有价值的。
一种提高萘二甲酰亚胺细胞毒性的方法是将一个或多个芳香环与萘核融合。Sami等人在1993年首先研究了一系列由蒽合成的化合物[7],相比amonafide,它显示出明显改善的效力,如代表化合物azonafide和ethonafide[8]。 从那以后,很多团体都投入到这个修饰工作中,使用不同的芳香杂环到修饰萘酰亚胺;这样的获得的化合物可以改善抗癌活性和或降低副作用[9-14]。
我们实验室基于上述的文献设计了一个新型萘二甲酰亚胺衍生物,先以4-溴-1,8-萘酐和二甲基氨基丙胺为原料经酰化反应合成中间体,再与邻硝基苯胺进行Buchwald-Hartwig偶联反应,最后经过优化反应条件后,以较高收率合成了化合物。该合成路线具有原料廉价易得、操作简单、催化剂和溶剂低毒环保等特点,具有潜在的工业化应用前景,开辟了一条绿色合成萘二甲酰亚胺衍生物的新途径。
1 实验部分
1.1 试剂和仪器
主要仪器:ZF-1型三用紫外线分析仪 (上海金鹏分析仪器有限公司);XT-5A精密熔点测定仪 (上海济成分析仪器有限公司);Bruker Model AvanceⅢ(500 M)核磁共振仪(TMS为内标,氘代氯仿为溶剂 );Varian 1200质谱分析仪;柱层析200~300目硅胶(山东青岛硕远化工有限公司)。
主要试剂:溶剂经过标准化无水处理;试剂为市售分析纯商品试剂。
1.2 化合物的合成
1.2.1 4-溴-N-(N',N'-二甲基) 氨基丙甲基-1,8-萘二甲酰亚胺的合成
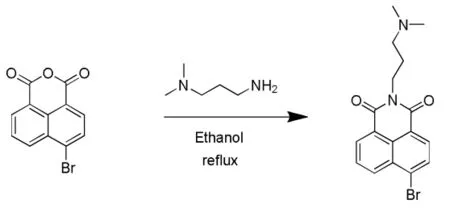
在氮气保护条件下,将 3.5 g(12.6 mmol)4-溴-1,8-萘二甲酸酐溶于乙醇(300 mL)中并加热回流。 然后将1.7 mL的3-二甲基氨基丙胺(13.3 mmol)滴加到混合物中。 所得混合物在搅拌下回流1 h。溶液变清后停止反应。冷却至室温后,向反应混合物中加水,使粗产物沉淀。真空过滤收集沉淀,分别用水和乙醇洗涤三次,最后真空干燥 (产率89%),mp:99.5℃ ~100.1℃(lit.99.4℃~100.8℃ )。1.2.2 2-(3-(二甲氨基)丙基)-6-((2-硝基苯基)氨基)-1H-苯并[de]异喹啉-1,3(2H) - 二酮的合成
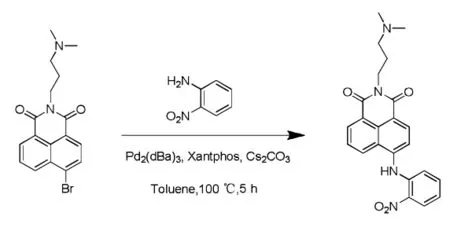
在氮气保护条件下,向配有温度计和回流冷凝管的25 mL三口圆底烧瓶中依次加入中间体1.0 mmol,邻硝基苯胺1.2 mmol,三 (二亚苄-BASE 丙酮)二钯(0) 0.1 mmol,4,5-双(二苯基膦)-9,9-二甲基氧杂蒽 0.1 mmol, 碳酸铯1.5 mmol,甲苯5 mL。 然后,在 100℃下将溶于邻硝基苯胺1.2 mmol的5 mL甲苯溶液滴加到混合物中搅拌反应5 h,反应结束后,冷却至室温,用硅藻土过滤,滤液用乙酸乙酯萃取三次,合并有机相,用饱和食盐水洗涤一次,所得有机层再经无水硫酸钠干燥、过滤,旋蒸浓缩后,获得暗色稠状液体。 最后,用 200~300目硅胶,以二氯甲烷为洗脱液对暗色稠状液体进行柱色谱分离,得橙红色固体0.312 g,收率为 76%.
结构表征数据:1H NMR (500 MHz,CDCl3)δ(ppm):10.12(s,1H), 8.68(dd, J=1.1 Hz,J=7.3 Hz, 1H),8.58(d,J=8.1 Hz,1H), 8.46 (dd, J=1.2 Hz,J=8.5 Hz,1H),8.32 (dd, J=1.6 Hz, J=8.5 Hz,1H),7.85 ~7.78 (m,2H),7.56 ~7.52 (m,1H),7.46(dd,J=1.3 Hz,J=8.6 Hz, 1H,),7.05~7.03(m, 1H),4.30(t, J=7.1Hz, 2H),2.85(t, J=7.7 Hz,2H),2.58(s,6H),2.19~2.13(m,2H).MSESI:m/z 419.1 (M+H)+
2 结果与讨论
在 2-(3-(二甲氨基)丙基)-6-((2-硝基苯基)氨基)-1H-苯并[de]异喹啉-1,3(2H) - 二酮的合成中,原料配比、碱、溶剂、温度和时间对反应的影响比较大。
因此,从原料配比、碱、溶剂、反应温度和时间等方面对反应条件进行优化,探究2-(3-(二甲氨基)丙基)-6-((2-硝基苯基)氨基)-1H-苯并[de]异喹啉-1,3(2H)-二酮的最佳合成条件。
2.1 原料配比
为了得到适宜的原料配比,本文 在100℃温度,0.1 mmol三 (二亚苄-BASE丙酮) 二钯(0),0.1 mmol 4,5-双 (二苯基膦)-9,9-二甲基氧杂蒽,1.5 mmol碳酸铯,10 m L甲苯的条件下,反应5 h,考察不同的原料配比(4-溴-N-(N',N'-二甲基)氨基丙甲基-1,8-萘二甲酰亚胺:邻硝基苯胺)对反应的影响,结果如表1所示。

表1 原料配比对化合物收率的影响Table 1 Effect of raw material ratio on the yield of the compound
表 1的实验结果表明: 当 n(4-溴-N-(N',N'-二甲基)氨基丙甲基-1,8-萘二甲酰亚胺):n(邻硝基苯胺)大于 1.2时,收率随着原料配比的增大而减小。 考虑原料的消耗,本文以 n(4-溴-N-(N',N'-二甲基)氨基丙甲基-1,8-萘二甲酰亚胺):n(邻硝基苯胺)=1.2作为适宜的原料配比。
2.2 碱
碱催化剂选择和碱催化剂投料对反应收率有较大影响:在100℃,1.0 mmol中间体,1.2 mmol邻硝基苯胺,0.1 mmol三(二亚苄-BASE丙酮) 二钯 (0),0.1 mmol 4,5-双 (二苯基膦)-9,9-二甲基氧杂蒽,10 mL甲苯的条件下,反应5 h,考察不同的碱以及改变碱的用量对反应的影响,结果如表2所示。
表2的实验结果表明:相比较于碳酸钾、碳酸钠,以加入碳酸铯效果最佳。所以,选择加入1.5当量碳酸铯为进一步的反应优化条件。
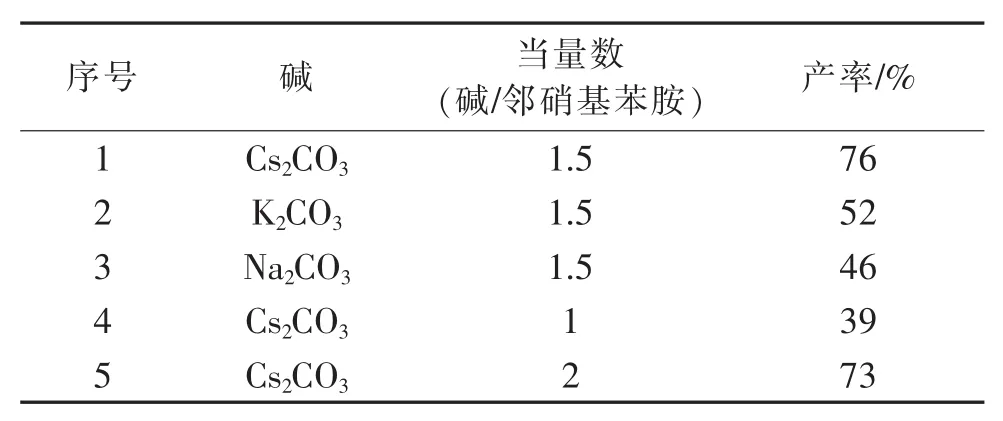
表2 碱对化合物收率的影响Table 2 Effect of different base on the yield of the compound
2.3 溶剂的种类
不同的溶剂对反应也会有不同的影响,在100℃温度,1.0 mmol中间体,1.2 mmol邻硝基苯胺,0.1 mmol三(二亚苄-BASE 丙酮)二钯(0),0.1 mmol 4,5-双 (二苯基膦)-9,9-二甲基氧杂蒽,1.5 mmol碳酸铯的条件下,反应5 h,考察反应溶剂对收率的影响,结果如表3所示。
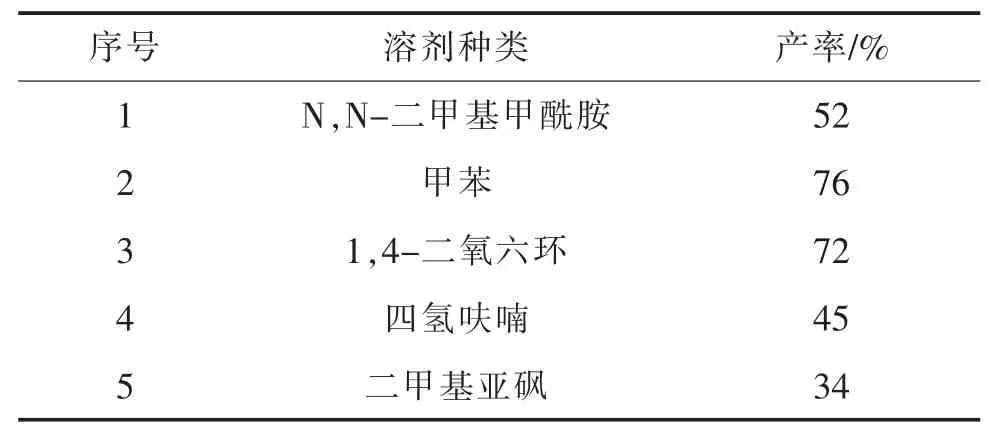
表3 溶剂对化合物收率的影响Table3 Effectofsolventsontheyieldofthecompound
表3的实验结果表明:该反应在 甲苯中具有较高收率,因此以下的条件优化采用甲苯为反应溶剂。
2.4 反应温度
反应温度对化合物收率有重大影响。在1.0 mmol中间体,1.2 mmol邻硝基苯胺,0.1 mmol三(二亚苄-BASE 丙酮)二钯(0),0.1 mmol 4,5-双(二苯基膦)-9,9-二甲基氧杂蒽,1.5 mmol碳酸铯,10 mL甲苯的条件下,反应5 h,考察反应温度对收率的影响,结果如表4所示。
表4的实验结果表明,当温度<100℃时,随着温度的上升选择性上升,当温度达到 100℃时,选择性为76%;随着温度的继续提高 ,选择性稍有下降 。综合考虑,本文以100℃作为适宜的反应温度。

表4 反应温度化合物收率的影响Table 4 Effect of reaction temperature on the yield of the compound
2.5 反应时间
在100℃温度,1.0 mmol中间体,1.2 mmol邻硝基苯胺,0.1 mmol三(二亚苄-BASE丙酮)二钯(0),0.1 mmol 4,5-双(二苯基膦)-9,9-二甲基氧杂蒽,1.5 mmol碳酸铯,10 mL甲苯的条件下,考察反应时间对收率的影响,结果如表5所示。

图5反应时间化合物收率的影响Table 5 Effect of reaction time on the yield of the compound
表5的实验结果表明,当反应时间达到5 h时,反应收率开始下降。原因是当主反应达到平衡后,开始向副产物方向进行。 综合考虑,选择反应时间为5 h为宜。
3 结论与展望
本文以4-溴-1,8-萘酐和3-二甲基氨基丙胺为原料经酰化反应合成中间体,再与邻硝基苯胺进行Buchwald-Hartwig偶联反应得到目标化合物。本方法具有简单、经济、低毒环保等特点,具有潜在的工业化应用前景。
参考文献:
[1] Zou C Y,Gao L Z,Liu T Y,et al.A fuorescent probe based on N-butylbenzene-1,2-diamine for Cu(II) and its imaging in living cells[J].JInclPhenom Macrocycl Chem,2014,80: 383-390.
[2]Mangalath S,Abraham S,Joseph J.pH-Responsive fluo-rescence enhancem-ent in graphene oxide-naphthalimide nanoconjugates:A fluorescence turn-on sensor for acetylcholine[J].Chemistry (Weinheim an der Bergstrasse, Germany) ,2017,23(47):11404-11409.
[3] Brafa M F,Ramos A.Naphthalimides as anti-cancer agents:synthesis and biological activity[J].Curr.Med.Chem.Anticancer Agents, 2001, 1(3): 237.
[4] Brafa M F,Cacho M,Gradillas A,et al.Intercalators as anticancer drugs[J].Curr.Pharm.Des.,2001,7 (17):1745-1780.
[5] Ingrassia L,Lefranc F,Kiss R,et al.Naphthalimides and azonafides as pr-omising anti-cancer agents[J].Med.Chem., 2009, 16(10): 1192.
[6] Lv M,Xu H.Overview of naphthalimide analogs as anticancer agents[J].Curr.Med.Chem., 2009, 16(36):4797.
[7] Sami S M, Dorr R T, Alberts D S,et al.2-Substituted-1,2-dihydro-3H-dibenz[de, h]isoquinoline-1,3-diones.A new class of antitumor agent[J].J.Med.Chem., 1993,36 (6):765-770.
[8] Sami S M,Dorr R T,Solyom A M,et al.6-and 7-Substituted 2-[2'-(dimethylam-ino)ethyl]-1,2-dihydro-3H-di-benz[de,h]isoquinoline-1,3-diones: synthesis,nucleophilic displacements, antitumor activ-ity, and quantitative structure activity relationships[J].J.Med.Chem.,1996,39 (8):1609-1618.
[9] Li Z,Yang Q,Qian X.Novel thiazonaphthalimides as efficient antitu-mor and DNA photocleaving agents:effects of intercalation, side chains, and substituent groups[J].Bioorg.Med.Chem., 2005, 13 (16) :4864-4870.
[10]Brana M F, Cacho M, Ramos A,et al.Synthesis,biological evaluation and DNA binding properties of novel mono and bi-snaphthalimides[J].Org.Biomol.Chem., 2003,1(4):648-654.
[11]Li F, Cui J, Guo L,et al.Molecular design, chemical synthesis, and biological evaluation of ‘4-1’ pentacyclic aryl/heteroaryl-imidazonaphthalimides[J].Bioorg.Med.Chem., 2007,15(15):5114-5121.
[12]Xu Y, Qu B, Qian X,et al.Five-member thio-heterocyclic fused naphthalimides with aminoalkyl side chains:intercalation and photocleavage to DNA[J].Bioorg.Med.Chem.Lett., 2005, 15 (4) :1139-1142.
[13]Qian X, Li Y, Xu Y,et al.Highly efficient DNA photocleavers with l-onwavelength absorptions:thio-heterocyclic fused naphthalimides containing aminoalkyl side chains[J].Bioorg.Med.Chem.Lett., 2004,14 (10):2665-2668.
[14]Yin H,Xu Y,Qian X,et al.Novel Noxide of naphthalimides as prodrug leads against hypoxic solid tumor:synthesis and biological evaluation[J].Bioorg.Med.Chem.Lett.,200717 (8):2166-2170.
