基于表面增强拉曼光谱的小鼠流感血清检测技术
2018-05-11张会敏曲新艳周喆王升启
张会敏 曲新艳 周喆 王升启
1山东省中医药研究院(济南250014);2山东省分析测试中心(济南 250014);3中国人民解放军军事医学科学院放射与辐射医学研究所(北京100850)
流感病毒可引起急性呼吸道传染病,其中以甲型流感病毒传染性最强,且易发生变异,易引起爆发性的流行。目前,甲型H1N1流感病毒检测的常用技术主要有病毒分离培养法、RT⁃PCR检测[1]、胶体金检测等。表面增强拉曼光谱技术(surface⁃enhanced Raman spectroscopy,SERS)具有对样品无损伤、用量少,检测简单、灵敏度高、特异性高的优点,同时克服了常规拉曼光谱信号弱的缺点,因而近年来在临床诊断、生物检测、药品非法添加快检等[2-6]领域得到了较为广泛的应用。国外学者通过SERS鉴定新出现的流感病毒[7],研究表明无需样品扩增或标记,SERS还可直接识别与毒力相关的流感NA突变[8]。因此,本文以纳米银溶胶为活性基底,采用便携式拉曼光谱仪分别检测正常组、模型组、达菲组小鼠血清拉曼增强光谱,并进行正交校正的偏最小二乘辨别分析(OPLS⁃DA),初步探索基于表面增强拉曼光谱的流感血清检测方法,旨在为建立一种快速、简便、低成本,可用于甲型H1N1流感病毒检测的新技术提供实验参考。
1 材料与方法
1.1 实验材料流感病毒株:甲型流感病毒亚型FM1小鼠适用株,由中国疾病预防控制中心提供。干预药物:磷酸奥司他韦片(达菲),临用前配成1 mg/mL;麻醉药物:戊巴比妥钠,实验前用生理盐水配成10 mg/mL;实验动物:SPF级BALB/c小鼠,雄性,体质量18~20 g,购自维通利华实验动物有限公司[许可证号:SCXK(京)2012⁃0001]。
1.2 实验试剂和仪器主要试剂:柠檬酸钠、氯金酸;抗坏血酸、高氯酸银;单晶硅片(浙江立晶)。主要仪器:i⁃Raman Plus BWS465⁃785H 便携式拉曼光谱仪、back⁃illuminated CCD检测器、低温高速离心机、万分之一电子天平、加样枪、加热磁力搅拌器、超声清洗仪、Millli⁃Q超纯水系统。
1.3 实验方法
1.3.1 动物分组将60只小鼠[体质量(18±1)g,雄性],按体质量分层随机分为正常对照组(C)、病毒感染组(V)、达菲组(D)3组,每组20只(其中10只小鼠用于观察死亡率、生存指数,评价流感模型造模是否成功)。适应性喂养48 h后开始造模实验。腹腔注射戊巴比妥钠麻醉,麻倒后,吸取20 μL 4LD50的病毒液滴鼻攻毒,注意让小鼠充分吸入病毒液。给药方法:于感染病毒1 d后灌胃给药,每只小鼠灌胃给药剂量为0.2 mL/10 g,每天同一时间灌胃1次,正常对照组和模型组每天以等体积的生理盐水灌胃,连续灌胃6 d,观察14 d。
1.3.2 血清制备分别于感染病毒后第3、5天两个时间点,每组取小鼠3只,摘眼球方式取血,实验前禁食不禁水8 h。不加抗凝剂,静置2 h后,以转速3 000 r/min离心10 min,取上清液即为血清。分装之后保存于-80℃冰箱内,备用。
1.3.3 RT⁃PCR测定肺组织中流感病毒RNA复制数称取第3、5天各组肺组织(RNA Later浸泡)50 mg,置含有0.5 mL Trizol试剂的 EP管(2 mL,RNase⁃Free)中,将EP管置于匀浆机中研磨(60 Hz,60 s),Trizol法提取肺组织总RNA。按照Aglilent RNA 6000 Pico Quick Start Guide说明书,使用AGI⁃LENT 2100测定总肺组织总RNA完整性,然后使用甲型流感病毒/乙型流感病毒核酸检测试剂盒(PCR荧光探针法)检测肺匀浆中流感病毒RNA复制数。
1.3.4 纳米胶体银溶液的制备Lee法:称取36 mg硝酸银于烧瓶中,加200 mL水溶解,将溶液加热至沸腾并磁力搅拌。然后,迅速加入4 mL新鲜1%(W/V)柠檬酸钠溶液,保持溶液沸腾1 h,连续搅拌,至颜色变黄、灰,说明已形成纳米胶体银(AgNPs)溶液,冷却,备用。
1.3.5 待测样品处理取各组小鼠血清与纳米胶体银溶液按照不同比例混合,考察并优选合适的比例;按照优选出的比例将血清与纳米胶体银溶液混匀,静置30 min,取2 μL混合液点样于直径为0.4 cm的硅片上,每份血清平行点样3份,待室温下干燥后,置拉曼光谱仪上进行SERS图谱测定,每个血清样本测量3次,取平均值。
1.3.6 SERS光谱测试条件激发光波长为785 nm,光谱测量范围为500~1 800 cm-1,光谱分辨率为2.0 cm-1,激发功率位20 mW,积分时间为10 s。
1.4 统计学方法使用Bwspec4软件进行背景扣除和光谱平滑处理,并进行归一化处理,以减少光谱强度差异带来的影响;运用Simca⁃P+14.0对各组SERS数据进行正交校正的偏最小二乘辨别分析(OPLS⁃DA)。
2 结果
2.1 血清:Ag NPs不同混合比例考察结果对血清与纳米胶体银溶液混合比例进行了一系列考察,考察范围为血清:Ag NPs(4∶1)至血清:Ag NPs(1∶20),SERS图谱见图1。由图1可见,血清:Ag NPs(4∶1)至血清:Ag NPs(1∶4)对应的 SERS 特征峰逐渐尖锐,说明随着加入的Ag NPs增多,峰型越尖锐,激发强度增强,SERS特征峰越明显;但当加入的Ag NPs从4倍增大到20倍过程中,峰型基本上一致,没有明显变化。经谱峰对比,最终选择血清:Ag NPs(1∶4)作为血清与纳米胶体银溶液混合的最适比例。
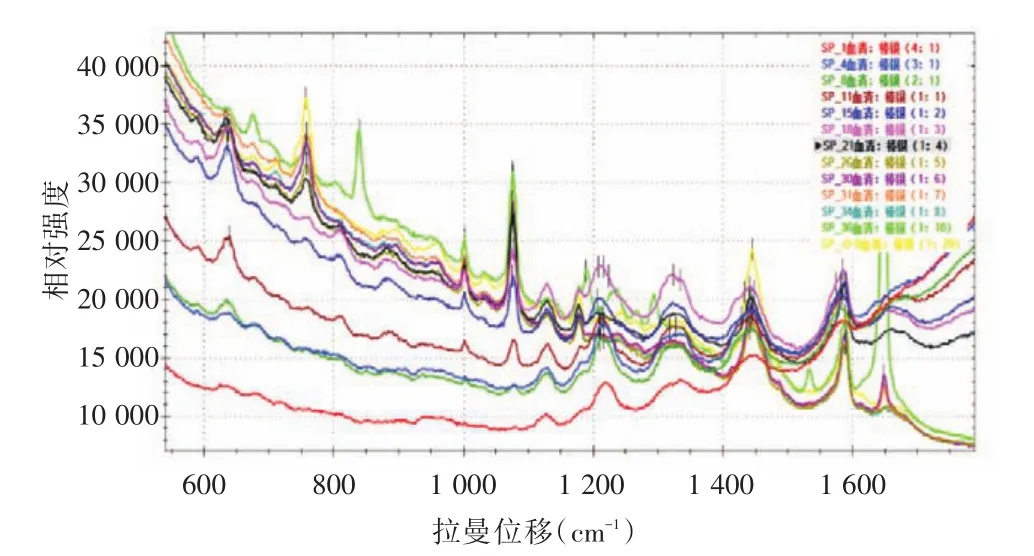
图1 血清:Ag NPs不同混合比例考察结果Fig.1 Results of Serum:Ag NPs mixed proportion
2.2 小鼠流感血清SERS特征图谱由各组小鼠血清SERS谱图2可知,1 650和1 330 cm-1分别是血清白蛋白的酰胺Ⅰ和酰胺Ⅲ贡献的拉曼特征峰[9]。1 006 cm-1为蛋白质的侧链苯丙氨酸的单基取代苯基环,该峰在蛋白质的拉曼光谱中属于强峰。1 204和1 590 cm-1也属于苯丙氨酸的残基特征峰[11]。在810 cm-1处有非常强的谱峰,属于天冬氨酸的拉曼光谱。634、1 130 cm-1谱带属于碳水化合物D-甘露糖的特征谱带[10]。血清中含量很低的糖类在银胶体粒子聚集形成的“热点”处,局域电场的强度得到提高,从而导致的SERS光谱也能被探测到。1 130、1 440 cm-1谱带属于脂类的特征拉曼峰[12]。在纳米胶体银作为SERS衬底下,血清中含量高的白蛋白及量非常低的成分如糖类和脂类都可以获得的拉曼光谱[13],见表1。参考文献报道血清SERS图谱特征峰归属对15个峰进行了初步的震动模式指认。并选取1 076 cm-1作为分析谱线的标准,比较各组血清SERS图谱特征峰强度差异,见表2。
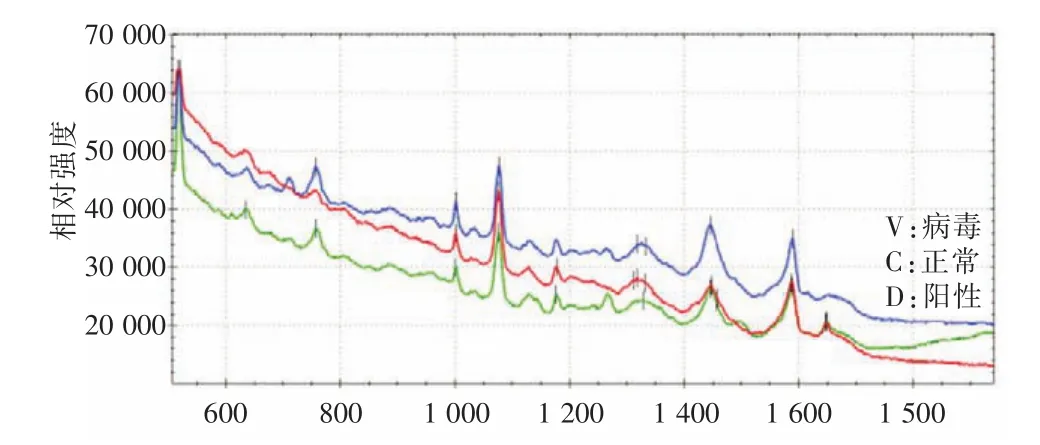
图2 各组小鼠血清SERS图谱比较Fig.2 Comparison of serum SERS spectrum of mice in each group
流感病毒感染第3天时,流感病毒感染组小鼠血清在1 440、758、710 cm-1处SERS特征峰强于正常组,这些拉曼峰主要归属于磷脂、D⁃甘露糖及辅酶、乙酰辅酶类成分;而流感病毒感染第5天时,流感病毒感染组小鼠血清在1 650、1 590、1 440、1 204、1 180、1 130、950、634 cm-1处SERS特征峰强于正常组,这些拉曼峰主要归属于酰胺I、色氨酸、酪氨酸、苯丙氨酸、磷脂、乙酰基葡萄糖、β⁃胡萝卜素、D⁃甘露糖、酪氨酸。可见,从感染流感病毒后第3~5天,流感病毒感染组小鼠血清SERS各特征峰信号明显增强。

表1 小鼠流感血清SERS图谱特征峰的归属及其振动模式Tab.1 Characteristic attribution and vibrational modes of the SERS spectrum peaks of mice serum

表2 各组SERS图谱特征峰差异Tab.2 Difference of characteristic peaks of SERS spectra in each group(n=9)
2.3 统计分析结果
2.3.1 OPLS⁃DA分析结果运用OPLS⁃DA对第3、5天正常组、病毒组、达菲组3种血清SERS光谱分别进行组间差异分析。由图3可见,在流感病毒感染第3天时,正常组与流感病毒感染组血清样本之间具有明显的组内聚集和组间分离的趋势,该模型的预测能力评估参数分别为R2X(cum)=0.662,R2Y(cum)=0.359,Q2(cum)=0.225,表明该模型的耐用性较高,而预测能力一般。由图4可见,在流感病毒感染第5天时,正常组与流感病毒感染组血清样本之间具有显著的组内聚集和组间分离的趋势,该模型的预测能力评估参数分别为R2X(cum)=0.849,R2Y(cum)=0.707,Q2(cum)=0.555,表明该模型的耐用性较高,模型预测能力良好。由得分图可直观3种血清的得分值虽有少量的交叉重叠,但3种血清表现出较为明显的分离趋势。

图3 流感病毒感染第3天各组血清样本得分图Fig.3 Serum samples score of third day after influenza virus infection
2.3.2 ROC曲线评估结果ROC曲线可反映模型预测能力的敏感性和特异性连续变量的综合指标。ROC曲线下面积(AUC)越大,模型预测能力越高。采用ROC曲线对OPLS⁃DA建立的3种血清SERS图谱模型进行评估,见图5、6。在流感病毒感染第3天时,正常组、流感病毒感染组、达菲组3组的AUC分别为0.883、0.889、0.821;在流感病毒感染第5天时,正常组、流感病毒感染组、达菲组3组的AUC分别为1.00、0.969、0.994。结果表明,OPLS⁃DA分析能够对3组血清进行良好的区分、鉴别。

图4 流感病毒感染第5天各组血清样本得分图Fig.4 Serum samples score of fifth day after influenza virus infection
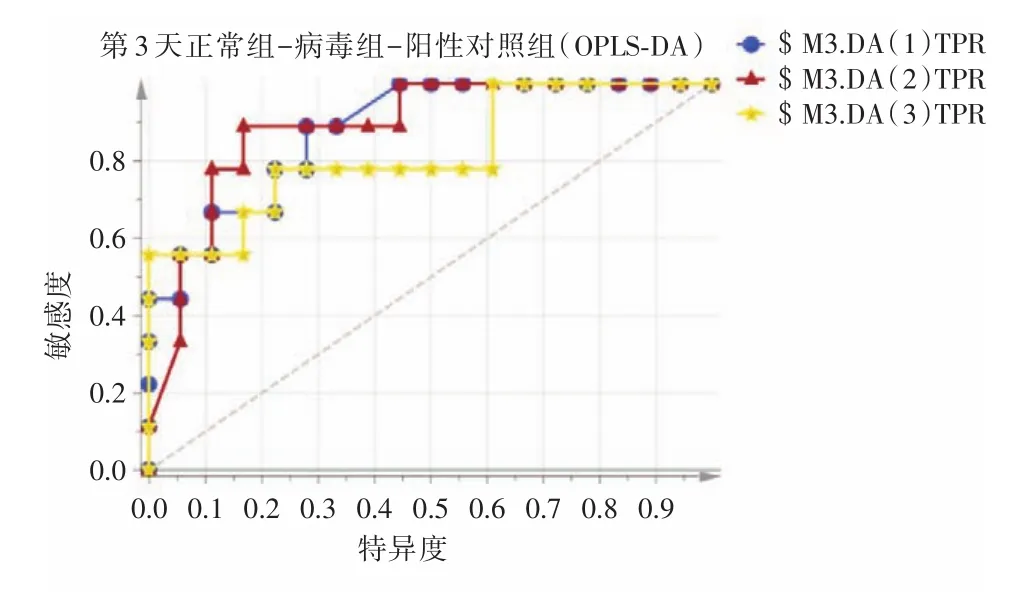
注:1,正常组;2,病毒组;3,达菲组。AUC(1)=0.882 716,AUC(2)=0.888 889,AUC(3)=0.820 988
2.4 各组肺组织中流感病毒RNA复制数的比较被感染器官内病毒RNA的量决定了病毒复制的含量和病变的程度。RT⁃PCR结果显示,正常组小鼠肺组织内无病毒RNA表达,被流感病毒感染后,病毒组及达菲组小鼠第3天和第5天肺组织病毒RNA复制数均显著增高。小鼠感染流感病毒后,给药第3、5天,病毒组及达菲组肺组织中病毒RNA复制数差异均有显著性(P<0.01),见图7。
3 讨论
本文采用流感病毒滴鼻感染法造模,每组设置10只小鼠用于观察死亡率、存活率,来评价流感模型造模是否成功。结果显示,与正常组相比,病毒模型组动物病死率为100%,平均存活时间为6.4 d,达菲组动物病死率为10%,平均存活时间为13.3 d。结合感染小鼠均出现不同程度的流感样发病症状,如弓背、耸毛、精神不振、毛发无光泽,喘息、发抖、饮食下降、闭眼,第5天开始出现聚堆,行走摇摆不定,极少活动等现象,说明流感模型造模成功。
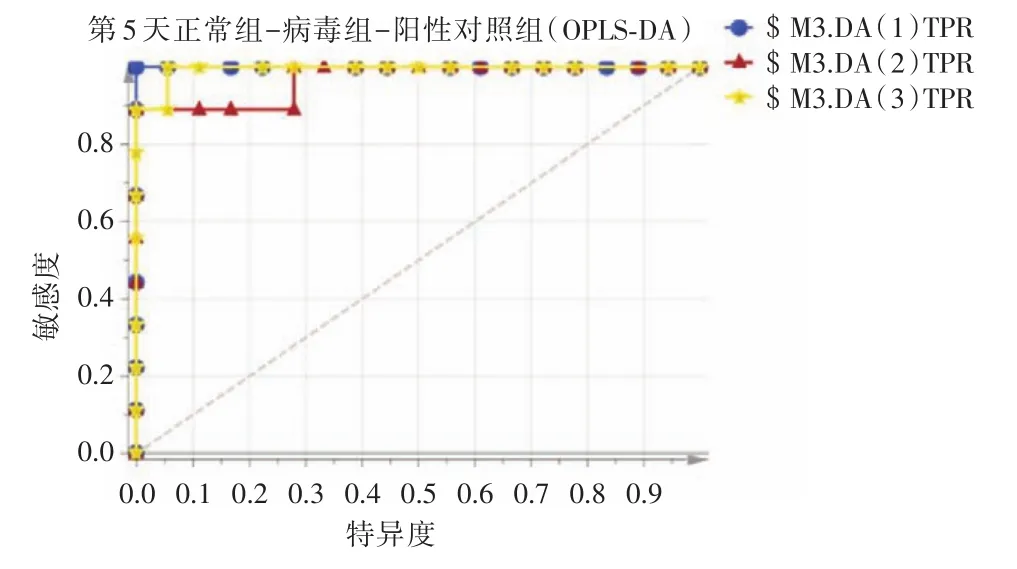
图6 感染第5天各组血清SERS图谱的ROC曲线图Fig.6 ROC curve of serum SERS spectrum in each group after fifth day infection

图7 各组肺组织中流感病毒RNA复制数的比较Fig.7 Comparison of the number of RNA replicas of influenza virus in lung tissues of each group
通过对测得的各组SERS谱峰进行归属指认发现,这些特征峰主要来自蛋白质、脂类、碱基、多肽、氨基酸、碳水化合物等成分中各种化学键(官能团)不同振动和转动模式,包括伸缩振动、弯曲振动等。从感染流感病毒后第3~5天,流感病毒感染组小鼠血清SERS各特征峰信号明显增强(表2),这些信号增强的特征峰主要为酰胺I、色氨酸、酪氨酸、苯丙氨酸、磷脂、乙酰基葡萄糖、β⁃胡萝卜素、D⁃甘露糖、酪氨酸等。血清中各种成分主要来源于细胞分泌的蛋白质或细胞因子或者代谢物(包括药物代谢物),血清中各种成分的改变是引起SERS谱峰差异的原因,而血清中各种成分的改变又可直接反映体内组织细胞生理和病理的变化。可见,这些发生变化的SERS特征峰所对应的成分与流感病毒对机体的影响有着密切的联系。
OPLS⁃DA可以更好地区分组间差异,提高模型的有效性和解析能力。由OPLS⁃DA对第3、5天正常组、病毒组、达菲组3种血清SERS光谱分别进行组间差异分析结果可知,在第3、5天两个时间点,这3种血清均表现出较为明显的分离趋势(图3、4)。由ROC曲线对OPLS⁃DA建立的3种血清SERS图谱模型评估结果可见,OPLS⁃DA分析能够对3组血清进行良好的区分、鉴别。通过以上实验结果可见,SERS检测鉴别结果与RT⁃PCR检测鉴别结果一致。因此,利用所建立的SERS技术,结合OPLS⁃DA多元分析方法,将有望用于快速鉴别和诊断机体是否感染了流感病毒。
[1]廖嘉仪,张涛.血清淀粉样蛋白A联合C反应蛋白对儿童甲型流感早期诊断价值的评价[J].实用医学杂志,2017,33(14):2368⁃2370.
[2]邵锋,陈坤,罗志辉,等.SERS技术在疾病诊断和生物分析中的应用[J].化学进展,2012,24(12):2391⁃2402.
[3]SCHLÜCKER S.Surface⁃enhanced Raman spectroscopy:con⁃cepts and chemical applications[J].Angew Chem lnt Ed Engl,2014,53(19):4756⁃4795.
[4]俞允,何雁,陈伟炜,等.拉曼光谱在中药检测中的研究进展[J].江西中医学院学报,2013,25(2):85⁃88.
[5]XIAO R,ZHANG X,RONG Z,et al.Non⁃invasive detection of hep atocellular carcinoma serum metabolic profile through surface ⁃en ⁃hanced Raman spectroscopy[J].Nanomedicine,2016,12(8):2475⁃2484.
[6]LI X,YANG T,LI S,et al.Noninvasive liver diseases detec⁃tion based on serum surface enhanced Raman spectroscopy and statistical analysis[J].Opt Express,2015,23(14):18361⁃18372.
[7]LIM J Y,NAM J S,YANG S E,et al.Identification of Newly Emerging Influenza Viruses by Surface⁃Enhanced Raman Spec⁃troscopy[J].Anal Chem,2015,87(23):11652⁃11659.
[8]CHOI J,MARTIN S J,TRIPP R A,et al.Detection of neur⁃aminidase stalk motifs associated with enhanced N1 subtype in⁃fluenza A virulence via Raman spectroscopy[J].Analyst,2015,140(22):7748⁃7760.
[9]ERIK R,FARQUHAR,JOSEPH P,et al.In vivo self⁃hydrox⁃ylation of an iron⁃substituted manganese⁃dependent extradiol cleaving catechol dioxygenase[J].JBIC,2011,16(4):589⁃597.
[10]NOTINGHER I.Raman Spectroscopy Cell⁃based Biosensors[J].Sensors(Basel),2007,7(8):1343⁃1358.
[11]KNEIPP J,KNEIPP H,WITTIG B,et al.Novel optical nano⁃sensors for probing and imaging live cells[J].Nanomedicine,2010,6(2):214⁃226.
[12]HODGESM D,KELLY J G,BENTLEY A J,et al.Combining immunolabel⁃ing and surface⁃enhanced Raman spectroscopy on cell membranes[J].ACS Nano,2011,5(12):9535⁃9541.
[13]王巍,潘志峰,唐伟跃,等.胃癌患者血红蛋白的表面增强拉曼光谱分析[J].光谱学与光谱分析,2015,35(12):3402⁃3405.
