化疗所致周围神经病变评估工具的汉化及信效度检测
2018-05-11王悦白燕妮郑玉杰王美霞杨艳赵卿付菊芳
王悦,白燕妮,郑玉杰,王美霞,杨艳,赵卿,付菊芳
(1.第四军医大学西京医院 疾病预防控制科,陕西 西安 710032; 2.第四军医大学西京医院 血液内科;3.陕西省肿瘤医院 普外科,陕西 西安 710061; 4.第四军医大学西京医院 消化病院; 5.第四军医大学唐都医院 肿瘤科,陕西 西安 710038)
化疗所致周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)是指使用铂类、紫杉醇类、植物生物碱类等神经毒性化疗药物导致的感觉、运动、自主神经的传导损伤。国外一项研究[1]对31篇文献进行Meta分析后得出:奥沙利铂导致的CIPN发生率为72.3%,紫杉醇导致的CIPN发生率为70.8%,顺铂或卡铂与紫杉醇合用导致的CIPN的发生率为73%。CIPN 为剂量限制型不良反应,会降低患者的生活质量[2],增加跌倒风险。若出现严重的CIPN,可能导致化疗剂量的减少、治疗的中断以及治疗方案的改变,最终影响整体的存活率,所以对于CIPN症状的早期识别显得尤为重要。目前医护人员、患者都对CIPN认识不足,CIPN症状对生活质量影响的研究缺乏特异性工具[2],所以亟需构建一个适合中国癌症患者、具有较高信效度、评价CIPN症状对于生活质量影响的特异性工具。CIPNAT(chemotherapy-induced peripheral neuropathy assessment tool,CIPNAT)是由美国南佛罗里达大学Tofthagen教授[3]于2008年构建的患者自我报告型问卷,能够全面评估CIPN,信效度较好,已有韩文版、西班牙语版,应用较广泛。本研究旨在引进CIPNAT,对其进行汉化,通过调查验证该量表的信效度,为国内开展相关领域的研究提供依据和研究工具。现报告如下。
1 对象与方法
1.1 研究对象
1.1.1 样本量的计算 采用便利抽样法,选择2015年10月1日至2016年6月30日西安市4所三甲医院(西京医院、唐都医院、陕西省人民医院、陕西省肿瘤医院)接受化疗药物治疗的癌症患者。按照样本量为条目数5~10倍的原则,本量表共23个条目、50个子条目,至少需要230例,扩大至260例。为了达到较好的区分效度,按照1∶4的原则进行配比[3]。其中,使用神经毒性药物化疗者210例,使用非神经毒性药物化疗的患者50例。
1.1.2 纳入和排除标准 纳入标准:使用包括铂类、紫杉烷类、植物生物碱类等神经毒性药物化疗;对照组使用非神经毒性药物化疗;年龄≥18周岁,能阅读文字或可以正确回答问题,自愿参加本研究。排除标准:具有精神疾患、认知障碍;不愿参加调查。
1.1.3 研究对象一般资料 共发放问卷260份,回收有效问卷247份,有效回收率为95.0%。其中:西京医院117例(47.4%),唐都医院67例(27.1%),陕西省人民医院4例(1.6%),陕西省肿瘤医院59例(23.9%)。使用非神经毒性药物化疗者和神经毒性药物化疗组分别为50例和197例。在使用神经毒性药物化疗的197例患者中,男124例(62.9%),女73例(37.1%);平均年龄(54.69±11.63)岁;小学及以下文化程度者40例(20.3%),初高中及中专98例(49.7%),大专及以上59例(30.0%);未婚8例(4.1%),已婚180例(91.4%),其他9例(4.5%);家庭月人均收入<500元者67例(34.0%),501~1000元31例(15.7%),1001~2000元34例(17.3%),2001~3000元26例(13.2%),>3000元39例(19.8%);在职21例(10.6%),离职41(20.8%),无工作100例(50.8%),退休35(17.8%);胃癌60(30.5%),肠癌70例(35.5%),乳腺癌23例(11.7%),肺癌10例(5.1%),妇科肿瘤12例(6.1%),血液肿瘤13例(6.6%),食管癌6例(3.0%),其他实体肿瘤3例(1.5%)。
1.2 方法
1.2.1 研究工具
1.2.1.1 一般资料调查表 为自行设计,共包括两方面内容:(1)人口学资料,包括年龄、性别、宗教、婚姻状况、文化程度、职业、家庭情况、收入水平等;(2)疾病相关资料,包括诊断、分期、化疗放疗情况、给药方式及周围神经毒性症状持续时间。
1.2.1.2 CIPNAT量表 CIPNAT是由美国南佛罗里达大学Tofthagen教授[3]于2008年构建,属于患者自我报告型问卷,主要分为两部分:第一部分为CIPN的症状体验,包括9项症状、感觉和运动神经受损2个维度,共36个子条目,评估症状是否发生、严重程度、困扰程度和发生频率;第二部分是CIPN对日常生活活动(activities of daily living,ADL)的影响,共14个条目,评估精细动作和一般活动两方面。均采用0~10分评分,总分越高,说明患者的CIPN症状越严重、困扰越大、持续时间越长、对ADL影响越大。
1.2.1.3 美国国立癌症研究所常见不良反应事件评价标准3.0版(National Cancer Institute-common toxicity criteria,NCI-cfc) 该毒性分级标准始于20世纪80年代,被广泛用于评估化疗药物导致的神经毒性反应,由医生对患者的神经毒性进行评估和分级,包括感觉和运动两个条目,分为0~5级,共6个级别[4-5]。
1.2.2 研究过程
1.2.2.1 翻译、回译和文化调适 本研究在征得原量表作者的同意并授权汉化后,严格遵循Brislin双人翻译-回译原则来转化量表[6]。由2名英语较好的我国研究人员将量表翻译成中文,其中1名是有多年肿瘤护理工作经验的护理研究人员,另1名是有美国学习经历的护理研究人员,两人翻译的版本分别记为T1、T2;研究者本人将两名研究人员的翻译合并并记录,形成T12版本;将此版本经过1名多年从事肿瘤护理研究工作的护理专家审核后,由2名不了解源量表的以英语为母语的研究者将该T12版本回译成英文,分别形成回译版本BT1和BT2。成立专家委员会,共包括5名专家,分别为3名从事肿瘤工作的医生、2名从事肿瘤工作的护理专家,学历均在硕士以上。将英文原版量表、T1、T2、T12、BT1、BT2这6个版本的量表提交给专家调适量表的内容,评价其内容效度。采用1~4分分别代表不相关、有些相关、相关、非常相关。专家建议对条目5(手指/手或者脚趾/脚不舒适?)中的“不舒适”进行解释说明,研究者本人通过前期访谈、查阅文献和原量表相关资料后,将不舒适解释为灼烧痛、电击样疼痛、蚁走感、不明原因的痒感。
1.2.2.2 预调查 选取20名接受神经毒性药物化疗的癌症患者填写问卷,填写过程中采用访谈法了解患者对条目的反应及建议,根据患者的反馈,将将原量表的形式改成表格式,形成了中文版CIPNAT量表。
1.3 统计学处理 本研究采用EpiData 3.1软件建立数据,SPSS 20.0和Amos 21.0统计分析,患者的一般资料采用频数、百分比表示;量表主要通过条目分析和信效度检验来评价;量表的信度主要通过重测信度、Cronbach’s α系数来评价;量表的效度主要通过内容效度指数(content validity index,CVI)、Pearson相关分析、探索性因子分析和验证性因子分析来评价。以P<0.05 或P<0.01表示差异有统计学意义。
2 结果
2.1 中文版CIPNAT量表的条目分析
2.1.1 高低分组独立样本t检验 为了判别量表项目是否具有区别受试者能力高低的功能,将量表总分相加,依其得分高低排序,选前27%为高分组,后27%为低分组,对两个极端组进行独立样本t检验,根据检验结果将未达显著性的项目考虑删除(t<3,P>0.01)[7]。本次结果显示未有条目删除。
2.1.2 各条目与量表总分间的相关分析 条目与总分相关采用Pearson相关,结果显示所有条目与总分相关系数在0.32~0.70之间,且均具有统计学意义(P<0.01),表示题项与整体量表的同质性较高[7]。
2.1.3 中文版CIPNAT量表的地板和天花板效应 一般认为,某次评定中取得该量表可能的最低分(最高分)的病例数占总病例数的百分比大于20%,则提示存在明显的地板(天花板)效应。本次研究中除了CIPN对ADL的影响分量表可能存在地板效应外,其余均无明显的天花板效应和地板效应。详见表1。

表1 中文版CIPNAT量表得分分布情况[n(%)]
2.2 中文版CIPNAT量表的信度分析 (1)重测信度:为了检验量表的稳定性,于调查后48~72 h随机选取参与过本研究的20例患者进行重测,然后将两次测量的得分情况进行相关分析,得出各分量表及总量表的重测信度为0.89~0.93(P<0.01)。(2)内部一致性信度:CIPNAT总量表的Cronbach’s α 系数为0.94,两个分量表的Cronbach’s α系数分别为0.92和0.89。
2.3 中文版CIPNAT量表的效度分析
2.3.1 内容效度 采用条目水平的内容效度指数对各个条目的内容进行评价,经过5名专家评定,各条目的CVI 值为0.89~1,全部条目的平均CVI值为0.92.
2.3.2 分量表间及与量表总分的相关系数 分量表间的相关系数为0.632,分量表与量表总分之间的相关系数为0.814~ 0.964,且均具有统计学意义(P<0.01)。
2.3.3 结构效度
2.3.3.1 探索性因子分析 分量表1(CIPN症状体验)的Bartlett球形检验值为527.62(P<0.001),KMO值为0.732,适合做因子分析。对9项症状采用主成分分析法,共提取出2个因子,各因子负荷量均>0.4,累计贡献率为53.61%。分量表2(CIPN对ADL的影响)的Bartlett球形检验值为1529.83(P<0.001),KMO值为0.862,适合做因子分析。对14个条目采用主成分分析法,选取特征值>1的公因子,共抽出2个因子,各条目因子负荷量均>0.4,累计贡献率为57.46%,提示量表具有较好的结构效度。见表2和表3。

表2 CIPNAT第一部分CIPN的症状体验因子分析结果(n=197)
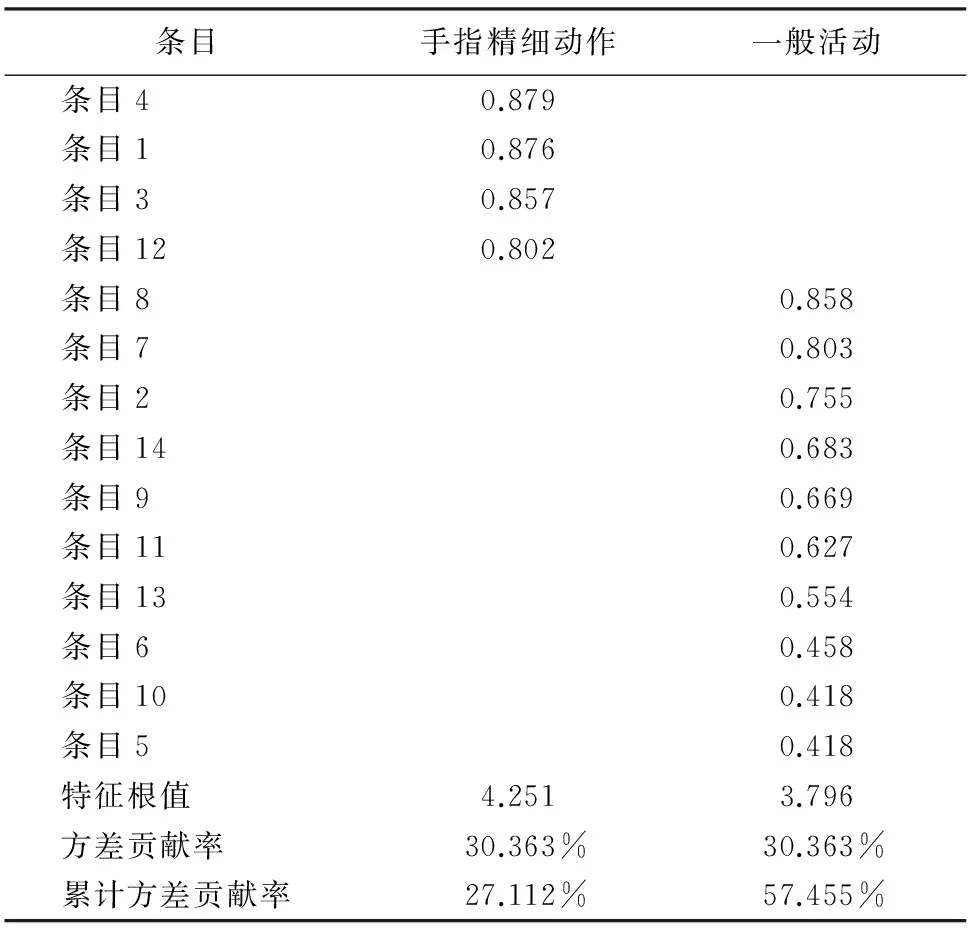
表3 CIPNAT第二部分CIPN对ADL影响的因子分析结果(n=197)
2.3.3.2 验证性因子分析 按照探索性因子分析所获得的因子划分建立模型,运用极大似然法对量表进行验证性因子分析,其各项拟合指标值详见表4。
2.3.4 中文版CIPNAT量表的区分效度 本研究通过对比使用神经毒性化疗药物患者与未使用神经毒性化疗药物患者的CIPNAT得分来评价该量表的区分效度。采用Mann-WhitneyU检验,发现两组间得分差异具有统计学意义(P<0.01),说明量表区分效度较好。见表5。
2.3.5 中文版CIPNAT量表的校标关联效度 将CIPNAT的调查结果与医生评估的NCI-CTC毒性评分进行Pearson相关分析,两者总相关系数为0.873,感觉维度、运动维度和总的相关系数r分别为0.783、0.807和0.873(P均<0.01)。
3 讨论
3.1 形成中文版CIPNAT量表的必要性 由于缺乏可靠的诊断标准及预防、治疗方法,CIPN已成为一种低评估、低报告的医疗问题。CIPN以患者主观体验为主,研究显示患者自我报告型的评估方法要优于以医生为主导的评估方法[8]。目前国外已有一些患者自我报告型CIPN评估问卷,但是应用时仍不能多维度全面评估CIPN的特点。本研究汉化的CIPNAT量表,与原量表的结构基本一致,从症状是否发生、严重程度、困扰程度、发生频率等4个方面全面评估,同时能详细了解CIPN对患者ADL的影响,可为后期预防或减轻CIPN干预研究的效果评价提供全面的评估工具。
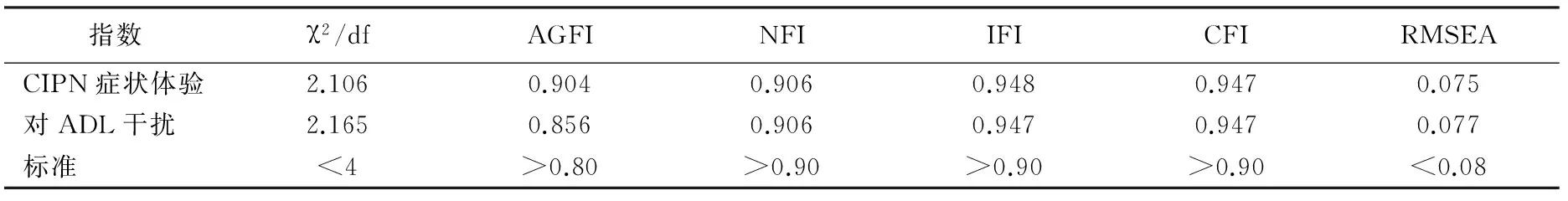
表4 验证性因子分析拟合指标(n=197)
AGFI:调整拟合优度指数,NFI:正规拟合指数,IFI:递增拟合指数,CFI:比较拟合优度指数,RMSEA:近似误差均方根

表5 两组患者CIPNAT得分的比较(n=247)
3.2 中文版CIPNAT量表的条目分析 条目分析主要目的在于检验量表或测试个别题项的可靠程度,本研究使用了高低分组比较区分度、条目与总量表相关、地板和天花板效应来测试条目的可靠程度。在CIPN对ADL的影响部分,CIPN对ADL的影响可能存在地板效应,29.4%患者出现了此部分可能的最低分,可能是使用神经毒性药物化疗的患者中有18例患者没有出现CIPN,所以量表得分为0;另一方面,有些患者CIPN的症状较轻,不影响ADL,所以对ADL的影响得分为0。
3.3 中文版CIPNAT量表的信度 对于某些比较稳定的特征,重测时间间隔一般建议在14 d左右[9]。在本研究中,考虑到患者间隔时间太长,CIPN症状会因药物在体内代谢而有所减退,造成结果不可信,因此重测时间间隔设定为48~72 h。通常认为,一份信度较好的量表应满足[7,10]其总量表Cronbach’s α系数>0.8,分量表Cronbach’s α系数>0.6,重测信度>0.7。本研究结果显示,中文版CIPNAT量表中,总问卷的Cronbach’s α系数为0.94,分量表的Cronbach’s α系数分别为0.92和0.89。与原量表[3](0.95)及西班牙学者[11]的研究结果(0.87)相近,说明整个量表的各条目具有较好的内在一致性和稳定性。
3.4 中文版CIPNAT量表的效度
3.4.1 内容效度 内容效度方面,前期通过质性访谈[12],了解了CIPN患者可能出现的症状,除了视力模糊、味觉改变、记忆力下降等这些发生较少且不易于与其他疾病区别的神经受损症状外,其余症状均在CIPNAT量表中涉及,专家评价CIPNAT量表的各条目平均内容效度为0.92,表明CIPNAT量表可以测量患者CIPN的症状体验及对ADL的影响。
3.4.2 结构效度 结构效度是指问卷所要测量的概念能显示科学的意义并符合理论上的设想[13]。公因子能解释40%以上的变异,每个条目在相应的因子载荷量>0.4[14],说明该因子分析比较理想,具有较好的结构效度。本研究采用因子分析检验量表的结构效度,CIPN的症状体验部分提取出2个公因子,共解释53.61%的变异;CIPN对ADL的影响部分提取出2个公因子,共解释57.46%的变异,各条目在相应因子上负荷值0.418~0.879。中文版CIPNAT量表维度的划分均与原量表相同,实现了理论结构的对等;同时,各分量表得分与总量表得分间相关系数为0.814~0.964,说明中文版CIPNAT量表结构效度较好。
3.4.3 区分效度 使用神经毒性药物和未使用神经毒性药物化疗的患者CIPNAT得分差异有统计学意义,说明中文版CIPNAT量表区分效度较好。虽然目前CIPN的诊断没有金标准,但临床医生应用NCI-CTC评分较多,故以它作为“准金标准”,相关系数为0.783~0.873,表明该量表的效标和效度理想。
4 小结
中文版CIPNAT适合中国癌症患者,具有良好的信效度,符合计量学标准。该量表的引进可为医护人员早期识别、全面评估CIPN提供科学的测量工具,为护士开展化疗相关健康教育及干预措施提供有力的依据和针对性。
【参考文献】
[1] Seretny M,Currie G L,Sena E S,et al.Incidence,prevalence,and predictors of chemotherapy-induced peripheral neuropathy:A systematic review and meta-analysis[J].PAIN,2014,155(12):2461-2470.
[2] Mols F,Beijers T,Vreugdenhil G,et al.Chemotherapy-induced peripheral neuropathy and its association with quality of life:A systematic review[J].Support Care Cancer,2014,22(8):2261-2269.
[3] Tofthagen C S,McMillan S C,Kip K E.Development and psychometric evaluation of the chemotherapy-induced peripheral neuropathy assessment tool[J].Cancer Nurs,2011,34(4):10-20.
[4] Trotti A,Colevas A D,Setser A,et al.CTCAE v3.0:Development of a comprehensive grading system for the adverse effects of cancer treatment.[J].Semin Radiat Oncol,2003,13(3):176-181.
[5] Velasco R,Bruna J.Chemotherapy-induced peripheral neuropathy:An unresolved issue[J].Neurología (Barcelona,Spain),2010,25(2):116-131.
[6] Beaton D E,Bombardier C,Guillemin F,et al.Guidelines for the process of cross-cultural adaptation of self-report measures[J].Spine,2000,25(24):3186-3191.
[7] 吴明隆.SPSS统计应用实务 [M].北京:科学出版社,2003:12-19.
[8] 于世英,张莉红.神经毒性自评量表的信度及效度评估[J].中华物理医学与康复杂志,2014,36(5):388-390.
[9] 安胜利,陈平雁.量表的信度及其影响因素[J].中国临床心理学杂志,2001,19(4):23-27.
[10]Cook D,Beckman T.Current concepts in validity and reliability for psychometric instruments:Theory and application[J].Am J Med,2006,119(2):166-167.
[11]Alexandra P Z.The cross-cultural adaptation and validation of the instrument chemotherapy-induced peripheral neuropathy assessment tool (cipnat) for brazil[D].Säo Paulo:University of Säo Paulo,2015.
[12]王悦,付菊芳,白燕妮,等.癌症患者对化疗导致周围神经病变症状体验及应对方式的质性研究[J].护理学报,2016,23(22):9-13.
[13]胡雁.护理研究[M].3版.北京:人民卫生出版社,2008:118-120.
[14]陈雪蕾,林平,赵振娟.中文版护士工作环境感知量表的开发[J].中国护理管理杂志,2011,11(4):28-31.
