基于环介导等温扩增技术检测江苏省中部地区小麦赤霉病病菌的种群组成
2018-05-11王淑琛马家新叶文武郑小波
许 苗,冯 慧,王淑琛,马家新,叶文武,郑小波
(南京农业大学植物保护学院/农业部作物病虫害监测与防控重点开放实验室,江苏南京 210095)
小麦赤霉病是由镰孢菌(Fusarium)的多个种引起的一种毁灭性病害。该病在我国主要发生于温暖湿润和半湿润地区[1],在长江中下游地区发生尤为严重,一般年份因该病害造成的小麦产量损失高达13%左右,严重时损失过半[2]。江苏省是长江中下游重要冬麦区,其温暖湿润的气候条件有利于病原菌在小麦扬花期侵入,导致小麦穗部发病,进而引起小麦赤霉病的流行。
不同国家或地区,引起小麦赤霉病的镰孢菌种类有所不同。据报道,有17个种的镰孢菌可引起小麦赤霉病,其中最主要的有5个种[3]。在中国有15个种的镰孢菌是小麦赤霉病的致病菌,但是在一个省区一般只有一到数个种[4-7],主要是亚细亚镰孢(F.asiaticum)和禾谷镰孢(F.graminearum)[8-10]。小麦赤霉病病菌的种群组成与地理分布有关,不同地区的主要致病菌种类因地理生态环境差异而有所不同[11]。Zhang等[12]研究发现,在引起中国小麦赤霉病的两种主要致病菌中,亚细亚镰孢主要分布在年平均气温高于15 ℃的温暖地区,禾谷镰孢则大多分布在年平均气温低于15 ℃的寒冷地区。徐 飞等[13]发现,禾谷镰孢和亚细亚镰孢是河南省小麦赤霉病的优势种群;假禾谷镰孢(F.pseudograminearum)、黄色镰孢(F.culmorum)、木贼镰孢(F.equiseti)和拟轮枝镰孢(F.verticillioides)为次要种群。潘晓静等[14]报道,引起东北地区小麦赤霉病的镰孢有7个种,即禾谷镰孢、藤仓镰孢(F.fujikuroi)、燕麦镰孢(F.avenaceum)、尖孢镰孢(F.oxysporum)、木贼镰孢(F.equiseti)、锐顶镰孢(F.acuminatum)和拟轮枝镰孢(F.verticillioides)。Qiu等[15]和Dong等[16]报道,亚细亚镰孢是江苏省小麦赤霉病的主要致病菌,其次是禾谷镰孢,但对该省赤霉病病菌的其他种类知之甚少。
传统上对小麦赤霉病病菌的种群组成主要依据组织分离法进行病原菌鉴定,该方法对多病原病害的鉴定存在检出率低且耗时、费力的缺点。随着分子生物学技术的发展,分子检测技术已成功应用于小麦赤霉病病菌种群组成与结构的分析[17-18],使小麦赤霉病病菌种类检测、鉴定较传统方法更为快速准确,但这些检测、鉴定方法依旧存在检测周期长或特异性偏低等缺点。引起小麦赤霉病的镰孢菌种类多,不同种类病原菌形态特征相似,所致病害症状相近,但不同种类镰孢菌在发病麦穗组织中产生的毒素类型有差异[16,19-20],基于环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)建立的特异性检测技术[21],具有操作简单、特异性强、灵敏度高、检测时间短、结果可肉眼观察判断等优点。
本研究采用本课题组研发的可以分别特异性检测7种小麦赤霉病主要病原菌的LAMP检测技术,对江苏省中部地区小麦赤霉病样本进行检测,旨在了解该地区小麦赤霉病致病镰孢菌种类及其地理分布,并为小麦赤霉病病菌种群与结构分析提供新的技术。
1 材料与方法
1.1 小麦赤霉病样本的采集
2017年5月上旬至下旬从江苏省镇江的句容市、扬州的仪征市和广陵区、南京的江宁区和浦口区小麦田间采集带有粉红色霉层的小麦赤霉病样本151份(1个病穗作为1份样本)。病样采集后分别用自封袋装好,并编号,记录采集地信息。
1.2 检测的目标病原菌
检测的7种病原菌均为小麦赤霉病的常见致病菌,包括亚细亚镰孢、禾谷镰孢、藤仓镰孢、黄色镰孢、燕麦镰孢、拟轮枝镰孢和木贼镰孢。
1.3 病穗组织DNA提取
每份样本各取新鲜病穗上1~2个带有粉红色霉层的小穗,剪掉麦芒,于灭菌的研钵中加入液氮充分研磨,DNA提取采用中国北京天根公司的新型植物基因组DNA提取试剂盒DNAsecure Plant Kit,方法参见说明书。提取的DNA作为LAMP检测的模板,于-20 ℃保存。
1.4 小麦赤霉病病菌的LAMP检测
7种目标病原菌的LAMP特异性检测扩增条件、灵敏度及引物序列见表1和表2。所列7个LAMP检测技术的反应体系为:2.5 μL 10×Thermo Pol Buffer,4 μL MgSO4(50 mmol·L-1),4 μL betaine(5 mmol·L-1),3.5 μL dNTPs(10 mmol·L-1),内引物FIP、BIP(20 μmol·L-1)各2 μL,外引物F3、B3(10 μmol·L-1)各0.5 μL,环引物 LF、LB(10 μmol·L-1)各1 μL,2 μL 羟基萘酚蓝(hydroxynaphthol blue,HNB)(2.4 mmol·L-1),1 μL Bst DNA 聚合酶(8 U·μL-1),2 μL模板DNA,灭菌水补至26 μL。
以1.3节中提取的DNA为模板,按照上述LAMP反应体系分别进行7种病原菌的检测,以相应病原菌标准菌株的DNA为阳性对照(藤仓镰孢标准菌株为CBS183.29,其他6种镰孢菌标准菌株参见表1对应参考文献),以ddH2O为阴性对照。扩增反应前加入羟基奈酚蓝(HNB)为反应指示剂,反应结束后,通过肉眼观察指示剂羟基奈酚蓝颜色变化判定扩增结果,反应结束后产物呈天蓝色为阳性,呈紫色为阴性。
表17种小麦赤霉病病菌的LAMP检测技术体系
Table1LAMPassayusedfordetectingsevenFusariumspeciescausingwheatscab
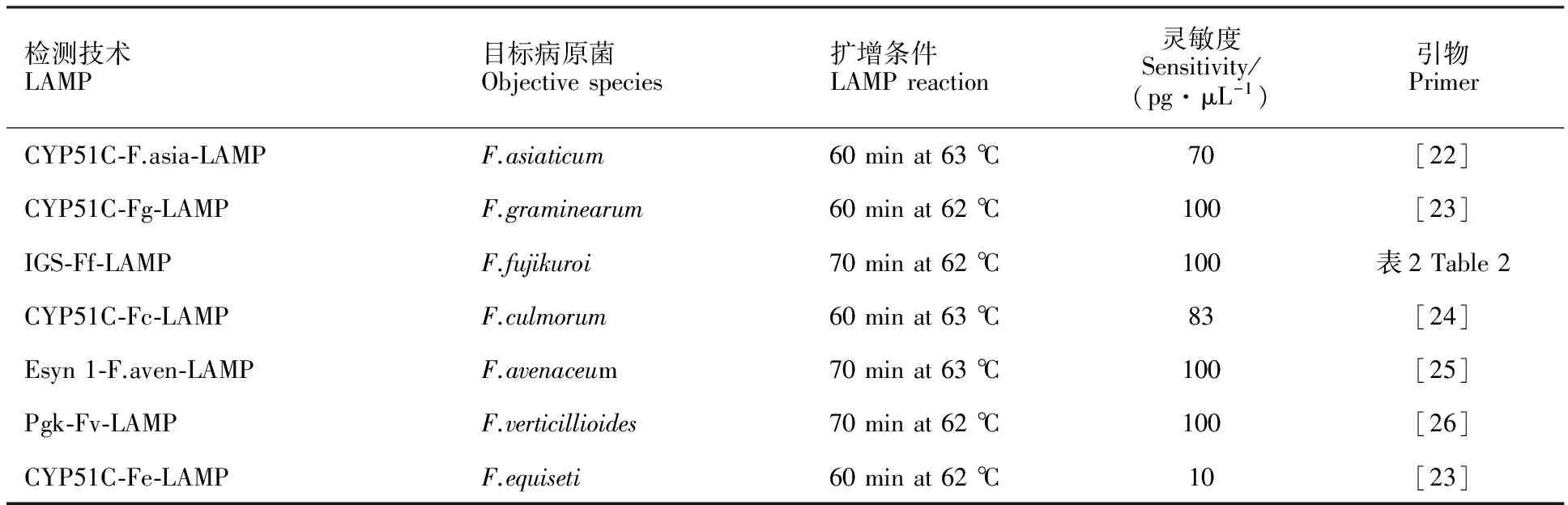
检测技术LAMP目标病原菌Objectivespecies扩增条件LAMPreaction灵敏度Sensitivity/(pg·μL-1)引物PrimerCYP51C⁃F.asia⁃LAMPF.asiaticum60minat63℃70[22]CYP51C⁃Fg⁃LAMPF.graminearum60minat62℃100[23]IGS⁃Ff⁃LAMPF.fujikuroi70minat62℃100表2Table2CYP51C⁃Fc⁃LAMPF.culmorum60minat63℃83[24]Esyn1⁃F.aven⁃LAMPF.avenaceum70minat63℃100[25]Pgk⁃Fv⁃LAMPF.verticillioides70minat62℃100[26]CYP51C⁃Fe⁃LAMPF.equiseti60minat62℃10[23]
表2用于检测藤仓镰孢的LAMP引物
Table2LAMPprimersusedforspecificdetectionofFusariumfujikuroi

目标病原菌Objectivespecies引物名称Primername序列Sequence(5′→3′)藤仓镰孢菌Ff⁃FIPTCAGCCTACCCTAGACCCTCGCCCTTACCTTTGCTTGAF.fujikuroiFf⁃BIPAGCTAGACTACTCTAAGGGTAGGTACAACTTCCACCAATTGCAFf⁃F3AGACACCGTTTTGTTTTGCFf⁃B3CTTTTCTCCAACTTCACAGCFf⁃LFATCCGGCCAAGACCGTC
1.5 小麦赤霉病病原菌的分离、验证
为进一步验证小麦赤霉病病原菌的LAMP检测结果,选择部分LAMP呈阳性样本,采用组织分离法进行病菌分离[27]。将发病小麦穗剪成约0.5 cm × 0.5 cm的组织块,在超净工作上经70%酒精(v/v)表面消毒1 min,移至2%(v/v)NaClO中浸泡2 min,用无菌水冲洗3次;用灭菌的滤纸片吸取残存在组织块表面的水分,并在超净工作台上吹干;将病组织置于PDA(potato dextrose agar)平板上,于黑暗条件下25 ℃培养3 d 后,挑取菌落边缘菌丝转入新的PDA培养基上纯化病原菌。通过病原菌形态观察,进行镰孢菌属的种类鉴定。参照许 娟[28]描述的CTAB(Hexadecyltrimethy Ammonium Bromide)法提取分离纯化的菌丝体DNA,通过TEF-1a基因序列比对分析鉴定小麦赤霉病病菌的种类。
2 结果与分析
2.1 LAMP检测结果
7个LAMP检测体系对某被测样本的检测结果(图1)显示,可特异性识别亚细亚镰孢(试管编号2号,下同)、禾谷镰孢(3号)和拟轮枝镰孢(8号)的LAMP检测结果呈阳性。判定该样本病组织中包含亚细亚镰孢、禾谷镰孢和拟轮枝镰孢3种病原菌。其他4种病原菌的LAMP检测结果(4、5、6和7号)呈阴性,表明该样本中不存在这4种小麦赤霉病病菌。151份小麦赤霉病样本检测结果(图2)表明,所有样本中共检测到6种小麦赤霉病病菌,亚细亚镰孢的检出率最高,达100%;其次为藤仓镰孢,检出该种病菌的样本有15份,检出率为10.0%;随后依次为禾谷镰孢、黄色镰孢、燕麦镰孢和拟轮枝镰孢,检出样本数分别为10、4、3和1,检出率依次为6.0%、2.6%、2.0%和0.6%。所有样本均未检测到木贼镰孢。

1:阳性对照;2~8:被测样品分别对亚细亚镰孢、禾谷镰孢、黄色镰孢、藤仓镰孢、燕麦镰孢、木贼镰孢、拟轮枝镰孢的检测结果;9:阴性对照
1:Positive control;2-8:Sample tested result forFusariumasiaticum,F.graminearum,F.culmorum,F.fujikuroi,F.avenaceum,F.equisetiandF.verticillioides,respectively;9:Negative control
图1小麦赤霉病菌的LAMP检测结果
Fig.1DetectionofFusariumspeciescausingwheatscabusingLAMPassays
不同地点的病原菌种类分布有所差异(表3)。151份样本中有122份样本仅检测到亚细亚镰孢,表明被测样本由亚细亚镰孢单独侵染引起。另有29份样本检测到2种或3种镰孢菌,占被测总样本数的19.2%,表明这些样品所在地区小麦赤霉病存在复合侵染状况,且均由亚细亚镰孢与藤仓镰孢、禾谷镰孢、黄色镰孢、燕麦镰孢或拟轮枝镰孢复合侵染引起。由此可见,江苏中部地区引起小麦赤霉病的优势种为亚细亚镰孢,藤仓镰孢、禾谷镰孢、黄色镰孢、燕麦镰孢和拟轮枝镰孢的也有零星分布。

F.asia:Fusariumasiaticum;Ff:F.fujikuroi;Fg:F.graminearum;Fc:F.culmorum;F.aven:F.avenaceum;Fv:F.verticillioides;Fe:F.equiseti. 下同. The same in table 3 and 4.
图2引起小麦赤霉病的7种镰孢菌的LAMP检测结果
Fig.2LAMPdetectionofFusariumspeciescausingwheatscab
表3江苏中部地区引起小麦赤霉病的镰孢菌种类及分布
Table3FusariumspeciescausingwheatscabandtheirdistributioninthemiddleareaofJiangsu

病菌种数No.ofspecies镰孢菌种类Fusariumspp.样本数No.ofsamples采集地点Samplingsite一种OnespeciesF.asia122句容、江宁、浦口、仪征、广陵Jurong,Jiangning,Pukou,Yizheng,Guangling两种TwospeciesF.asia+Ff13句容、江宁 Jurong,JiangningF.asia+Fg6句容、江宁、浦口 Jurong,Jiangning,PukouF.asia+Fc4江宁、仪征 Jiangning,YizhengF.asia+F.aven2广陵 Guangling三种ThreespeciesF.asia+Fg+Ff2句容、江宁 Jiangning,JurongF.asia+Fg+Fv1句容 JurongF.asia+Fg+F.aven1广陵 Guangling合计Total151
检测结果(表3)表明,亚细亚镰孢在江苏中部5个采集地区均有分布,而藤仓镰孢、禾谷镰孢、黄色镰孢、燕麦镰孢和拟轮枝镰孢5种小麦赤霉病病菌仅在局部地区被检测到。例如,禾谷镰孢在句容、江宁、浦口和广陵有分布,而黄色镰孢和燕麦镰孢仅在扬州的广陵区被检测到。
2.2 阳性样本的病原菌分离验证
为了验证LAMP检测结果的准确性和可靠性,选择34份LAMP阳性样本,包含仅单独检测到亚细亚镰孢以及同时检测到2或3种镰孢菌的样本,对其进行病原菌分离与鉴定。结果(表4)表明,从仅检测到亚细亚镰孢的10份阳性样本,以及检测到亚细亚镰孢与其他种类镰孢菌复合侵染的24份阳性样本中均分离出亚细亚镰孢,进一步证实亚细亚镰孢为江苏中部地区引起小麦赤霉病的优势种。在24份检测到2种或3种镰孢菌的阳性样本中,除燕麦镰孢外,其余4个种均被分离出来,该结果进一步证实藤仓镰孢、禾谷镰孢、黄色镰孢和拟轮枝镰孢是该地区小麦赤霉病发生的病原菌种类。除亚细亚镰孢外,LAMP检测结果与分离结果存在一定差异,例如,从9份同时检测到亚细亚镰孢和禾谷镰孢的阳性样本中,仅4份分离出禾谷镰孢(表4)(表4中将一份样本中分离到的同1种病原菌记载为该病原菌的1个菌株)。
本研究未能从3份检测到燕麦镰孢的阳性样本中分离出该病原菌,可能与该病菌生长速度较其他镰孢菌慢,其菌落被其他病原菌覆盖故未能获得纯培养所致。阳性样本的病原菌分离验证结果表明,本研究采用的LAMP检测技术具有准确性和可靠性,可作为小麦赤霉病菌种群组成研究的新技术。
表4LAMP检测阳性样本的分离与鉴定
Table4IsolationandidentificationofFusariumspp.frompositivesamplesdetectedbyLAMPassay

ALMP检测结果ResultdetectedbyLAMP样本数No.ofsample分离到镰孢菌种类Fusariumspp.isolated镰孢菌Fusariumspp.数量NumberF.asia10F.asia10F.asia+Ff9F.asia9Ff1F.asia+Fg5F.asia5Fg2F.asia+Fc4F.asia4Fc1F.asia+F.aven2F.asia2F.aven0F.asia+Fg+Ff2F.asia2Fg1Ff0F.asia+Fg+Fv1F.asia1Fv1Fg0F.asia+Fg+F.aven1F.asia1Fg1F.aven0
3 讨 论
小麦赤霉病病菌种类的检测与鉴定是研究小麦赤霉病发生发展及其预防和抗病育种的基础。由镰孢菌引起的小麦赤霉病的检测诊断主要依据病害症状和病原菌的形态学特征。近年来已报道的基于PCR的分子生物学鉴定技术也逐步应用于小麦赤霉病菌的检测[17,18,28-30]。已有的检测方法大多需要先分离获得病原菌的纯培养,然后提取病原菌DNA进行基因序列比对,整个检测鉴定过程费时、费工,操作比较繁琐,且效率低。张 林等[31]采用 Chelex-100法从病害标样材料上直接提取DNA与特异性分子标记检测相结合的方法快速检测小麦赤霉病病菌,较之以往的PCR技术更为简便、快速,但该方法对于发病症状不明显病组织的检测效果欠佳。本研究采用的LAMP技术特异性强,所设计的4条引物可识别6个靶标区段,其特异性较普通PCR有较大提升,灵敏度高,本研究应用的7个LAMP检测体系的灵敏度均能达到pg(picogram,1 g=109 pg)级水平;对DNA模板质量要求低,可从病组织中提取的包含有寄主植物、病原菌和其他腐生微生物的DNA中直接检出目标病原菌;检测所需时间短,完成一次检测(从病组织DNA提取至获得LAMP检测结果)仅需2 h左右;操作简单,经济实用,不需要昂贵的仪器设备。值得指出的是,本实验室研发的7个LAMP检测技术是分别特异性针对7种小麦赤霉病病菌的,因而病原菌的检测与种的鉴定可同步完成。
本研究确定亚细亚镰孢为江苏省中部地区小麦赤霉病的优势致病菌,与前人的研究结果基本一致[12,15,16,30,32]。本研究发现由该镰孢菌引起的小麦赤霉病比重显著上升。假禾谷镰孢(F.pseudograminearum)是引起小麦茎基腐病的主要致病菌[33],在河南省分布较广泛,同时该镰孢菌也是部分地区小麦赤霉病的致病菌[13,34]。本研究也应用本实验室研发的假禾谷镰孢的LAMP检测技术对该病原菌进行了检测,151份小麦赤霉病样本的检测结果均为阴性(结果未显示),表明该镰孢菌对目前江苏中部地区小麦赤霉病的发生可能不起作用。虽然本研究基本涵盖了小麦赤霉病的主要致病菌种类,但是由于本实验室研发的LAMP技术体系检测的病原菌种类数量有限,还需进一步研发其他小麦赤霉病病菌的LAMP检测体系,以补充完善小麦赤霉病病菌的快速检测技术。
综上所述,本研究应用LAMP技术明确了江苏省中部地区小麦赤霉病菌的种群组成和地理分布,对小麦赤霉病的田间防治有一定的参考价值,并为小麦赤霉病菌的快速检测和鉴定提供了新的方法。
致谢:南京农业大学王秀娥老师、扬州大学陈孝仁老师为本研究采集部分小麦赤霉病样本,谨此致谢!
参考文献:
[1] GOSWAMI R S,KISTLER H C.Heading for disaster:Fusariumgraminearum on cereal crops [J].MolecularPlantPathology,2004,5(6):515.
[2] 黄 昌,牟建梅,刘敬阳,等.小麦赤霉病抗性鉴定和新抗源筛选 [J].江苏农业科学,2000(2):24.
HUANG C,MOU J M,LIU J Y,etal.Resistant identification and screening new sources of wheat head blight [J].JiangsuAgriculturalSciences,2000(2):24.
[3] PARRY D W,JENKINSO P J,MCLEOD L.Fusariumear blight(scab) in small grain cereals-a review [J].PlantPathology,1995,44(2):207.
[4] 陆维忠,程顺和,王裕中.小麦赤霉病研究[M].北京:科学出版社,2001:15.
LU W Z,CHENG S H,WANG Y Z.Study of wheat head blight [M].Beijing:Science Press,2001:15.
[5] 全国小麦赤霉病研究协作组.我国小麦赤霉病穗部镰刀菌种类、分布及致病性 [J].上海师范学院学报(自然科学版),1984(3):72-74.
National Cooperation Group for Wheat Head Blight Research.Distribution and pathogenicity ofFusariumspecies causing wheat scab [J].JournalofShanghaiNormalUniversity(NatureSciences),1984(3):72-74.
[6] 李克昌.小麦赤霉病及其防治[M].上海:上海科学技术出版社,1982:20.
LI K C.Study of wheat head blight and its prevention [M].Shanghai:Shanghai Scientific and Technical Publishers,1982:20.
[7] 陈利锋,赵燕驹,马国良,等.青海省小麦赤霉病致病菌的鉴定 [J].南京农业大学学报,1996,19(2):117.
CHEN L F,ZHAO Y J,MA G L,etal.Identification of pathogen causing wheat head blight in Qinghai Province [J].JournalofNanjingAgriculturalUniversity,1996,19(2):117.
[8] O'DONNELL K,WARD T J,GEISER D M,etal.Genealogical concordance between the mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within theFusariumgraminearumclade [J].FungalGeneticsandBiology,2004,41(6):600-601.
[9] O'DONNELL K,WARD T J,ABERRA D,etal.Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within theFusariumgraminearumspecies complex from Ethiopia [J].FungalGeneticsandBiology,2008,45(11):1514.
[10] QU B,LI H P,ZHANG J B,etal.Geographic distribution and genetic diversity ofFusariumgraminearumandF.asiaticumon wheat spikes throughout China [J].PlantPathology,2008,57(1):15.
[11] DAAMEN R A,LANGERAK C J,STOL W.Surveys of cereal disease and pests in the Netherlands.Ⅲ.Monographella nivalis andFusariumspp.in winter wheat fields and seed lots [J].NetherlandsJournalofPlantPathology,1991,97:106.
[12] ZHANG J B,LI H P,DANG FJ,etal.Determination of the trichothecene mycotoxin chemotypes and associated geographical distribution and phylogenetic species of theFusariumgraminearumclade from China [J].MycologicalResearch,2007,111(8):967.
[13] 徐 飞,杨共强,王俊美,等.河南省小麦赤霉病菌种群组成及致病力分化[J].植物病理学报,2016,46(3):294.
XU F,YANG G Q,WANG J M,etal.Composition and variation in aggressiveness ofFusariumpopulations causing wheat head blight in Henan Province [J].ActaPhytopathologicaSinica,2016,46(3):294.
[14] 潘晓静,陈 楠,姚 远,等.东北地区小麦赤霉病镰孢菌种群及其致病性测定 [J].华北农学报,2015,30(3):205.
PAN X J,CHEN N,YAO Y,etal.Population and pathogenicity ofFusariumspp.causing wheat head blight in northeast of China [J].ActaAgriculturaeBoreali-sinica,2015,30(3):205.
[15] QIU J B,XU J H,SHI J R,etal.Molecular characterization of theFusariumgraminearumspecies complex in Eastern China [J].EuropeanJournalofPlantPathology,2014,139(4):811.
[16] DONG F,QIU J B,XU J H,etal.Effect of environmental factors onFusariumpopulation and associated trichothecenes in wheat grain grown in Jiangsu Province,China [J].InternationalJournalofFoodMicrobiology,2016,230:58.
[17] O'DONNELL K,KISTLER H C,TACKE B K,etal.Gene genealogies reveal global phylogeographic structure and reproductive isolation among lineages ofFusariumgraminearumthe fungus causing wheat scab [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2000,97(14):7905-7910.
[18] CONSOLO V F,ORTEGA L M,GRACIELA S,etal.Genetic diversity ofFusariumgraminearumsensu lato isolates from wheat associated with Fusarium head blight in diverse geographic locations of Argentina [J].RevistaArgntentinadeMicrobiologia,2015,47(3):245.
[19] LI F Q,WANG W,MA J J,etal.Natural occurrence of masked deoxynivalenol in Chinese wheat and wheat-based products during 2008-2011 [J].WorldMycotoxinJournal,2012,5(3):221.
[20] JI F,XU J H,LIU X,etal.Natural occurrence of deoxynivalenol and zearalenone in wheat from Jiangsu Province,China [J].FoodChemistry,2014,157:393.
[21] NOTOMI T,OKAYAMA H,MASUBUCHI H,etal.Loop-mediated isothermal amplification of DNA [J].NucleicAcidsResearch,2000,28(12):63.
[22] XU M,YE W W,ZENG D D,etal.Rapid diagnosis of wheat head blight caused byFusariumasiaticumusing a loop-mediated isothermal amplification assay [J].AustralasianPlantPathology,2017,46(2):4.
[23] LU C C,ZHANG H F,WANG Y C,etal.Rapid diagnosis ofFusariumroot rot in soybean caused byFusariumequisetiorFusariumgraminearumusing loop-mediated isothermal amplification(LAMP) assay [J].AustralasianPlantPathology,2015,44(4):440.
[24] ZENG D D,YE W W,XU M,etal.Rapid diagnosis of soya bean root rot caused byFusariumculmorumusing a Loop-mediated isothermal amplification assay [J].JournalofPhytopathology,2017,165(165):252.
[25] 徐 倩.三种果类褐腐病菌及燕麦镰孢菌的LAMP检测 [D].南京:南京农业大学,2017:50.
XU Q.LAMP detection ofFusariumavenaceumand three brown rot pathogens of fruits [D].Nanjing:Nanjing Agricultural University,2017:50.
[26] 曾丹丹.拟轮枝镰孢、黄色镰孢、雪松疫霉、栗黑水疫霉及大豆种传病原菌的LAMP检测 [D].南京:南京农业大学,2017:27.
ZENG D D.LAMP detection ofFusariumverticillioides,F.culmorum,Phytophthoralateralis,P.cambivoraand seed-borne pathogens on soybean [D].Nanjing:Nanjing Agricultural University,2017:27.
[27] 方中达.植病研究方法 [M].北京:中国农业出版社,1998.
FANG Z D.Research methodology of plant diseases [M].Beijing:China Agriculture Press,1998.
[28] 许 娟.安徽小麦赤霉病菌生物学特性及遗传多样性研究 [D].合肥:安徽农业大学,2012:23.
XU J.The biological characteristics and genetic diversity of wheat scab pathogens in Anhui Province [D].Hefei:Anhui Agricultural University,2012:23.
[29] 方兴洲.安徽小麦赤霉病菌菌群分布及产毒类型相关研究 [D].合肥:安徽农业大学,2013:17.
FANG X Z.Distribution and toxin types of wheat scab pathogens in Anhui Province [D].Hefei:Anhui Agricultural University,2013:17.
[30] 胡迎春,李 伟,陈怀谷,等.中国冬小麦主产区小麦赤霉病菌种群组成及其致病力 [J].江苏农业学报,2010,26(5):955.
HU Y C,LI W,CHEN H G,etal.Composition and pathogenicity of theFusariumgraminearumspecies complex in main winter wheat production areas of China [J].JiangsuJournalofAgriculturalSciences,2010,26(5):955.
[31] 张 林,张梦雅,康 健,等.一种快速检测小麦赤霉病菌种类的方法 [J].河南农业科学,2017,46(1):88.
ZHANG L,ZHANG M Y,KANG J,etal.A rapid detection method forGibberellasaubinetii[J].JournalofHenanAgriculturalSciences,2017,46(1):88.
[32] 史文琦,杨立军,冯 洁,等.小麦赤霉病流行区镰刀菌致病种及毒素化学型分析 [J].植物病理学报,2011,41(5):492.
SHI W Q,YANG L J,FENG J,etal.Analysis on the population structure ofFusariumpathogenicspp. and its mycotoxin chemotypes in Fusarium head blight epidemic region [J].ActaPhytopathologicaSinica,2011,41(5):492.
[33] LI H L,YUAN H X,FU B,etal.First report ofFusariumpseudograminearumcausing crown rot of wheat in Henan,China [J].PlantDisease,2012,96(7):1065.
[34] AOKI T.Morphological and molecular characterization ofFusariumpseudograminearumsp.nov. formerly recognized as the group 1 population ofF.graminearum[J].Mycologia,1999,91(4):597.
