内皮素A受体拮抗剂预处理对犬体外循环后肾功能的影响
2018-05-10白毅平冯建国张亚兵
白毅平,冯建国,刘 力,龙 翔,张亚兵,刘 斌
(1.西南医科大学附属医院麻醉科,四川泸州 646000;2.四川大学华西医院麻醉科,成都 610000)
体外循环心脏术后肾损伤发生率为20%~30%,而肾损伤患者围术期病死率为20%~80%[1],病死率的高低与肾损伤的严重程度呈明显正相关[2]。前期临床结果提示,较体外循环(CPB)前肾脏超声微泡造影指标而言,儿童及成人CPB术中肾脏各个区域的灌注均出现了降低[3-4]。KUMAR等[1]讨论术后肾损伤与CPB期间肾灌注密切相关,并且肾损伤若早期诊断和治疗可以完全恢复[5]。内皮素A受体在肾脏内仅表达在血管平滑肌上,其拮抗剂西他生坦可以高选择性扩张肾血管,改善肾微循环。本文采用西他生坦预处理,观察其对CPB下比格犬肾功能影响,现将研究结果报道如下。
1 材料与方法
1.1材料 雄性比格犬18只,2~4岁,10~15 kg,采用随机数字表法分为3组(n=6):假手术组(Sham组)全身麻醉5 h;CPB组转机2 h并心脏复跳后观察2 h;CPB+内皮素受体拮抗剂组(ETA组)在CPB前1 h持续泵入西他生坦0.7 mg/kg(批号:B29F7E10070,上海源叶生物科技有限公司)。
1.2方法 经上下腔及主动脉插管建立CPB,采用非搏动性灌注,浅低温CPB(32~34 °C),CPB期间转机流量1.8~2.2 L·min-1·m2,维持平均动脉压力(60~90 mm Hg),血气管理采用α-稳态管理策略。通过同种异体输血维持血细胞比容(Hct)24%~28%,心肌保护采用自制HTK(细胞内)停跳液。CPB前(T1)、CPB 1 h(T2)、CPB结束(T3)、CPB后1 h(T4)、CPB后2 h(T5)采集体温、平均动脉压(MAP)和动脉血气[酸碱度(pH)、二氧化碳分压(PaCO2)、氧分压(PaO2)、血红蛋白(Hb)、血氧饱和度(SaO2)];T1、T5抽取外周血监测血肌酐及尿素氮,根据KDIGO指南[6],观察评定急性肾损伤(AKI)。
CPB停机观察2 h后,采集脏肾标本,分别保存于4%甲醛或-80 ℃冰箱中。肾脏标本,4%甲醛固定,脱水,石蜡包埋并切片,常规行苏木精-伊红(HE)染色。镜下观察肾脏组织病理学改变,肾小管坏死表现为刷状缘丢失,扩张,管型形成,细胞分解。由2位有经验的医师依坏死肾小管所占比例对其严重程度进行半定量评分。评分标准:0分,正常组织,无可见明显损伤;1分,很少量的肾小管坏死(少于10%);2分,轻度肾小管坏死(10%~25%);3分,中度肾小管坏死(>25%~75%);4分,重度肾小管坏死(>75%)[7]。低温保存肾剪取小块组织,加入裂解液与蛋白酶抑制剂研磨、离心,Western blot测定磷酸化蛋白激酶(p-Akt),磷酸化内皮型一氧化氮合酶(p-eNOS)蛋白水平。
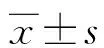
2 结 果
2.13组各时间点体温与MAP分析 CPB组和ETA组T2的体温与MAP明显低于T1(P<0.05),其余时间点比较差异无统计学意义(P>0.05);Sham组体温与MAP各时间点比较差异无统计学意义(P>0.05),见表1。

表1 3组各时间点体温与MAP比较
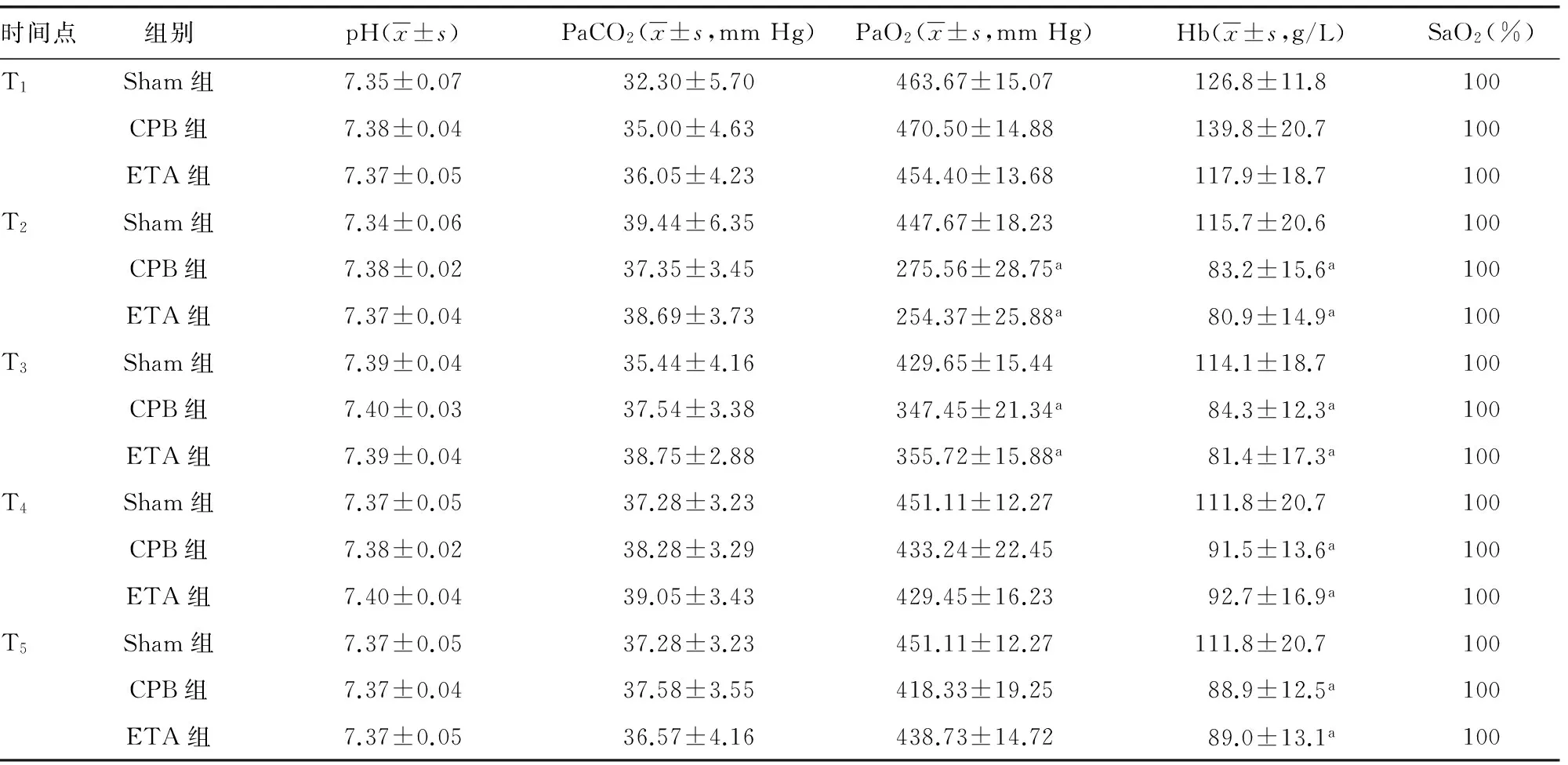
表2 3组犬动脉血气分析比较
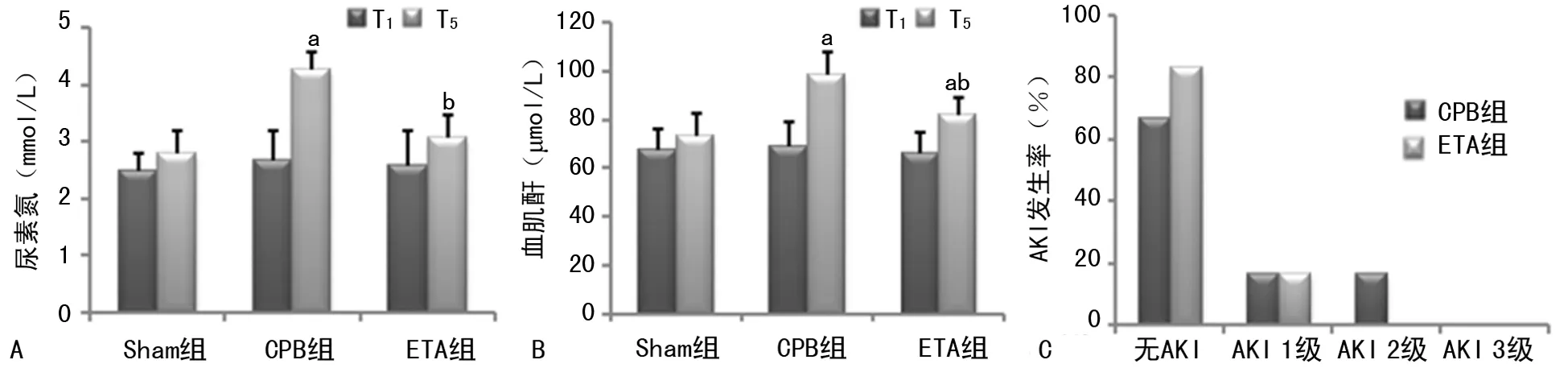
A:3组T1和T5时尿素氮比较;B:3组T1和T5时血肌酐比较;C:CPB组与ETA组不同等级AKI发生率。a:P<0.05,与T1比较;b:P<0.05,与CPB组比较
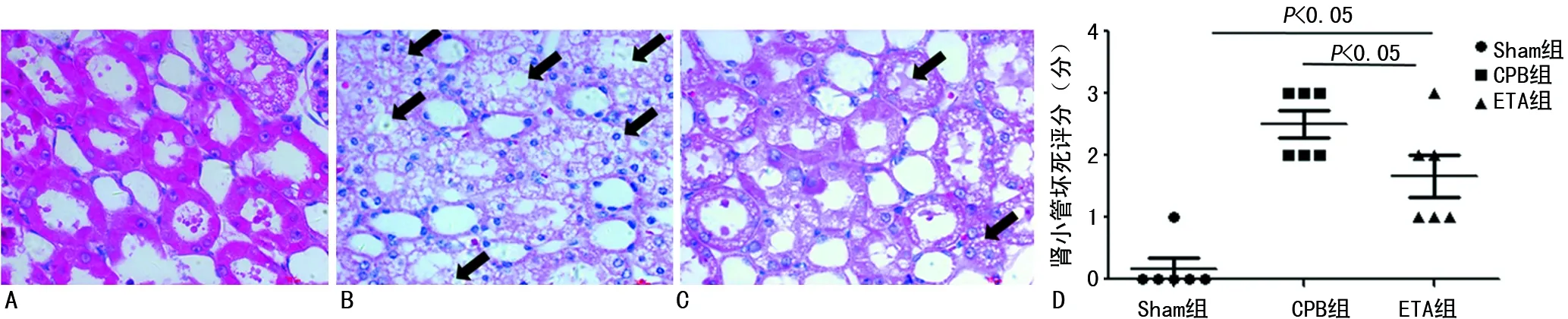
A:Sham组肾小管HE染色(HE,×200);B:CPB组肾小管HE染色(HE,×200);C:ETA组肾小管HE染色(HE,×200);D:3组肾小管坏死评分点状图。箭头显示变性坏死的肾小管上皮细胞
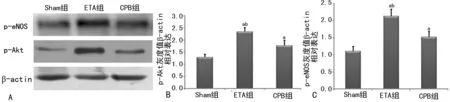
A:Western blot蛋白条带;B:p-Akt灰度值与β-actin灰度值的比值柱形图;C:p-eNOS灰度值与β-actin灰度值的比值柱形图。a:P<0.05,与Sham组比较;b:P<0.05,与CPB组比较
2.2动脉血气分析 CPB组和ETA组中,与T1相比,PaO2在T2、T3时刻明显降低,Hb在T2、T3、T4、T5时刻明显降低(P<0.05),其余各时间点比较差异无统计学意义(P>0.05),见表2。
2.33组血肌酐、尿素氮及AKI发生率 T5时CPB组血肌酐和尿素氮明显高于T1时(P<0.05),T5时ETA组明显低于CPB组(P<0.05);ETA组的AKI发生率明显低于CPB组(P<0.05),见图1。
2.4肾小管坏死评分 CPB组及ETA组肾小管坏死评分明显高于Sham组(P<0.05),CPB组明显高于ETA组(P<0.05),见图2。
2.53组蛋白表达 与Sham组比较,CPB组及ETA组p-Akt,p-eNOS表达明显增加(P<0.05);与CPB组比较,ETA组p-Akt,p-eNOS表达明显增加(P<0.05),见图3。
3 讨 论
AKI在体外循环心脏手术中的高发生率和不良预后给患者带来了巨大痛苦,也增加了医院成本,更不利于社会医疗资源的合理配置[8-10]。既往有研究探讨了相关防治措施,但由于发病机制不清,缺乏有效的早期检测手段,临床干扰因素多等原因,目前尚无有效可靠的干预手段。
本课题组[3-4]及其他课题组[11-12]研究发现,即使CPB期间正常的MAP,肾微循环灌注仍然明显降低。O′NEIL等[13]指出,其原因可能与CPB非生理性灌注引起的肾微循环灌注改变相关,但其改变的根本原因仍有待进一步研究。任何原因造成的肾微循环灌注降低均可导致肾血管内皮系统受损,最终可致肾损伤[14]。内皮素是强有力的血管收缩剂,生理相关肽主要是ET-1,其受体ETA受体主要分布在肾血管平滑肌细胞,调节肾脏微循环;西他生坦是高选择性ETA受体阻断剂[15]。为此,本课题小组提出假设:西他生坦通过改善体外循环期间肾脏微循环灌注,预防CPB后AKI。
本研究发现,犬CPB期间转机流量、MAP、Hb都在既往研究推荐的正常范围(调节转机流量1.8~2.2 L·min-1·m-2,维持MAP 60~90 mm Hg;Hb 70~100 g/L)[16-17],也并未出现缺氧,但CPB后血肌酐都明显高于CPB前。根据KDIGO指南对AKI的分级标准[6],CPB组2只犬发生AKI,发生率为33.3%,与文献报道结果相近(20%~30%)[18],而西他生坦预处理后的犬,急性肾损伤发生率降为16.7%。肾微循环灌注降低会造成肾血管内皮系统受损,最终引起肾损伤[14]。GUAN等[15]研究也显示,ETA受体阻断剂可增加肾血流及肾小球滤过率,从而改善肾微循环灌注、减少肾损伤。本研究采用了大动物模型,且是CPB完全阻断上下腔,更接近于临床,得到与GUAN研究一致的结果。在进一步的HE染色病理结果中发现,给予西他生坦预处理后,肾小管水肿减轻,坏死评分明显降低,可推断西他生坦可能通过保护肾小管结构的稳定,从而保护肾功能。在既往的小动物非CPB缺血模型中,也有研究佐证本研究结果[19-20]。
本研究能明确观察到西他生坦预处理CPB犬后,除了血肌酐及肾小管坏死评分降低,肾组织中p-Akt及p-eNOS蛋白表达也明显升高。在既往缺血损伤模型中[21],p-Akt可以活化内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),促进eNOS磷酸化,形成p-eNOS,刺激血管内皮细胞合成和释放NO。NO可以通过弥散的方式扩散到周围平滑肌细胞,引起平滑肌细胞松弛,舒张血管,改善微循环。NO同时又具有抗炎、细胞保护、抗氧化和调节线粒体呼吸链的作用[22-23]。本研究中西他生坦预处理对CPB犬肾脏的保护作用,可能与其激活Akt-eNOS信号通路,促进NO释放,改善动物肾微循环灌注有关。本课题组计划进一步实验将采用影像学实时监测肾脏微循环灌注,用确切数据证实西他生坦预对微循环的改善程度。
肾损伤有功能损伤及结构损伤两个阶段[13,24]。功能损伤阶段是在损伤早期由于内皮受损、炎症因子释放、内皮NO表达下降等因素引起一过性的毛细血管收缩导致的损伤。本课题组既往研究显示,CPB期间肾微循环灌注降低[3-4],术后一过性的血肌酐和尿素增加可能与这个原因相关。结构损伤是在损伤后期出现内皮细胞坏死、毛细血管缺失导致微循环障碍引起的肾损伤,继而引起血肌酐和尿素氮升高。本课题发现CPB组血肌酐和尿素明显升高,肾小管坏死评分也明显升高,证明发生了结构损伤;西他生坦预处理后结构损伤得到明显改善,可能与西他生坦激活Akt-eNOS信号通路,刺激NO合成和释放,改善微循环相关。
综上所述,CPB可能会导致急性肾损伤,内皮素A受体拮抗剂预处理可能通过激活Akt-eNOS信号通路,可促进NO释放,为改善肾微循环灌注起到肾保护作用。
[1]KUMAR A B,SUNEJIA M.Cardiopulmonary bypass-associated acute kidney injury[J].Anesthesiology,2011,114(4):964-970.
[2]UCHINO S,BELLOMO R,GOLDSMITH D,et al.An assessment of the RIFLE criteria for acute renal failure in hospitalized patients[J].Crit Care Med,2006,34(7):1913-1917.
[3]ZHANG L U,ZHANG J Y,ZHONG X F,et al.Exploration of renal microcirculation perfusion during cardiopulmonary bypass with contrast-enhance ultrasound[J].J Sichuan Univ (Med Sci Edi),2015,46(6):846-850.
[4]ZHONG X F,ZHU D A,LU Q,et al.Monitoring renal microcirculation perfusion alteration with contrast-enhanced ultrasound during cardiopulmonary bypass[J].J Sichuan Univ (Med Sci Edi),2013,44(4):646-650.
[5]GOLDBERG R,DENNEN P.Long-term outcomes of acute kidney injury[J].Adv Chronic Kidney Dis,2008,15(3):297-307.
[6]ALSEIARI M,MEYER K B,WONG J B.Evidence underlying KDIGO (kidney disease:improving global outcomes) guideline recommendations:a systematic review[J].Am J Kidney Dis,2016,67(3):417-422.
[7]BADYLAK S F,KERN K B,TACKER W A,et al.The comparative pathology of open chest vs.mechanical closed chest cardiopulmonary resuscitation in dogs[J].Resuscitation,1986(13):249-264.
[8]VOLPON L C,SUGO E K,CONSULIN J C,et al.Epidemiology and outcome of acute kidney injury according to pediatric risk,injury,failure,loss,end-stage renal disease and kidney disease:improving global outcomes criteria in critically Ⅲ children-A prospective study[J].Ped Criti Care Med,2016,17(5):e229-238.
[9]CABRAL F C,GARCIA P C R,MATTIELLO R,et al.Influence of acute kidney injury defined by the pediatric risk,injury,failure,loss,end-stage renal disease score on the clinical course of PICU patients[J].Ped Critic Care Med,2015,16(8):e275-282.
[10]GIL-RUIZ GIL-ESPARZA M A,ALCARAZ ROMERO A J,ROMERO OTERO A,et al.Prognostic relevance of early AKI according to pRIFLE criteria in children undergoing cardiac surgery[J].Pediatric Nephrology,2014,29(7):1265-1272.
[11]RICKSTEN S E,BRAGADOTTIR G,REDFORS B.Renal oxygenation in clinical acute kidney injury[J].Critic Care,2013,17(2):221.
[12]LANNEMYR L,BRAGADOTTIR G,KRUMBHOLZ V,et al.Effects of cardiopulmonary bypass on renal perfusion,filtration,and oxygenation in patients undergoing cardiac surgery[J].Anesthesiology,2017,126(2):205-213.
[13]O′NEI M P,FLEMING J C,BADHWAR A,et al.Pulsatile versus nonpulsatile flow during cardiopul-
monary bypass:microcirculatory and systemic effects[J].Thorac Surg,2012,94(6):2046-2053.
[14]BASILE D P.Challenges of targeting vascular stability in acute kidney injury[J].Kidney Int,2008,74(3):257-258.
[15]GUAN Z,VANBEUSECUM J P,INSCHO E W.Endothelin and the renal microcirculation[J].Semin Nephrol,2015,35(2):145-155.
[16]ROSNER M H,PORTILLA D,OKUSA M D.Analytic reviews:cardiac surgery as a cause of acute kidney injury:pathogenesis and potential therapies[J].J Int Care Med,2008,23(1):3-18.
[17]PAROLARI A,ALAMANNI F,GHERLI T,et al.Cardiopulmonary bypass and oxygen consumption:oxygen delivery and hemodynamics[J].Ann Thora Surg,1999,67(5):1320-1327.
[18]KUMAR A B,SUNEJA M.Cardiopulmonary bypass-associated acute kidney injury[J].Anesthesiology,2011(114):964-970.
[19]吴平,陈孝文,江黎明,等.内皮素受体拮抗剂联合内皮源血管松弛因子防治大鼠缺血性急性肾衰竭[J].中国中西医结合肾病杂志,2004,5(3):133-135.
[20]郑传东,苟欣.肾缺血再灌注损伤的内皮素作用的生物学研究[J].重庆医科大学学报,2007,32(2):218-221.
[21]BLANES M G,OUBAHA M,RAUTUREAU Y,et al.Phosphorylation of -tyrosine 801 of vascular endothelial growth factor receptor-2 is necessary for akt-dependent endothelial nitric-oxide synthase activation and nitric oxide release from endothelial cells[J].J Biol Chem,2007,282(14):10660-10669.
[22]SHU X,KELLER T C S,BEGANDT D,et al.Endothelial nitric oxide synthase in the microcirculation[J].Cell Mol Life Sci,2015,72(23):4561-4575.
[23]BHATRAJUA P,CRAWFORDB J,HALL M,et al.Inhaled nitric oxide:current clinical concepts[J] Nitric Oxide,2015(50):114-128.
[24]兰晓莉,李春艳.核素显像在肾脏疾病评价中的临床应用[J].临床泌尿外科杂志,2015,29(10):885-888.
