罗哌卡因乳酸-蓖麻油共聚物微球在小鼠坐骨神经旁的缓释作用研究
2018-05-10王博赵峰公茂伟段明达霍修林龚洁傅强
王博,赵峰,公茂伟,段明达,霍修林,龚洁,傅强
有效控制术后疼痛可以提高患者的满意度和舒适度,加速患者康复,减少慢性疼痛综合征的发生。阿片类药物曾广泛用于术后疼痛的治疗,但恶心、呕吐、呼吸抑制等副作用限制了其临床使用[1]。随着神经阻滞技术的推广和应用,局部麻醉药物的应用越来越广泛[2-3],局部注射局麻药进行围术期镇痛也受到了医生和患者的青睐。尽管局麻药可有效减轻患者的疼痛,但临床常用的局麻药作用时间较短,不能有效长时间地镇痛[4-5],需要间断注射或通过植入导管持续泵入给药[6],不仅需要相应的设备,增加了患者的医疗负担,同时留置的导管容易移位、脱出或引起感染[7]。
随着药物缓释技术的发展,国内外学者对局麻药缓释给药系统进行了研究,如水凝胶、脂质囊、微球技术等[8]。微型成球技术利用天然的或合成的高分子聚合物作为控制药物释放的载体,可使药物缓慢释放,延长药物的作用时间。该技术的应用不仅延长了局部单次给药后的镇痛时间,减少了给药次数,同时也降低了局麻药物血药浓度的波动及其毒性反应。本研究以生物降解聚合物乳酸-蓖麻油作为载体材料,盐酸罗哌卡因为包裹药物,采用双重乳化-溶剂挥发法合成一种缓释制剂罗哌卡因乳酸-蓖麻油共聚物微球,将其植入小鼠坐骨神经旁,通过小鼠感觉运动阻滞时效和体内血药浓度来评估其缓释作用效果,现报告如下。
1 材料与方法
1.1 主要试剂和仪器 罗哌卡因对照品(中国药品生物制品检定所);乳酸-蓖麻油共聚物(实验室自制);氢氧化钠、氯仿等试剂均为市售化学纯或分析纯。ZH-YLS-6B智能热板仪(安徽正华生物仪器设备有限公司);LC-1260高效液相色谱仪(安捷伦科技有限公司);FJ200-S数显高速均质机(上海标本模型厂);DF-Ⅱ型恒温磁力搅拌器(金坛市杰瑞尔电器有限公司)。
1.2 药物的制备 采用双重乳化-溶剂挥发法制备乳酸-蓖麻油共聚物微球。精密称取一定量的罗哌卡因,用蒸馏水溶解作为内水相;另取适量乳酸-蓖麻油共聚物和乳化剂溶于二氯甲烷作为有机相。将两相混合,采用高速分散均质机均质90s,制成初乳。将初乳移入外水相聚乙烯醇水溶液中,用高速分散均质机均质90s,制得复乳。将复乳在磁力搅拌器上搅拌2h后离心、过滤,用超纯水洗涤3次,收集微球,真空冷冻干燥24h后,–4℃储藏备用。对照组不加罗哌卡因,同种方法制备成不含药的乳酸-蓖麻油共聚物空白微球。
1.3 实验动物筛选 取体重20~25g的雄性昆明小鼠,置于50℃ ZH-YLS-6B智能热板上,以小鼠舔后足反应的潜伏期为痛阈指标,每只小鼠测定3次,每次间隔5min,取3次测定结果的平均值作为基础痛阈。将反应潜伏期小于5s或大于30s的小鼠剔除,并保证小鼠双侧下肢感觉运动无明显差异。
1.4 动物分组及给药 将筛选后符合标准的150只雄性昆明小鼠随机分为3组:空白微球对照组(A组,n=50)、罗哌卡因组(B组,n=50)、罗哌卡因乳酸-蓖麻油共聚物微球组(C组,n=50)。小鼠经2%七氟醚吸入麻醉后俯卧位固定于手术台上,剔除臀部鼠毛,切开皮肤和皮下组织,钝性分离暴露双下肢坐骨神经,在其周围均匀包埋微球或注入盐酸罗哌卡因(0.2ml,0.5%)建立动物模型。
1.5 小鼠坐骨神经感觉阻滞评估 每组分别在给药后10min、30min、1h、3h、5h、7h、10h、15h、30h、48h时间点采用热踏板法测定小鼠舔后足潜伏时间,每个时间点测定5只小鼠。
1.6 小鼠坐骨神经运动阻滞评分 热板实验30s后提尾观察小鼠后爪的伸展及屈曲能力并进行评分。1分为足部及趾部伸展及屈曲正常;2分为足部及趾部屈曲正常,伸展能力受抑制;3分为足部及趾部尚能屈曲,但无伸展能力;4分为足部及趾部无屈曲及伸展能力,步态异常甚至出现拖腿现象。
1.7 高效液相色谱法测定小鼠血浆中罗哌卡因浓度 色谱条件:色谱柱InertSustain C18,5μm,4.6mm×250.0mm;流动相为乙腈-磷酸二氢钠-三乙胺(48:52:0.15),用磷酸调节pH至3.15;流速1.0ml/min;进样量20μl;检测波长210nm。血浆样品处理:各组小鼠在相应时间点完成坐骨神经感觉阻滞评估及运动阻滞评分后行眼眶取血,肝素抗凝,3500r/min离心8min,离心后提取血浆0.3ml,置于–20℃冰箱中备用。分析测定时,室温下溶解血浆标本,取200μl,加入100μl甲醇,漩涡混匀3min,10 000r/min离心10min后取上清液,注入液相色谱仪。血药浓度标准曲线的绘制:取空白小鼠血清0.5ml,加入不同浓度的罗哌卡因对照品溶液,配制成浓度为0.025~1μg/ml罗哌卡因血浆样品,按样品处理方法操作进行色谱分析,绘制标准曲线。根据标准曲线,计算出不同时间点的血药浓度。
1.8 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以表示,符合正态分布者采用配对t检验,不符合正态分布者采用Wilcoxon秩检验。P<0.05为差异有统计学意义。
2 结 果
2.1 感觉阻滞的评估 在植入罗哌卡因乳酸-蓖麻油共聚物微球后3h,C组小鼠给药侧肢体出现明显的感觉阻滞效果,反应时间较B组明显延长,10h时药效达到最强,30h时药效明显降低,48h时药效基本消退。C组给药后起效时间与B组相比较慢(表1)。
表1 小鼠热踏板缩足反应潜伏时间(s,±s,n=5)Tab. 1 Paw withdrawal thermal latency of the mice measured by hot plate (s, ±s, n=5)

表1 小鼠热踏板缩足反应潜伏时间(s,±s,n=5)Tab. 1 Paw withdrawal thermal latency of the mice measured by hot plate (s, ±s, n=5)
(1)P<0.05 compared with group A; (2)P<0.05 compared with group B
Time Group A Group B Group C 10min 12.31±1.21 13.35±1.22 13.54±1.45 30min 12.51±1.82 15.51±1.88(1) 13.81±1.82 1h 13.12±1.33 26.12±0.93(1) 13.41±2.00 3h 12.30±1.51 17.30±1.45(1) 16.31±1.55(1)5h 11.51±1.72 15.51±1.82(1) 18.31±0.81(1)7h 13.32±2.01 13.32±1.02 20.31±2.20(1)(2)10h 12.31±1.20 12.11±1.24 22.31±1.45(1)(2)15h 11.31±0.91 12.00±1.11 22.31±1.65(1)(2)30h 11.81±1.81 13.81±0.82 18.31±1.89(1)(2)48h 13.45±1.14 12.20±1.22 15.31±1.14
2.2 运动阻滞评分 A组小鼠肢体均无运动阻滞现象,运动阻滞评分为1分。B组小鼠1h时30%运动阻滞评分为3分,70%运动阻滞评分为2分,阻滞效果达到最强(P=0.003);10h后基本恢复正常。C组小鼠3h时75%给药侧肢体运动阻滞评分为2分,25%为1分(P=0.015);10h后80%运动阻滞评分为2分,20%为3分,阻滞效果达到最强(P=0.008);30h时40%运动阻滞评分为1分,60%运动阻滞评分为2分,运动阻滞开始恢复(P=0.05);48h后基本恢复正常(P=0.317)。各时间点各组小鼠行走及步态均未见明显异常。
2.3 血药浓度测定结果 C组小鼠罗哌卡因血药浓度在3h内上升较快,随后继续上升,10h达峰值,为121.25ng/ml,此后开始逐渐下降,48h后降至较低浓度。B组小鼠罗哌卡因血药浓度在1h内迅速上升,并于1h时达峰值,为199.87ng/ml,此后迅速下降,7h后基本消除完全。与B组比较,C组小鼠血浆罗哌卡因浓度上升速度较慢,波动范围较小(图1)。
3 讨 论
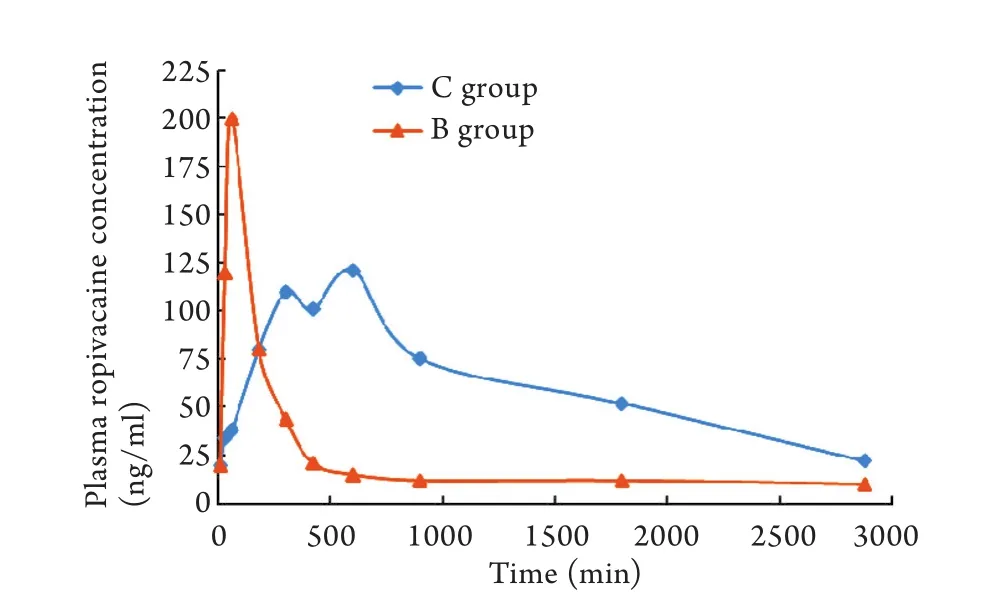
图1 小鼠血浆罗哌卡因浓度-时间曲线Fig. 1 Plasma ropivacaine concentration - time curve of mice
罗哌卡因是临床上大量用于治疗急、慢性疼痛的局麻药物,具有高度的感觉-运动神经阻滞分离特性,低浓度时以感觉神经阻滞为主,无进行性的运动神经阻滞,提高了患者迅速恢复运动的可能性,而且具有中枢神经和心血管毒性低、作用时间较长的特点[9-10],更适用于各种疼痛的治疗。聚乳酸(polylactic acid,PLA)是一种可生物降解材料,能被自然界中微生物完全降解为二氧化碳和水,不污染环境,因此在环保材料和生物医药等领域具有非常广阔的应用前景,已有众多学者将其用于药物缓释微球技术的研究[11-14]。蓖麻油是从蓖麻籽中提取的一种几乎无色或微带黄色的澄清黏稠液体,其中将近90%的成分为蓖麻油酸,其余的脂肪酸包括亚油酸、硬脂酸、棕榈酸等。已有蓖麻油与乳酸共聚合成高聚物作为药物缓释载体的相关报道[15-18]。
本实验室前期已成功将乳酸-蓖麻油共聚物作为罗哌卡因的载体材料,合成了罗哌卡因乳酸-蓖麻油共聚物缓释微球,研究发现其在体外可缓慢稳定释放,7d内约释放80%。乳酸-蓖麻油共聚物空白微球对小鼠坐骨神经无阻滞作用,因此本实验中用于空白对照组。本研究结果表明,罗哌卡因乳酸-蓖麻油共聚物微球在小鼠坐骨神经旁可发挥较好的缓释作用,其热痛觉阻滞时间较罗哌卡因注射液明显延长,可达到48h的感觉阻滞效果,而运动阻滞作用轻微,在临床镇痛方面具有重要的研究价值。血药浓度测定结果表明罗哌卡因乳酸-蓖麻油共聚物微球清除时间明显延长,血药浓度低,波动幅度小。因为研究初期合成的微球粒径大,载药量较少,血药浓度低,使镇痛效果降低,后续研究中将进一步探讨如何提高微球载药量、提高血药浓度。
【参考文献】
[1]Wu CL, Raja SN. Treatment of acute postoperative pain[J].Lancet, 2011, 377(9784): 2215-2225.
[2]Deng F, Lu R, Zhang H. Effect of exposure to anesthesia on the functions of nervous system of children in the growth period[J].Med J Chin PLA, 2015, 40(3): 248-254. [邓菲, 芦睿, 张惠. 麻醉暴露对发育期儿童神经系统功能的影响[J]. 解放军医学杂志, 2015, 40 (3): 248-254.]
[3]Li M, Guo ZH, Xie YD,et al. Effect of propranolol on the expression of growth factors and apoptotic factors related to infantile hemangiomas[J]. Med J Chin PLA, 2015, 40(3): 121-127. [李铭, 郭志辉, 谢义德, 等. 口服普萘洛尔对婴幼儿血管瘤相关生长因子及凋亡因子表达水平的影响[J]. 解放军医学杂志, 2015, 40(3): 121-127.]
[4]Barreveld A, Witte J, Chahal H,et al. Preventive analgesia by local anesthetics: the reduction of postoperative pain by peripheral nerve blocks and intravenous drugs[J]. Anesth Analg,2013, 116(5): 1141-1161.
[5]Zorzetto L, Brambilla P, Marcello E,et al. From microto nanostructured implantable device for local anesthetic delivery[J]. Int J Nanomedicine, 2016, 11: 2695-2709.
[6]Grant SA, Nielsen KC, Greengrass RA,et al. Continuous peripheral nerve block for ambulatory surgery[J]. Reg Anesth Pain Med, 2001, 26(3): 209-214.
[7]Ilfeld BM. Continuous peripheral nerve blocks: a review of the published evidence[J]. Anesth Analg, 2011, 113(4): 904-925.
[8]Weiniger CF, Golovanevski L, Domb AJ,et al. Extended release formulations for local anaesthetic agents[J]. Anaesthesia, 2012,67(8): 906-916.
[9]Li TF, Fan H,Wang YX. Epidural sustained release ropivacaine prolongs anti-allodynia and anti-hyperalgesia in developing and established neuropathic pain[J]. PLoS One, 2015, 10(1):e0117321.
[10]Li H, Liu T, Zhu Y,et al. Anin situ-forming phospholipid-based phase transition gel prolongs the duration of local anesthesia for ropivacaine with minimal toxicity[J]. Acta Biomater, 2017, 58:136-145.
[11]Zhang Z, Wu L, Li H,et al. Drug release characteristics and tissue distribution of rifapentine polylactic acid sustained-release microspheres in rabbits after paravertebral implantation[J]. Iran Red Crescent Med J, 2016, 18(11): e38661.
[12]Ratajczak-Enselme M, Estebe JP, Dollo G,et al. Epidural,intrathecal and plasma pharmacokinetic study of epidural ropivacaine in PLGA-microspheres in sheep model[J]. Eur J Pharm Biopharm, 2009, 72(1): 54-61.
[13]Tian HJ, Chen ZQ, Wang ZF,et al. The pharmacodynamics and biocompatibility of ropivacaine loading poly (lactide-coglycolide) microspheres in mice[J]. J Clin Anesthesiol, 2010,26(2): 148-150. [田洪居, 陈仲清, 王照飞, 等. 罗哌卡因乳酸羟基乙酸共聚物微球在小鼠的坐骨神经阻滞时效及生物相容性[J]. 临床麻醉学杂志, 2010, 26(2): 148-150.]
[14]Yu RH, Chen ZQ, Chen H,et al. Pharmacokinetics and pharmacodynamics of poly (lactide-co-glycolide) microspheres containing ropivacaine and dexamethasone for sciatic nerve block in mice[J]. J South Med Univ, 2010, 30(3): 502-505. [余让辉, 陈仲清, 陈辉, 等. 罗哌卡因-醋酸地塞米松聚乳酸羟基乙酸共聚物微球药效学和药动学的观察[J]. 南方医科大学学报, 2010, 30(3): 502-505.]
[15]Eckhard LH, Houri-Haddad Y, Sol A,et al. Sustained release of antibacterial lipopeptides from biodegradable polymers against oral pathogens[J]. PLoS One, 2016, 11(9): e0162537.
[16]Eckhard LH, Sol A, Abtew E,et al. Biohybrid polymerantimicrobial peptide medium against Enterococcus faecalis[J].PLoS One, 2014, 9(10): e109413.
[17]Sokolsky-Papkov M, Golovanevski L, Domb AJ,et al. Longacting poly (DL:lactic acid-castor oil) 3:7-bupivacaine formulation: effect of hydrophobic additives[J]. Pharm Res,2011, 28(12): 3265-3273.
[18]Sokolsky-Papkov M, Golovanevski L, Domb AJ,et al. Prolonged local anesthetic action through slow release from poly (lactic acid co castor oil)[J]. Pharm Res, 2009, 26(1): 32-39.
