右美托咪定对脂多糖刺激后大鼠肾上腺嗜铬细胞瘤细胞的保护作用及机制
2018-05-10周俊杰肖伟何璇彭娜童华生苏磊
周俊杰,肖伟,何璇,彭娜,童华生,苏磊
脓毒症是机体对感染的反应失调而导致的危及生命的器官功能障碍[1]。脓毒症相关性脑病系脓毒症脏器功能损伤之一,可表现为多种形式,包括注意力或定向力损伤、谵妄、昏迷等[2]。研究发现,脑功能障碍是脓毒症患者不良预后的重要因素[3],对于存活患者,可遗留记忆力下降、注意力改变等不同程度的认知功能障碍,严重影响患者生活质量[4]。脂多糖(lipopolysaccharide,LPS)是革兰阴性细菌细胞壁中的一种成分,被认为是革兰阴性菌感染产生全身症状的主要诱因[5]。LPS可刺激炎症因子的生成进而造成细胞损伤。Toll样受体家族(Tolllike receptors,TLR)是一类跨膜受体蛋白,在信号转导中扮演重要角色,其中TLR4主要识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)介导天然免疫,LPS是其重要的活化物。在LPS刺激下,TLR4可通过细胞内髓样分化因子88(myeloid differentiation factor 88,MyD88)诱导NF-κB活化,增加多种炎症因子表达,放大炎症反应[6]。镇静药物右美托咪定(dexmedetomidine,DEX)是一种高效的α2肾上腺素受体激动剂,可激动突触前膜α2受体,抑制去甲肾上腺素的释放,并终止疼痛信号的传导[7]。DEX可通过血脑屏障,具有良好的镇静、镇痛和抗焦虑作用,在ICU中得到了广泛的应用[8-9]。近年来有研究发现,DEX可减轻LPS导致的内毒素血症小鼠神经元损伤[10],但其机制尚不明确。来源于大鼠肾上腺嗜铬细胞瘤的细胞株PC12是神经系统体外研究应用最广泛的细胞株,因此,本研究探讨了DEX在LPS所致大鼠神经元损伤中的作用。
1 材料与方法
1.1 材料 DEX由江苏新晨医药股份有限公司提供。MTT、Hoechst购自美国MP公司,DMEM高糖培养基及胎牛血清购自美国Gibco公司,TNF-α及IL-6 ELISA试剂盒购自美国eBiosience公司。TLR4及MyD88抗体均购自美国Cell Signaling Technology公司。
1.2 细胞培养及处理 PC12细胞由南方医科大学法医学实验室提供。培养条件为37℃、5% CO2,使用含10%胎牛血清及1%青霉素-链霉素双抗的高糖DMEM培养基。LPS干预前2h更换为无血清培养基饥饿培养。第一部分分组及处理:①对照组:给予常规培养;②LPS 3、6、12h组:按照文献报道浓度[11],给予400μg/ml LPS刺激,分别在作用3、6、12h后进行检测,找到峰值作用时间,作为第二部分实验检测点。第二部分分组及处理:①对照组:给予常规培养;②LPS组:给予400μg/ml LPS刺激;③DEX组:按照文献报道的最佳保护浓度[12],给予100μmol/L DEX;④LPS+DEX组:同时给予400μg/ml LPS及100μmol/L DEX,各组在第一部分确定的时间点进行检测。
1.3 细胞存活率检测 将细胞接种于96孔板中,按上述方式干预后,使用MTT法进行细胞活力检测。具体步骤为:弃去96孔板中原培养基,每孔加入0.5mg/ml MTT溶液150μl,37℃避光孵育4h后,去除含有MTT的溶液,每孔加入DMSO溶液150μl,置摇床上避光低速振荡10min,在酶标仪490nm处测量各孔的吸光度(OD)值。细胞存活率=模型组OD值/对照组OD值×100%。
1.4 细胞凋亡分析 采用Hoechst染色法进行分析。首先弃去培养基,4%多聚甲醛冰上固定15min,PBS清洗后,再加10μg/ml Hoechst工作液37℃染色10min,置于荧光倒置显微镜以激发光360nm、发射光420nm观察并记录。
1.5 细胞上清TNF-α、IL-6水平检测 收集细胞上清,按照试剂盒说明书进行测定,显色反应终止后,使用酶标仪在450nm处检测各孔OD值,绘制标准曲线,计算各孔TNF-α、IL-6浓度。
1.6 细胞TLR4、MyD88、p-65、p-p65表达水平检测 采用Western blotting法,细胞经裂解提取蛋白,BCA法定量后,行SDS-PAGE凝胶电泳,将蛋白转移至硝酸纤维素膜并封闭后,分别与兔源抗TLR4(1:1000)、MyD88(1:1000)、p-65(1:1000)、p-p65(1:1000)的激活型一抗孵育,继而与辣根过氧化物酶标记的山羊抗兔二抗(1:5000)作用,经化学发光剂显迹,采用Image J进行灰度分析。
1.7 统计学处理 采用SPSS 20.0软件进行统计分析。数据均以表示,进行正态分布性检验后,多组间比较应用单因素方差分析,进一步两两比较应用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 LPS对PC12细胞活力及细胞上清IL-6、TNF-α水平的影响 400μg/ml LPS刺激PC12细胞后,与对照组相比,3h时细胞活力即明显下降,6h后进一步下降,而12h时细胞活力情况与6h接近(P<0.05)。LPS刺激后,细胞上清中IL-6、TNF-α水平明显上升,3、6、12h组与对照组比较差异有统计学意义(P<0.05),在6h达到峰值(图1)。
2.2 LPS对PC12胞内TLR4、MyD88、p-p65表达水平的影响 Western blotting结果显示,LPS刺激后,PC12中TLR4、MyD88、p-p65水平均明显升高(图2),在LPS刺激6h后达到高峰。结合前述LPS刺激后细胞上清中的IL-6及TNF-α变化结果,在后续实验中选取LPS刺激6h作为检测时间点。
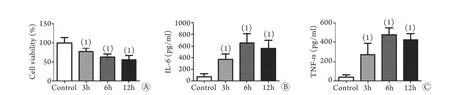
图1 LPS刺激对PC12细胞活力(A)及细胞上清IL-6(B)、TNF-α(C)水平的影响Fig.1 Effects of LPS on PC12 cell viability (A), concentrations of IL-6 (B) and TNF-α (C) at different time points

图2 LPS对PC12胞内TLR4(A)、MyD88(B)、p-p65(C)表达水平影响的时间效应Fig.2 Effects of LPS on the expressions of TLR4 (A), MyD88 (B) and p-p65 (C) in PC12 cells at different time points
2.3 DEX对LPS刺激的PC12细胞活力及凋亡的影响如图3A所示,同时给予400μg/ml LPS及100μmol/L DEX的LPS+DEX组,PC12细胞活力较LPS组增强,差异有统计学意义(P<0.05)。Hoechst染色结果(图3B)显示,对照组与DEX组细胞均匀着色,仅个别细胞呈强荧光,提示基础凋亡率极低;在LPS刺激后,着亮蓝色细胞明显增多,荧光强度增强,表明凋亡细胞数明显增多;LPS+DEX组凋亡细胞数较LPS组减少,提示DEX可减轻LPS诱导的PC12细胞凋亡。

图3 DEX对LPS刺激PC12细胞6h后细胞活力(A)及细胞凋亡水平(B, Hoechst staining, ×200)的影响Fig.3 Ef f ects of dexmedetomidine on the cell viability (A) and apoptosis rate (B, Hoechst staining, ×200) of LPS-treated PC12 cells
2.4 DEX对LPS刺激后PC12细胞上清IL-6、TNF-α水平的影响 细胞上清IL-6浓度测定结果显示,对照组浓度为71.50±25.33pg/ml,DEX组为58.72±30.40pg/ml,两组间无明显统计学差异(P>0.05);LPS刺激6h后上升至652.64±159.17pg/ml,与对照组比较差异有统计学意义(P<0.05);LPS与DEX共处理6h后,IL-6浓度为338.51±114.52pg/ml,与LPS组相比,差异有统计学意义(P<0.05)。细胞上清TNF-α浓度测定结果显示,对照组浓度为36.39±12.89pg/ml,单用DEX作用后浓度为55.87±17.90pg/ml,两组间无明显统计学差异(P>0.05);LPS刺激6h后较对照组明显升高,至476.74±73.90pg/ml(P<0.05);LPS与DEX共处理6h后,TNF-α浓度为305.34±62.99pg/ml,与LPS组相比,差异有统计学意义(P<0.05,图4)。结果提示DEX可减轻LPS诱导的PC12促炎因子释放。
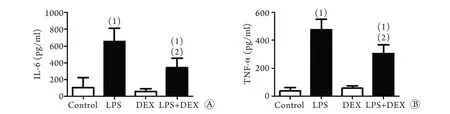
图4 DEX对LPS刺激PC12细胞6h后IL-6(A)、TNF-α(B)分泌水平的影响Fig.4 Effects of dexmedetomidine on the concentrations of IL-6 (A) and TNF-α (B) in the supernatants of LPS-treated PC12 cells
2.5 DEX对LPS刺激后PC12细胞TLR4、MyD88、p-p65表达水平的影响 Western blotting检测结果显示,DEX与LPS共处理后,PC12细胞中TLR4、MyD88、p-p65表达水平均较LPS组下降;经Image J灰度分析,两组差异有统计学意义(P<0.05,图5)。
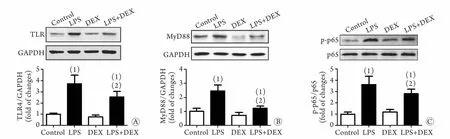
图5 DEX对LPS刺激PC12细胞6h后胞内TLR4(A)、MyD88(B)、p-p65(C)表达水平的影响Fig.5 Effects of dexmedetomidine on the expressions of TLR4 (A), MyD88 (B) and p-p65 (C) in LPS-treated PC12 cells
3 讨 论
脓毒症相关性脑病是脓毒症的严重并发症,目前其发病机制尚不明确,可能的机制包括血脑屏障损伤、脑血流改变、神经递质失衡及炎症因子的作用等[13]。脓毒症患者脑脊液中白细胞明显升高,提示存在内皮细胞损伤,导致血脑屏障功能障碍,细菌及其毒素进入中枢,直接造成神经元不同程度的损伤。脓毒症相关性脑病可导致病死率明显升高,但目前尚无特效的治疗。DEX是咪唑啉的衍生物,是一种新型α2肾上腺素受体激动剂,具有镇静、镇痛、抗交感、稳定血流动力学等多种作用,同时大剂量时对呼吸系统的抑制作用轻微,安全性好,因此作为麻醉辅助用药被广泛应用于ICU及麻醉科。近年来许多研究发现,DEX具有抗氧化、抑制细胞凋亡、影响细胞信号转导等作用,可改善脑缺血-再灌注、创伤等导致的颅脑损伤[14-17];在脓毒症的临床研究中发现,DEX可提高脓毒症患者28d生存率[18];有关内毒素血症的动物研究结果表明,DEX可改善实验动物肠道黏膜的血管灌注,减轻肠屏障功能损伤,减轻循环中的细菌数[19];DEX预处理亦可减缓LPS刺激的大鼠肾脏和肺脏组织中促炎因子TNF-α、IL-6、IL-18等的释放,减轻肾脏、肺脏的组织损伤[20-21];Ning等[10]的研究结果发现,DEX同样可减轻内毒素血症小鼠脑组织中的TNF-α和IL-6水平,但其具体机制尚不明确。本研究以PC12为研究对象,发现DEX可抑制LPS刺激后细胞内TLR4水平的升高,进而抑制TLR4/MyD88/NF-κB信号通路的活化,降低TNF-α和IL-6水平,减少细胞凋亡。
Toll样受体是一类天然免疫受体,最初在果蝇中发现,随后在哺乳动物中也发现其广泛表达,在天然免疫防御中发挥重要作用。TLR4是人类发现的第一个Toll家族蛋白,除了表达于参与宿主防御功能的细胞如巨噬细胞、树突状细胞等细胞以外,在肾小管上皮细胞、肠上皮细胞、呼吸道上皮细胞等全身多个脏器细胞中表达[22-23]。TLR4通过识别病原相关分子模式(PAMPs)的特有抗原成分而进行信号识别和转导,LPS是其重要的配体。LPS与TLR4结合后,其胞内段可与MyD88羧基端结合,进而通过IL-1受体相关激酶(interleukin-1 receptor associated kinase,IRAK)和肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6)激活NF-κB,促进多种炎症因子的转录。本研究观察到,DEX可抑制TLR4/MyD88/NF-κB信号通路的活化,降低TNF-α和IL-6水平,这与Liu等[24]在脓毒症肺组织中得到的结果一致。此外,TLR4/MyD88/NF-κB信号通路除了在急性炎症反应中发挥作用外,同样参与认知障碍等晚期并发症的病理过程[25-26],提示DEX可能对改善脓毒症相关性脑病患者远期生存质量有一定益处。
炎症介质的大量释放也是导致脓毒症相关性脑病的重要因素。脓毒症患者循环中存在大量炎症介质,同时患者血脑屏障损伤,炎症介质可进入中枢神经系统,进一步导致血脑屏障通透性增加,且刺激神经细胞及胶质细胞释放大量炎症介质,形成恶性循环。研究发现,脓毒症患者脑脊液中炎症介质TNF-α、IL-1明显升高,且其升高程度与预后明显相关[27]。DEX除可能通过抑制TLR4/MyD88/NF-κB信号通路降低TNF-α和IL-6水平外,亦可抑制c-Jun氨基末端激酶,减少TNF-α和IL-6的表达,且呈剂量依赖性[28]。本研究发现,DEX可明显降低LPS刺激后PC12细胞上清中TNF-α和IL-6水平,达到神经元保护的目的。
由于血脑屏障存在,许多药物对神经元的作用受到了一定限制。DEX作为一种中枢神经系统用药,同时具有良好的抗炎作用,进一步明确其机制及适宜的应用剂量对改善脓毒症相关性脑损伤具有重要意义。
【参考文献】
[1]Singer M, Deutschman CS, Seymour CW,et al. The third international consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA, 2016, 315(8): 801-810.
[2]Kuperberg SJ, Wadgaonkar R. Sepsis-associated encephalopathy:the blood-brain barrier and the sphingolipid rheostat[J]. Front Immunol, 2017, 8: 597.
[3]Feng Q, Ai YH, Gong H,et al. Characterization of sepsis and sepsis-associated encephalopathy[J]. J Intensive Care Med,2017, doi: 10.1177/0885066617719750.
[4]Pandharipande PP, Girard TD, Ely EW. Long-term cognitive impairment after critical illness[J]. N Engl J Med, 2014, 370(2):185-186.
[5]Faraj TA, McLaughlin CL, Erridge C. Host defenses against metabolic endotoxaemia and their impact on lipopolysaccharide detection[J]. Int Rev Immunol, 2017, 36(3): 125-144.
[6]Płóciennikowska A, Hromada-Judycka A, Borzęcka K.et al.Co-operation of TLR4 and raft proteins in LPS-induced proinflammatory signaling[J]. Cell Mol Life Sci, 2015, 72(3): 557-581.
[7]Tang C, Xia Z. Dexmedetomidine in perioperative acute pain management: a non-opioid adjuvant analgesic[J]. J Pain Res,2017, 11(10): 1899-1904.
[8]Tran A, Blinder H, Hutton B.et al. A systematic review of alpha-2 agonists for sedation in mechanically ventilated neurocritical care patients[J]. Neurocrit Care, 2018, 28(1): 12-25.
[9]Wang JX, Shi SZ, Li JH,et al. Application effects of dexmedetomidine combined with sevoflurane for anesthesia in short operations in children with burn injury[J]. Med J Chin PLA, 2016, 41(3): 254-257. [王金鑫, 史淑珍, 李菊红, 等. 右美托咪定复合七氟烷麻醉在小儿烧伤短小手术中的应用效果观察[J]. 解放军医学杂志, 2016, 41(3): 254-257.]
[10]Ning Q, Liu Z, Wang X,et al. Neurodegenerative changes and neuroapoptosis induced by systemic lipopolysaccharide administration are reversed by dexmedetomidine treatment in mice[J]. Neurol Res, 2017, 39(4): 357-366.
[11]Wang H, Xu YS, Wang ML,et al. Protective effect of naringin against the LPS-induced apoptosis of PC12 cells: Implications for the treatment of neurodegenerative disorders[J]. Int J Mol Med, 2017, 39(4): 819-830.
[12]Wang Q, Tan Y, Zhang N.et al. Dexmedetomidine inhibits activation of the MAPK pathway and protects PC12 and NG108-15 cells from lidocaine-induced cytotoxicity at its maximum safe dose[J]. Biomed Pharmacother, 2017, 91: 162-166.
[13]Schmutzhard E, Pfausler B. Neurologic complications of sepsis[J]. Handb Clin Neurol, 2017, 141: 675-683.
[14]Shen M, Wang S, Wen X,et al. Dexmedetomidine exerts neuroprotective effectviathe activation of the PI3K/Akt/mTOR signaling pathway in rats with traumatic brain injury[J]. Biomed Pharmacother, 2017, 95: 885-893.
[15]Jiang L, Hu M, Lu Y,et al. The protective effects of dexmedetomidine on ischemic brain injury: a meta-analysis[J]. J Clin Anesth, 2017, 40: 25-32.
[16]Luo C, Ouyang MW, Fang YY,et al. Dexmedetomidine protects mouse brain from ischemia-reperfusion injuryviainhibiting neuronal autophagy through up-regulating HIF-1α[J]. Front Cell Neurosci, 2017, 11: 197.
[17]Li Y, Liu S. The effect of Dexmedetomidine on oxidative stress response following cerebral ischemia-reperfusion in rats and the expression of intracellular adhesion molecule-1 (ICAM-1) and S100B[J]. Med Sci Monit Int, 2017, 23: 867-873.
[18]Zamani MM, Keshavarz-Fathi M, Fakhri-Bafghi MS,et al.Survival benefits of dexmedetomidine used for sedating septic patients in intensive care setting: a systematic review[J]. J Crit Care, 2016, 32: 93-100.
[19]Yeh YC, Wu CY, Cheng YJ,et al. Effects of Dexmedetomidine on intestinal microcirculation and intestinal epithelial barrier in endotoxemic rats[J]. Anesthesiology, 2016, 125(2): 355-367.
[20]Liu Z, Wang Y, Wang Y,et al. Dexmedetomidine attenuates inflammatory reaction in the lung tissues of septic mice by activating cholinergic anti-inflammatory pathway[J]. Int Immunopharmacol, 2016, 35: 210-216.
[21]Tan F, Chen Y, Yuan D,et al. Dexmedetomidine protects against acute kidney injury through downregulating inflammatory reactions in endotoxemia rats[J]. Biomed Rep, 2015, 3(3): 365-370.
[22]Wu BW, Zhu J, Shi HM,et al. Association between Toll-like receptor 4 Asp299Gly polymorphism and coronary heart disease susceptibility[J]. Braz J Med Biol Res, 2017, 50(9): e6306.
[23]Bachar O, Adner M, Uddman R,et al. Toll-like receptor stimulation induces airway hyper-responsiveness to bradykinin,an effect mediated by JNK and NF-kappa B signaling pathways[J]. Eur J Immunol, 2004, 34(4): 1196-1207.
[24]Liu X, Xiao Q, Zhao K,et al. Ghrelin inhibits high glucoseinduced PC12 cell apoptosis by regulating TLR4/NF-κB pathway[J]. Inflammation, 2013, 36(6): 1286-1294.
[25]Corrigan F, Arulsamy A, Collins-Praino LE,et al. Toll like receptor 4 activation can be either detrimental or beneficial following mild repetitive traumatic brain injury depending on timing of activation[J]. Brain Behav Immun, 2017, 64: 124-139.
[26]Wu D, Zhang X, Zhao M,et al. The role of the TLR4/NF-κB signaling pathway in Aβ accumulation in primary hippocampal neurons[J]. Acta Physiologica Sinica, 2015, 67(3): 319-328. [吴丹, 张弦, 赵敏, 等. TLR4/NF-κB信号通路激活对大鼠海马神经元淀粉样β蛋白沉积的影响[J]. 生理学报, 2015, 67(3):319-328.]
[27]Basu S, Agarwal P, Anupurba S,et al. Elevated plasma and cerebrospinal fluid interleukin-1 beta and tumor necrosis factor-alpha concentration and combined outcome of death or abnormal neuroimaging in preterm neonates with early-onset clinical sepsis[J]. J Perinatol Off J Calif Perinat Assoc, 2015,35(10): 855-861.
[28]Zhang X, Wang J, Qian W,et al. Dexmedetomidine inhibits tumor necrosis factor-alpha and interleukin 6 in lipopolysaccharidestimulated astrocytes by suppression of c-Jun N-terminal kinases[J]. Inflammation, 2014, 37(3): 942-949.
