基于α-葡萄糖苷酶抑制率的桦褐孔菌多糖提取工艺优化
2018-05-10王昭润荣瑞芬吴晓彤
王昭润,刘 萍,荣瑞芬,吴晓彤*
(1.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010020;2.中国农业大学 食品科学与营养工程学院,北京 100083;3.北京联合大学 生物化学工程学院,北京 100023)
桦褐孔菌(Inonotus obliquus)又称白桦茸,是生长在白桦树上的真菌,主要分布在北纬45~50°的地区(如北美北部,芬兰,俄罗斯,中国黑龙江、吉林省长白山地区等[1])。其是一种食药型真菌[2],16世纪东欧一些国家的民间就用这种菌的菌核来防治癌症[3],俄罗斯Komsomlshi制药公司发现桦褐孔菌精粉对糖尿病的治愈率为93%[4]。随着对桦褐孔菌化学成分研究的不断深入,发现桦褐孔菌含有多种具有生物活性的成分(如多糖、三萜类化合物、木脂素、桦褐孔菌醇、黑色素等[5-6]),其中桦褐孔菌多糖是中药多糖的一种,几乎无毒副作用[7],因具有抗肿瘤、抗氧化、免疫调节[8-12]等多种生物活性而受到广泛研究,但前人对桦褐孔菌多糖降血糖活性研究较少,本实验室前期研究发现,桦褐孔菌多糖具有α-葡萄糖苷酶抑制活性,α-葡萄糖苷酶抑制率可作为降血糖的活性考察指标。目前真菌多糖的提取方法主要有热水浸提法、碱提法、酸提法、酶提法、超声波辅助提取法和微波辅助提取法等[15]。在桦褐孔菌多糖的提取中,通常以多糖提取率为考察指标[16-18],而忽略了对多糖生物活性的评价,这可能会影响高活性多糖的提取。响应面优化法(response surface methodology,RSM)是通过合理的试验设计拟合因素与响应值之间的函数关系,以寻求最优工艺参数[19]。目前该方法已被广泛地应用于食品、化学、药学等领域[20-22]。为了获得具有高α-葡萄糖苷酶抑制率的桦褐孔菌多糖,本试验以桦褐孔菌多糖的α-葡萄糖苷酶抑制率及提取率为评价指标,在单因素试验基础上,采用响应面试验法对桦褐孔菌多糖的提取条件进行优化。以期为桦褐孔菌多糖的进一步开发利用提供一定的基础。
1 材料与方法
1.1 材料与试剂
桦褐孔菌:大兴安岭品味食品有限公司,粉碎后过40目筛,阴凉干燥处保存待用;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside,pNPG):美国Sigma公司;96孔酶标板:美国Corning公司;透析袋(截留分子质量3 500 Da,50 mm×5 m):北京经科宏达生物技术有限公司;层析柱(2.6 cm×25 cm):上海华美实验仪器厂。
1.2 仪器与设备
TGL-16C离心机:上海安亭科学仪器厂;TU-1810紫外分光光度计:上海棱光科技有限公司;BT-200B真空泵:郑州恒岩仪器有限公司;M200 pro多功能酶标仪:Tecan集团奥地利有限公司;N-1000-VN旋转蒸发仪:郑州恒岩仪器有限公司。
1.3 方法
1.3.1 多糖的提取
称取5 g桦褐孔菌子实体粉末,按照一定的料液比加入去离子水,在一定的温度条件下水提,提取完成后,取混合溶液离心(10 min、4 000 r/min),收集上清液,在60℃条件下,旋转蒸发至适当体积,加入无水乙醇,4℃过夜醇沉后8 000 r/min离心10 min,收集沉淀,于烘箱中50℃干燥,至质量恒定即得水提多糖。
1.3.2 单因素试验
在提取温度90℃,提取时间为4h,料液比为1∶25(g∶mL),醇沉倍数为3倍的条件下,固定其他3因素,分别考察不同提取温度(30℃、50℃、70℃、90℃、95℃),提取时间(2 h、3 h、4 h、5 h、6 h),料液比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g∶mL)),醇沉倍数(2、3、4、5)对高活性多糖提取工艺的影响。
1.3.3 响应面优化试验设计
在单因素试验结果的基础上,采用Design Expert 8.0.5中的Box-Benhnken中心组合设计法,选择提取温度(A)、提取时间(B)和提取料液比(C)3个因素,进行3因素3水平分析试验。以多糖提取率(Y1)和α-葡萄糖苷酶抑制率(Y2)为响应值,每个试验组合重复3次,优化多糖提取工艺,响应面试验因素与水平如表1。
1.3.4 测定方法
总糖的测定:按照参考文献[23]的方法测定样品总糖含量。
粗多糖提取率的测定:紫外分光光度计测定波长485nm处的吸光度值,从标准曲线上查得相应含量,计算粗多糖含量。粗多糖提取率的计算公式如下:
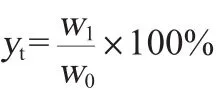
式中:yt为粗多糖的提取率,%;w0为桦褐孔菌的质量,g;w1为测定多糖的质量,g。
α-葡萄糖苷酶抑制率的测定:参照参考文献[24]的方法略加修改,计算α-葡萄糖苷酶抑制率。
2 结果与分析
2.1 单因素试验
2.1.1 提取时间对多糖提取率和α-葡萄糖苷酶抑制率的影响
提取时间对多糖提取率和α-葡萄糖苷酶抑制率的影响见图1。由图1可知,多糖提取率和α-葡萄糖苷酶抑制率均随提取时间的延长而逐渐提高,提取3 h时,多糖提取率较高,为4.03%;3h后多糖提取率变化较小,保持在4.03%~4.09%;α-葡萄糖苷酶抑制率在提取3 h时迅速升高至85.73%,之后仍缓慢升高,提取5 h时达到最高为88.98%。当提取时间达到3 h以后,多糖提取率和粗多糖α-葡萄糖苷酶抑制率变化均较小,而随着提取时间的延长,其他小分子活性物质的含量也会相应提高,会降低多糖在溶液中的比例,增加后期多糖分离纯化的难度。因此选择提取时间3 h最为适宜。
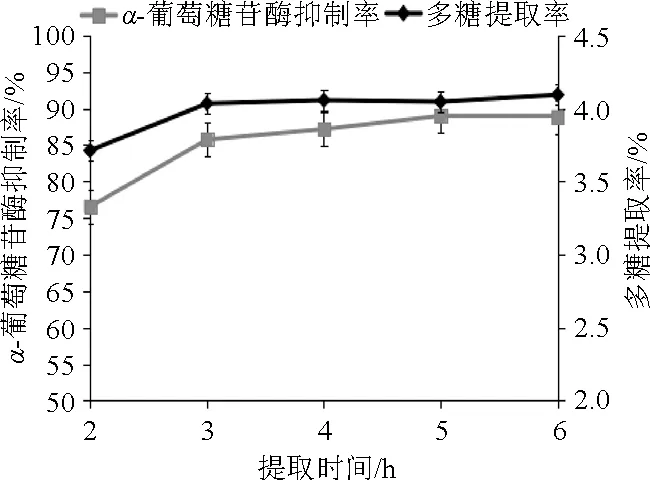
图1 提取时间对多糖提取率和α-葡萄糖苷酶抑制率的影响Fig.1 Effect of extraction time on the polysaccharide extraction rate andα-glucosidase inhibition rate
2.1.2 提取温度对多糖提取率和α-葡萄糖苷酶抑制率的影响
提取温度对多糖提取率和α-葡萄糖苷酶抑制率的影响见图2。

图2 提取温度对多糖提取率和α-葡萄糖苷酶抑制率的影响Fig.2 Effect of extraction temperature on the polysaccharide extraction rate andα-glucosidase inhibition rate
由图2可知,提取温度为30~90℃时,多糖提取率及α-葡萄糖苷酶抑制率均随温度的升高呈现快速升高趋势。提取温度为90℃时多糖提取率及α-葡萄糖苷酶抑制率分别为4.41%和86.73%;提取温度高于90℃之后,多糖提取率略微下降,α-葡萄糖苷酶抑制率变化不大。因此选择提取温度90℃最为适宜。
2.1.3 料液比对多糖提取率和α-葡萄糖苷酶抑制率的影响
提取过程中料液比对多糖提取率和α-葡萄糖苷酶抑制率的影响见图3。由图3可知,料液比为1∶15~1∶40(g∶mL)时,随着提取溶剂量增加,多糖提取率逐渐增加,料液比为1∶30(g∶mL)时,多糖提取率最高,为4.02%;料液比>1∶30(g∶mL)后提取率不再增加,表明多糖提取完全。提取料液比对α-葡萄糖苷酶抑制率影响作用并不明显,基本保持在80%左右。由此判断,多糖提取率与多糖活性之间并非存在正比关系,单一以多糖提取率为指标研究提取工艺存在一定的局限性,同时以多糖活性为多糖提取工艺考察指标,更具有全面性和有效性。因此选择提取料液比为1∶30(g∶mL)最为适宜。
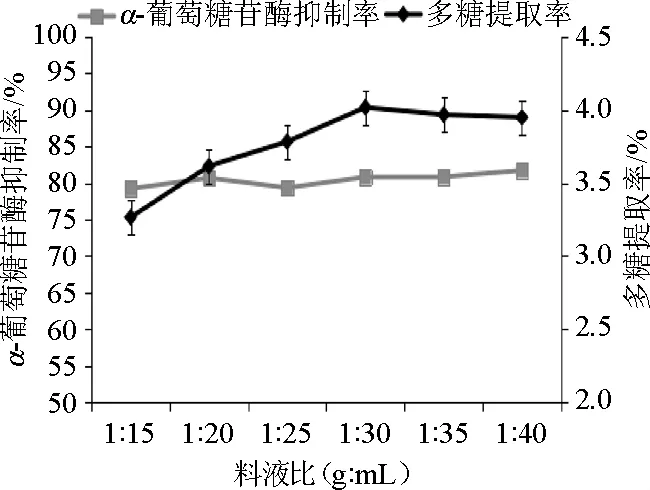
图3 料液比对多糖提取率和α-葡萄糖苷酶抑制率的影响Fig.3 Effect of solid-liquid ratio on the polysaccharide extraction rate andα-glucosidase inhibition rate
2.1.4 醇沉倍数对多糖提取率和α-葡萄糖苷酶抑制率的影响

图4 醇沉倍数对多糖提取率和α-葡萄糖苷酶抑制率的影响Fig.4 Effect of alcohol precipitation multiple on the polysaccharide extraction rate andα-glucosidase inhibition rate
提取过程中醇沉倍数对多糖提取率和粗多糖α-葡萄糖苷酶抑制率的影响见图4。由图4可知,随着醇沉倍数增加,多糖提取率有所增加,而α-葡萄糖苷酶抑制率略有下降趋势,但变化幅度都不大,多糖提取率在3.5%~4.0%,α-葡萄糖苷酶抑制率在80%~85%。醇沉倍数为3倍时,多糖提取率最高,但此时α-葡萄糖苷酶抑制率较醇沉倍数为2倍时低,醇沉倍数增加,能获得更多的多糖,但不一定是具备α-葡萄糖苷酶抑制活性的多糖,同时推测具备α-葡萄糖苷酶抑制活性的多糖对醇溶液浓度有选择性。因此选定醇沉倍数为2倍最为适宜。
2.2 响应面结果分析
2.2.1 响应面优化提取桦褐孔菌多糖工艺
在单因素试验结果的基础上,以提取温度(A)、提取时间(B)和提取料液比(C)为自变量,固定醇沉倍数为2倍,以多糖提取率(Y1)和α-葡萄糖苷酶抑制率(Y2)为响应值进行3因素3水平分析试验。试验共有17组,试验设计及结果如表3所示。
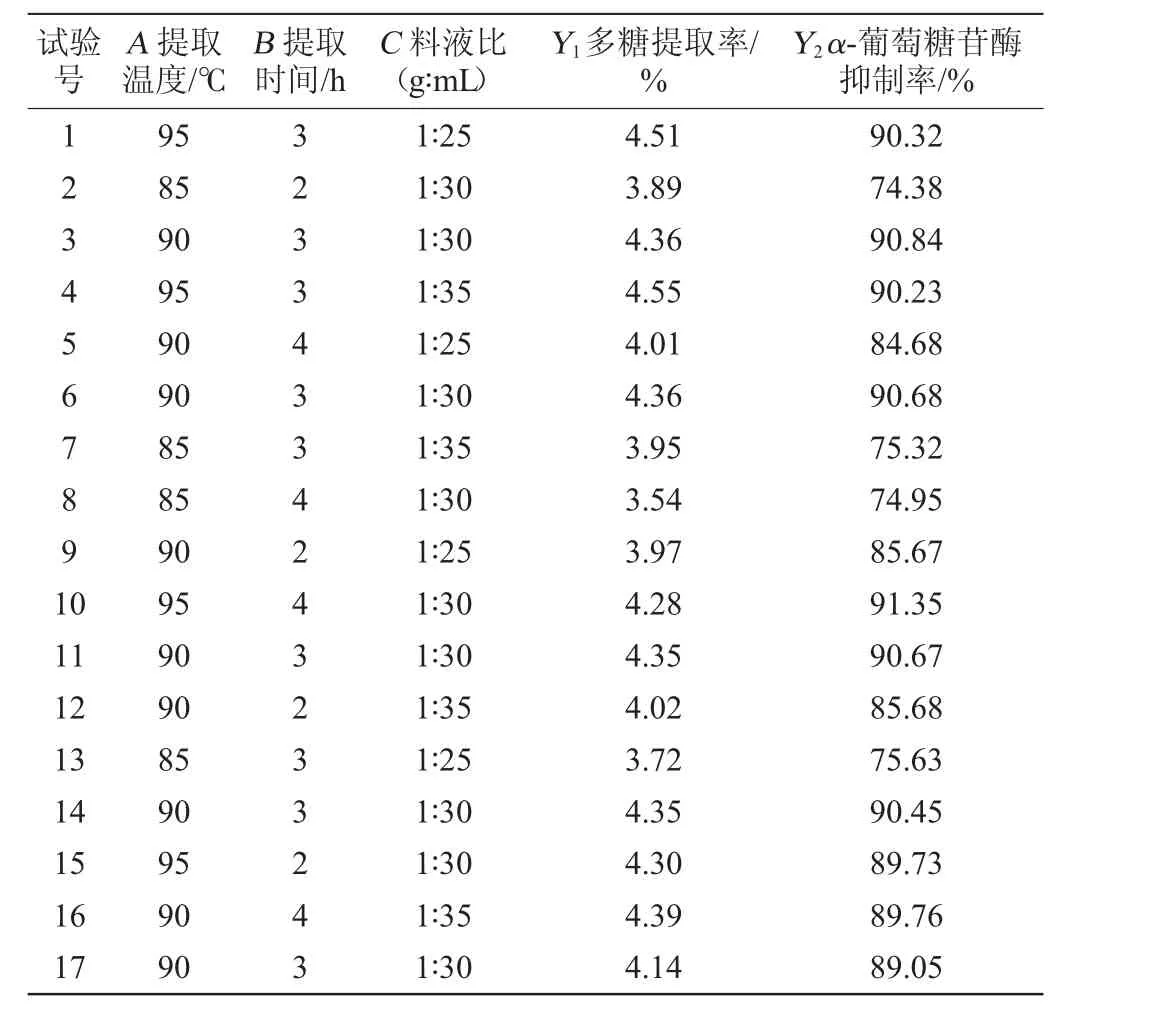
表3 多糖提取工艺优化响应面试验设计与结果Table 3 Design and results of response surface experiments for polysaccharide extraction process optimization
2.2.2 多糖提取率和α-葡萄糖苷酶抑制率回归模型的建立及显著性检验
对表3的数据进行回归分析,得到多糖提取率(Y1)和α-葡萄糖苷酶抑制率(Y2)的回归模型:
Y1=4.31+0.32A+0.005 25B+0.087C+0.083AB-0.048AC+0.083BC-0.11A2-0.2B2-0.017C2
Y2=90.34+7.67A+0.66B+0.59C+0.26AB+0.055AC+1.27BC-5.65A2-2.08B2-1.81C2
回归方程的方差分析见表4、表5。从表4可以看出,多糖提取率Y1回归模型极显著(P<0.01),失拟项不显著(P>0.05),说明该模型可以拟合试验结果。决定系数R2=0.9041,说明模型响应值的变化有90.41%来自所选因变量,因此,该回归方程可以描述各因素对多糖提取率的影响。该模型一次项A影响极显著(P<0.01)。

表4 回归模型的方差分析Table 4 Variance analysis of regression model
从表5可以看出,α-葡萄糖苷酶抑制率Y2模型极显著(P<0.01)。Y2模型失拟项不显著(P>0.05),该模型选择合适。Y2模型的校正决定系数R2为0.990 1,说明模型响应值的变化有99.01%来自所选因变量,进一步说明模型拟合优度较好。因此该回归方程可以描述各因素对α-葡萄糖苷酶抑制率的影响。该模型一次项A,二次项A2、B2、C2影响极显著(P<0.01),交互项BC影响显著(P<0.05)。
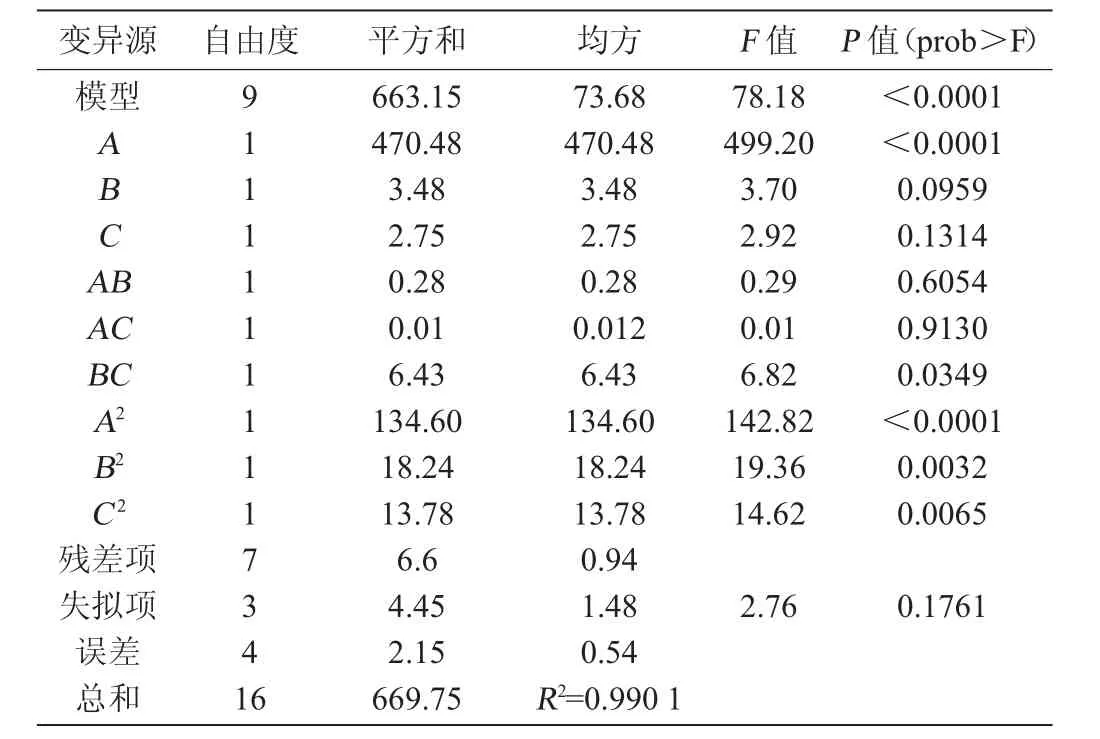
表5 α-葡萄糖苷酶抑制率回归模型的方差分析Table 5 Variance analysis of regression model forα-glucosidase inhibition rate
2.2.3 响应曲面图分析
响应值Y1和Y2与3个因素A、B、C构成的三维空间响应面图见图5~图6。
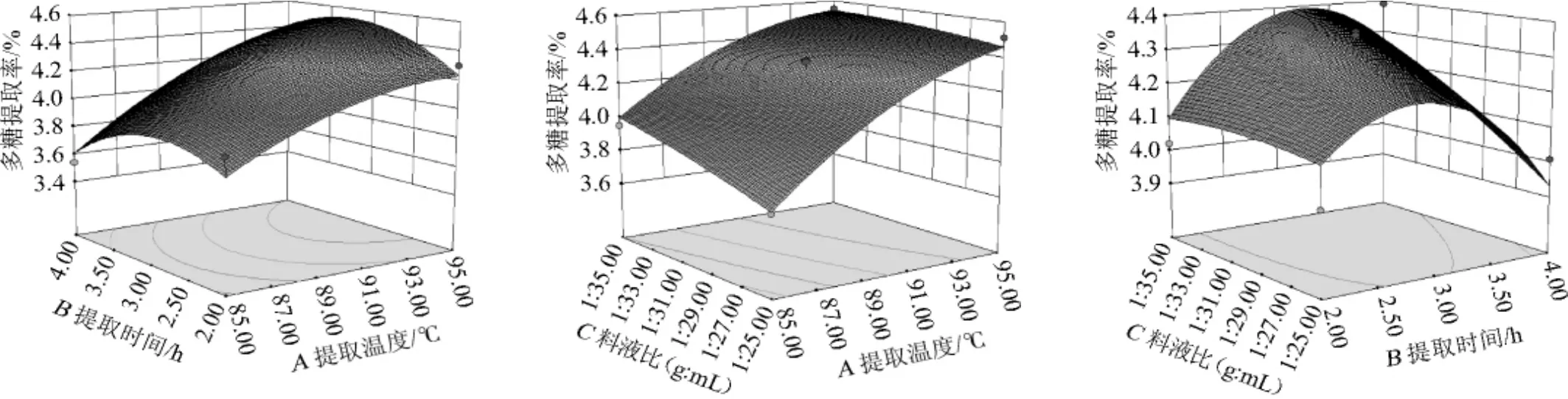
图5 提取温度、提取时间和料液比交互作用对多糖提取率影响的响应曲面与等高线Fig.5 Response surface plots and contour line of the effects of interaction between extraction temperature,time and solid-liquid ratio on polysaccharide extraction rate
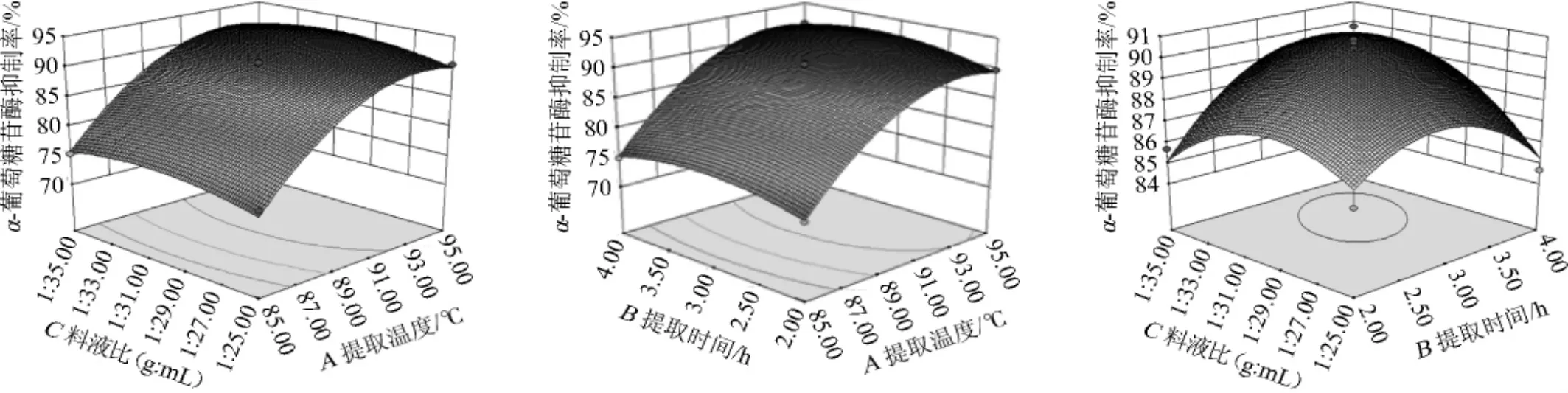
图6 提取温度、提取时间和料液比交互作用对α-葡萄糖苷酶抑制率影响的响应曲面及等高线Fig.6 Response surface plots and contour line of the effects of interaction between extraction temperature,time and solid-liquid ratio on α-glucosidase inhibition rate
由图5可知,提取温度对多糖提取率影响显著,随着提取温度的升高,多糖提取率上升趋势逐渐变缓,而随着提取时间的延长,多糖提取率先上升后保持稳定;多糖提取率随着提取料液比和提取温度的增加(升高)而不断增加,其中提取温度的影响更为显著;提取时间对多糖提取率的影响比提取料液比显著,因为前者的变化趋势更为明显。多糖提取率随提取时间的增加先上升后下降,并且当提取料液比越大时,这种趋势越明显。
由图6可知,α-葡萄糖苷酶抑制率随提取温度的升高而不断增加,随提取料液比的变化α-葡萄糖苷酶抑制率变化不明显。这与单因素试验结果一致;提取温度对α-葡萄糖苷酶抑制率影响显著,随着提取温度的升高,α-葡萄糖苷酶抑制率先上升后保持稳定,而提取时间对α-葡萄糖苷酶抑制率影响较低;α-葡萄糖苷酶抑制率随着提取时间和提取料液比的增加呈现先上升后下降的变化趋势,当提取时间为3 h,提取料液比为1∶30(g∶mL)时,有最大的α-葡萄糖苷酶抑制率。
2.2.4 响应面优化结果验证
结合实际情况与响应面优化所得最佳条件,确定提取时间为3.5 h,提取温度为95℃,提取料液比为1∶30(g∶mL),在此条件下进行多糖提取,并对多糖提取率和单位浓度多糖的α-葡萄糖苷酶抑制率进行测定,在此条件下,3次多糖提取率平均值为4.61%,α-葡萄糖苷酶抑制率平均值为92.34%,与理论值相差1.5%和0.47%,因此,响应面法所得桦褐孔菌多糖提取条件的回归方程模型是可行的,具有实际应用价值。
3 结论
本研究以α-葡萄糖苷酶抑制率和多糖提取率为考察指标,在单因素试验的基础上,通过响应面分析法优化多糖提取工艺,得出高活性桦褐孔菌多糖的最佳提取工艺为提取温度95 ℃,提取时间3.5 h、提取料液比1∶30(g∶mL),醇沉倍数2倍,在此条件下,多糖提取率为4.61%,α-葡萄糖苷酶抑制率为92.34%,
参考文献:
[1]FAN L,DINGS,AIL,et al.Antitumor and immunomodulatory activity of water-soluble polysaccharide from Inonotus obliquus[J].Carbohyd polym,2012,90(2):870-874.
[2]黄纪国,吕 静,余雄涛,等.桦褐孔菌抗病毒活性成分的分离及结构鉴定[J].现代食品科技,2015(4):175-180.
[3]LIU Y Q,BAOH Y.Chemical components and pharmacological actions of Inonotusobliquus[J].Edible Fungi of China,2008.
[4]黄年来.俄罗斯神秘的民间药用真菌——桦褐孔菌[J].中国食用菌,2002,21(4):7-8.
[5]李喜范,李 军,刘 鑫,等.桦褐孔菌的药用价值及人工段木培养技术[J].食药用菌,2014(2):99-101.
[6]ZHANGX,ZHAOFQ,HAN G,et al.Chemical constituentsand anti-inflammatory activitiesof Inonotusobliquus[J].Nat Product Res Develop,2010,22(3):433-436.
[7]刘向辉,谢人明,陈 琳,等.桦褐孔菌不同提取物小鼠急性毒性实验研究[J].中国药物警戒,2013,10(7):390-392.
[8]陈义勇,黄友如,刘晶晶,等.桦褐孔菌多糖IOP3a体内抗肿瘤活性及其机制[J].食品与生物技术学报,2013,32(9):983-988.
[9]ZHAO F,MAIQ,MA J,et al.Triterpenoids from Inonotus obliquus and their antitumor activities[J].Fitoterapia,2015,101:34-40.
首先,应当以学校为主体创设综合信息管理平台,以便依托该信息平台实现家校共育。同时,在该平台的建设过程之中,必须引入外部评价机制,改变以往的校内单一评价模式,依托现代通讯技术搭建家庭教育同学校教育之间的沟通桥梁。
[10]CHEN Y,GU X,HUANGS,et al.Optimization of ultrasonic/microwave assisted extraction(UMAE)of polysaccharides from Inonotus obliquus and evaluation of its anti-tumor activities[J].Inte J Biol Macromol,2010,46(4):429-435.
[11]HUANG S,DING S,FAN L.Antioxidant activities of five polysaccharidesfrom Inonotusobliquus[J].Int J Biol Macromol,2012,50(5):1183-1187.
[12]DU X J,MU H M,ZHOU S,et al.Chemical analysis and antioxidant activity of polysaccharides extracted from Inonotus obliquus sclerotia[J].Int J Biol Macromol,2013,62:691-696.
[13]尹红力,赵 鑫,佟丽丽,等.黑木耳多糖体外和体内降血糖功能[J].食品科学,2015,36(21):221-226.
[15]阿 燕.真菌胞内多糖提取方法的研究进展[J].微生物学杂志,2011,31(5):82-86.
[16]荣芳悦,张 宇,赵 宏,等.基于响应面法的闪式提取桦褐孔菌多糖工艺优化[J].食品工业科技,2016,37(8):286-289.
[17]高 娃,于德水,刘佳宁,等.桦褐孔菌子实体多糖提取研究[J].生物技术,2012(2):70-73.
[18]玄光善,王艳波,王延龙.纤维素酶辅助提取桦褐孔菌多糖的研究[J].中南药学,2014,12(7):657-660.
[19]吴雪艳,罗 鹏,叶建方,等.响应面法优化竹荪菌托多糖的提取工艺[J].南方农业学报,2015,46(3):480-485.
[20]万 阅,齐计英,曾 红,等.响应面法优化香菇多糖的超声辅助提取工艺[J].生物技术通报,2015,31(1):79-85.
[21]卢 静,陈旻骁,凌玮诗,等.响应面法优化林蛙干皮胶原蛋白提取工艺[J].食品科技,2016(2):270-275.
[22]陈红梅,谢 翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J].食品科学,2016,37(2):45-50.
[23]王娅玲,李维峰,郭 芬,等.微波辅助提取菱红菇多糖及抗氧化活性研究[J].食品工业科技,2015,36(9):251-254.
[24]KIM JS,HYUN T K,KIM M J.The inhibitory effects of ethanol extracts from sorghum,foxtail millet and proso millet onα-glucosidase and α-amylaseactivities[J].Food Chem,2011,124(4):1647-1651.
