新疆阿克苏地区牛传染性鼻气管炎病毒与牛副流感病毒3型感染的检测
2018-05-10廉德平倪宏斌剡根强
廉德平,倪宏斌,凌 晨,张 坤,剡根强
(1.新疆阿拉尔新农乳业有限责任公司,新疆 阿拉尔 843300;2.石河子大学动物科技学院,新疆 石河子 832003)
牛传染性鼻气管炎(IBR)又称“红鼻病”或“坏死性鼻炎”,病原为牛传染性鼻气管炎病毒(IBRV),属于疱疹病毒科(Herpesviridae)疱疹病毒亚科(Alphaher pesviridae)水痘病毒属(Varicellovirus)。自1956年 Madin等[1]首次从患牛中分离IBRV以来,美国、澳大利亚、新西兰、俄罗斯、墨西哥等国家相继出现IBRV感染的报道;我国于20世纪70年代从荷兰进口牛中发现该病,20世纪80年代初由周泰冲等[2]首次从新西兰进口的奶牛中分离到IBRV,颜邦芬[3]、邹世颖[4]等的调查表明,我国大部分地区都已存在IBRV感染;目前只有瑞典、丹麦、芬兰、奥地利等极少数国家没有IBRV感染或者已宣布成功消除该病[5-6],世界动物卫生组织(OIE)将该病列为 B类疾病[7]。临床感染表现为流鼻涕、呼吸困难、上呼吸道及气管黏膜发炎等症状,还可引起牛的结膜炎、乳腺炎、幼牛脑膜炎、脓疱性外阴-阴道炎、龟头炎、流产等疾病。IBRV可在牛体内长期存在甚至终身带毒,从而造成牛的持续性感染,对奶牛的产奶量、育肥牛的增重、使役牛的使役力及公牛的繁殖力均有较大影响;继发细菌与支原体感染可引起牛的支气管炎和/或肺炎,治疗不及时往往导致牛的死亡,大大增高了牛群的淘汰率和死亡率。现在没有治疗IBR的特效药物,国内也没有有效的上市疫苗。
牛副流感是由牛副流感病毒3型(Bovine parainfluenza virus 3,BPIV-3)引起的一种热性接触性传染病。BPIV-3属于单股负链RNA病毒目副黏病毒科副黏病毒亚科呼吸道病毒属,又被称为运输热病毒。自1959年Reisinger[8]等首次在美国分离到BPIV-3以来,法国、日本、前苏联、澳大利亚、加拿大、丹麦、巴拿马和意大利等国家也相继出现该病毒感染的报道[9];我国在近期才开始研究该病毒,根据最近几年的文献报道,BPIV-3己经在我国内蒙古、黑龙江、吉林、山东、山西和新疆等地存在[10-11]。临床感染表现从无明显的临床症状到严重的呼吸道疾病:大部分感染BPIV-3的牛仅表现出流鼻涕、咳嗽、发热等症状;但某些存在应激的牛则表现出严重的组织损伤和免疫抑制,继发细菌感染则表现为肺炎以及肺部、胸腔的出血性败血症;并且该病毒常与牛呼吸道合胞体病毒混合感染,使病情更加复杂[12]。目前该病在世界范围内流行,尤其是美洲和亚洲,每年都给养牛业造成严重的经济损失[13]。我国对该病的研究较少,也没有相关有效的疫苗。
为了调查阿克苏地区是否存在IBRV和BPIV-3的感染,本试验从该地区两个规模化奶牛场采集18份可疑发病犊牛鼻液样品,通过采用双抗体夹心ELISA、PCR、RT-PCR的方法来检测两种病毒,为两种疫病的防控提供理论基础。
1 材料与方法
1.1 样品 于2015年2月从阿克苏两个规模化奶牛场采集1月龄以内表现呼吸道症状的犊牛鼻液样品18份,其中A场11份,B场7份,保存于-80℃低温冰箱备用。
1.2 主要试剂 IBRV、BPIV-3抗原双抗体夹心ELISA试剂盒(TSZ)。购自上海酶联生物科技有限公司;病毒DNA提取试剂盒(Cat:9766)、反转录试剂盒,购自TaKaRa公司;TRIZol购自美国Invitrogen生命技术有限公司;引物合成于北京华大基因科技有限公司;PCR MIX、DNA Marker,购自广州东盛生物科技有限公司。
1.3 方法
1.3.1 样品处理 将样品从-80℃低温冰箱取出,置于4℃冰箱融化。向装有采样棉签的5 mL冻存管中加2 mL的生理盐水,充分振荡摇匀,使棉签上的鼻液完全溶解,吸取1.2 mL的鼻液悬液于
1.5 mL的离心管中,10 000 r/min(4℃)离心 15 min,取全部上清液,经 0.22 μm 微孔滤膜过滤,得到待分离病毒样品,-80℃保存备用。
1.3.2 抗原ELISA检测 采用商品化牛传染性鼻气管炎病毒与牛副流感病毒3型抗原双抗体夹心ELISA试剂盒,按照试剂盒说明书进行具体操作。
1.3.3 IBRV PCR检测
1.3.3.1 病毒DNA提取 将处理好的病毒样品从-80℃低温冰箱取出,置于4℃冰箱融化。IBRV DNA使用TaKaRa公司病毒提取试剂盒(Cat:9766)提取。(1)取200 μL处理过的样品溶液装于1.5 mL 的 EP 管中,加入 200 μL Buffer VGB、20 μL Proteinase K 和1.0 μL Carrier RNA,充分混匀后,放入56℃水浴锅温浴反应10 min;(2)加入200 μL无水乙醇,用移液枪充分吸打均匀;(3)将Spin Column安置于 Collection Tube上,溶液移至 Spin Column中,12 000 r/min离心2 min,弃滤液;(4)将500 μL的Buffer RWA加入至Spin Column中,12 000 r/min离心1 min,弃滤液;(5)将700 μL的Buffer RWB沿管壁加入至Spin Column中,12000 r/min离心1 min,弃滤液;(6)重复步骤(5);(7)将Spin Column安置于Collection Tube上,12000 r/min离心2 min;(8)将Spin Column安置于新的1.5 mL Rnase free collection tube上,再向Spin Column膜的中央加入30~50 μL的Rnase free dH2O,室温静置5 min;(9)12 000 r/min离心2 min洗脱DNA,即得到病毒DNA。
1.3.3.2 引物合成 参考倪宏斌等设计的IBRV gD基因引物合成一对检测引物,上游:5′-ACTGAACGCTGGCACACTAC-3′,下游:5′-TAGCCCTTCGACTCCTCAAA-3′,预期扩增片段大小为671 bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.3.3 gD基因的PCR扩增 PCR反应组分:PCR Mix 10 μL,上、下游引物各 0.5 μL,模板 3 μL,ddH2O补至25 μL。PCR扩增条件为:预变性95℃5 min,变性94℃ 45 s,退火58℃ 45 s,延伸 72℃1 min,35个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析。
1.3.4 BPIV3 RT-PCR检测
1.3.4.1 总RNA提取 使用TRIZol对全部处理过的样品提取病毒总RNA。(1)取200 μL样品上清液加入到经1‰DEPC水浸泡且高压灭菌过的1.5 mL离心管中,加入1 mL TRIZol,充分振荡混匀,冰上放置15 min;(2)加入200 μL氯仿,混匀,冰上放置8 min,12 000 r/min(4℃)离心15 min;(3)将离心产生的上清液全部用移液枪移入一新的1.5 mL离心管内(注意不要吸到沉淀),体积的异丙醇加入到离心管中,冰上放置20 min,12 000 r/min(4℃)离心15 min,弃上清,超净台内干燥20 min;(4)沿管壁加入75%DEPC水乙醇1 mL,7 500 r/min(4℃)离心5 min,弃乙醇;超净台中干燥30 min;(5)向离心管中加入15 μL DEPC水,溶解后即得到病毒RNA,-40℃冻存备用或直接用反转录。
1.3.4.2 反转录 使用TaKaRa反转录试剂盒,具体操作如下:(1)DNA的除去反应,反应组分见表1。
(2)反转录反应,反应组分见表2。

表2 反转录反应组分
(3)85℃瞬时热激5 s即得到反转录产品。
1.3.4.3 引物合成 参考倪宏斌等设计的BPIV-3 gM基因引物合成一对检测引物,上游:5′-TGATGATGCCCATATAACCAGA-3′, 下 游:5′-ATTCAAAATCCCCAAGTCCA-3′,预期扩增片段大小为394 bp。引物由上海生工生物工程技术服务有限公司合成。
1.3.4.4 gM基因的PCR扩增 反应组分:PCR Mix 10 μL,上、下游引物各 0.5 μL,模板 3 μL,ddH2O补至25 μL。扩增条件为:预变性 95℃ 5 min,变性94℃ 30 s,退火56.6℃ 30 s,延伸72℃45 s,35个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析。
2 结果
2.1 ELISA检测结果 使用IBRV抗原双抗体夹心ELISA方法检测出4份阳性样品,检出率为22.23%,使用BPIV-3抗原双抗体夹心ELISA方法未检测出BPIV-3。
2.2 IBRV PCR检测结果 将采集的样品经PCR扩增可得到预期671 bp大小的基因片段,见图1。PCR方法检测出13份阳性样品,其中A场8份,B场5份,总检出率为72.22%。

图1 PCR检测结果
2.3 BPIV-3 RT-PCR检测结果 将采集的样品经RT-PCR检测,可扩增得到预期394 bp大小的基因片段,见图2.RT-PCR方法检测出8份阳性样品,检出率为44.44%;其中4份同时检测出IBRV,检出率为22.22%。
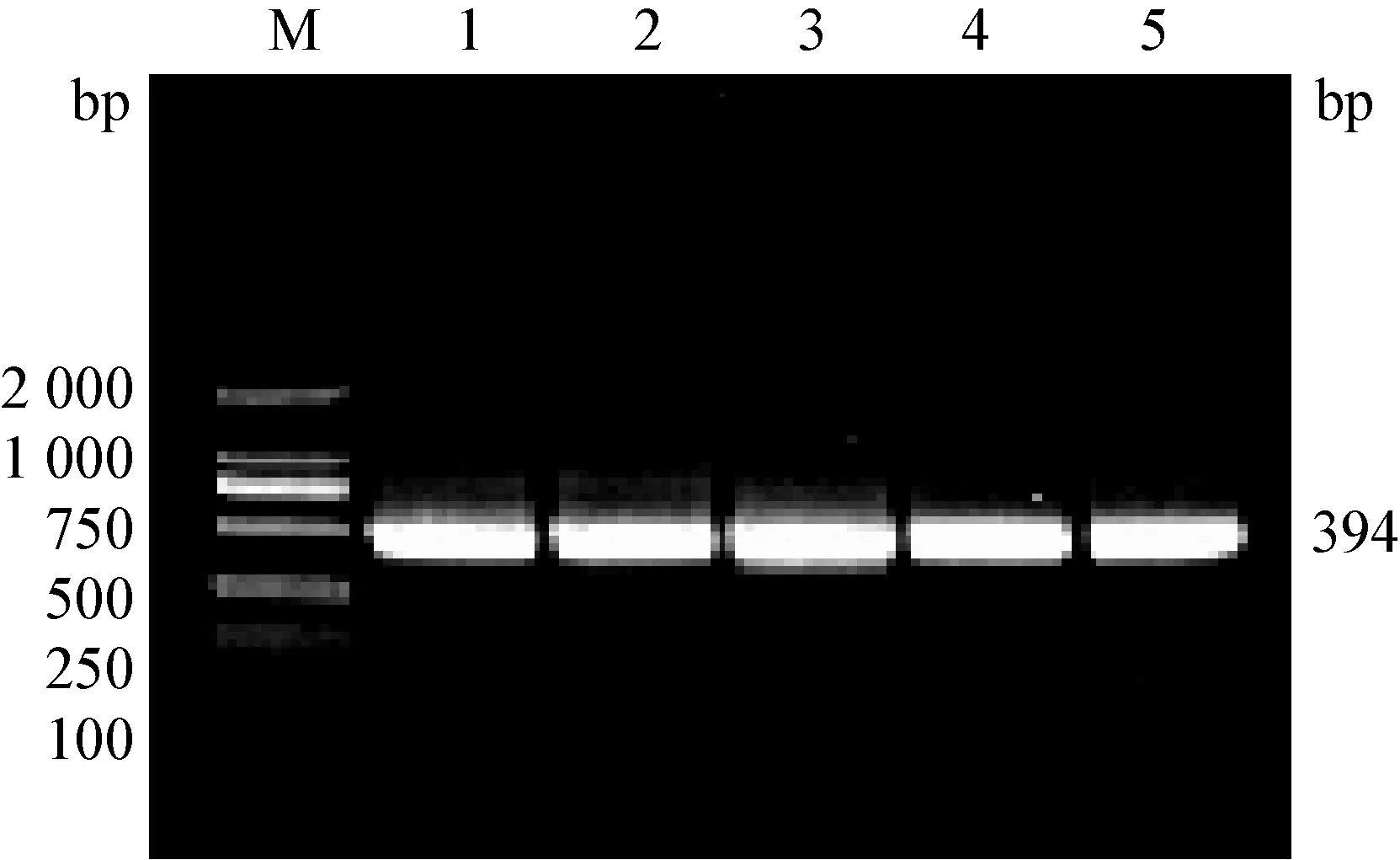
图2 RT-PCR检测结果
3 讨论
3.1 阿克苏市周边地区是南疆奶牛规模化养殖最集中的地区,约有3万余头荷斯坦奶牛,本次调查仅对两个奶牛场具有呼吸道症状的犊牛鼻拭子进行了IBRV和BPIV-3检测,结果显示,PCR方法检测 IBRV,检出13份阳性样品,感染率为72.22%;RT-PCR检测BPIV-3,检出8份阳性样品,感染率为44.44%。说明在阿克苏地区存在IBRV和BPIV-3的感染,且IBRV的感染率较高,两个牛场均检出较多的阳性样本,提示该地区牛场应实施IBRV疫苗的免疫接种,以有效控制该病的发生及扩散。
3.2 18份样品中有4份样品同时检测出IBRV和BPIV-3,说明在阿克苏地区存在IBRV和BPIV-3的混合感染,感染率为22.22%。
3.3 抗原双抗体夹心ELISA方法,IBRV的检出率为22.22%,BPIV-3的检出率为0%,远低于PCR与RT-PCR方法的检出率,说明检测牛鼻液中的两种病毒,使用PCR与RT-PCR方法更合适。这种检测差异同Socha W.和Rola J.等报道的一致[14]。
参考文献:
[1] Madn S H,York C J,Mckercher D G.Isolation of infectious bovine rhinotracheitis virus[J].Science,1956,124:721-722.
[2] 周泰冲.从新西兰进口奶牛中分离牛传染性鼻气管炎病毒[J].中国兽医科技,1981,11(1)6-9.
[3] 颜邦芬,陈铮,张书环,等.牛传染性鼻气管炎病毒gG-蛋白的表达及gG-ELISA的建立[J].生物工程学报,2007,23(5):806-811.
[4] 邹世颖,何倩妮,刘蕾,等.中国北方六省份牛传染性鼻气管炎病毒流行病学分析[J].中国兽医杂志,2012,48(2):47-48.
[5] Madin S H,York C J,Mckercher D G.Isolation of the infectious bovine rhinotrach-eitis virus[J].Science,1956,124(3225):721-722.
[6] Zwart D.The virus of infectious bovine rhinotracheitis in Northern Nigeria[J].BμL-letin of epizootic diseases of Africa.BμLletin des epizooties en Afrique,1966,14(4):405-408.
[7] OIE.Manual of Standards for Diagnostic Tests and Vaccines for Terrestrial Anim-als[M/OL].http://www.oie.int/eng/normes/mmanual/a-00035.htm.
[8] Andrewes C H,Bang F B,Chanock R M,et al.Para-influenza viruses 1,2 and 3:suggested names for recently described myxoviruses[J].Virology,1959,8(1):129-130.
[9] Ellis J A.Bovine parainfluenza-3[J].Vet Clin North Am Food Anim Pract,2010,26(3):575-593.
[10] 刘鹏,侯喜林,周玉龙,等.牛副流感病毒3型的分离鉴定[J].微生物学通报,2009,36(9):1 384-1 389.
[11] 周玉龙,吴海涛,任亚超,等.牛副流感病毒3型的分离鉴定及感染牛抗体消长规律的研究[J].中国人兽共患病学报,2011,27(1):23-28.
[12] 高丰,贺文琦.动物疾病病理诊断学[M].北京:科学出版社,2010:281-283.
[13] Stott E J,Thomas L H,Collins A P,et al.Asurvey of virus infeetions of the respirat-ory tract of eattle and their association Withdisease[J].J Hyg(Lond),1980,85(2):257-270.
[14] Socha W,Rala J.Use of rapid human respiratory syncytial virus strip tests for detection of bovine respiratory syncytial virus in experimentally vaccinated calves[J].Polish Journal of Veterinary Sciences,2012,15(4):629-634.
