高效液相色普法测定兔灌胃后血清中百草枯浓度及其变化特征*
2018-05-10黄晓亮李映新凌家杰党毅刘金远姚佩珊颜池雷卓青
黄晓亮,李映新,凌家杰,党毅,刘金远,姚佩珊,颜池,雷卓青
(1.广西医科大学药学院,广西 南宁 530021;2.广西医科大学基础医学院,广西 南宁530021;3.广西医科大学全科学院,广西 南宁 530021;4.广西医科大学第二附属医院西院 急诊科,广西 南宁 530007)
百草枯(Paraquat PQ)为农业上广泛使用的除草剂,其有效的化学成分为1,1’-二甲基-4,4’-联吡啶二氯物,对人畜具有很强的毒性和腐蚀性,极容易通过皮肤、呼吸道、消化道吸收,由于操作不当造成的急性中毒事件屡有发生,目前尚无特效解毒剂,死亡率极高,口服中毒死亡率可高达90%左右[1-2]。国外有学者确证了血液、尿液中百草枯浓度与中毒预后的相关性[3]。贾丽君等[4]通过对88例患者临床资料回顾性分析也发现,服毒量、毒物血药浓度是决定预后的强危险因素,但未对中毒后不同时间所测的血药浓度进行对比。本文探索高效液相色谱法(high performance liquid chromatography,HPLC)测定新西兰家兔灌胃百草枯后其血清浓度的可行性,并观察在不同剂量百草枯灌胃后72 h内血药浓度的经时变化情况,为临床治疗百草枯中毒提供实验参考资料。
1 材料与方法
1.1 实验动物
普通级健康成年白色新西兰家兔12只,雄性,体重(2.5±0.5)kg,由广西医科大学实验动物中心提供。
1.2 仪器及试剂
岛津LC-20AB高效液相色谱仪(日本岛津公司),包含:SPD-20A紫外检测器,SIL-20AC自动进样器,SUS 20A混合器,CTO-20AC 柱温箱;超声清洗器(德国Bandel公司),高速冷冻离心机(德国Heraeus公司),电子分析天平(梅特勒-托利多204型)。百草枯对照品(纯度为99.4%,北京普天同创生物科技有限公司,批号20150629),乙腈(色谱纯,美国天地公司);三氟乙酸(色谱纯,美国Sigma公司),庚烷磺酸钠(Ultra pure上海源叶生物科技有限公司,批号T23M6C1),实验用水为娃哈哈纯净水。
1.3 HPLC检测方法的建立
1.3.1 对照品溶液配制 精密称取百草枯对照品适量于容量瓶中,加纯净水定容后混匀,得浓度为1.0 mg/ml的对照品溶液,储存于4℃冰箱中,使用前逐级稀释。
1.3.2 色谱条件 色谱柱:ZORBAX300SB-C18(250.0 mm×4.6 mm,5μm),流动相为0.1 mol/L磷酸缓冲液(含12.5 mmol/L庚烷磺酸钠)-乙腈(90︰10,TFA调pH=2.8);流速为1.0 ml/min;检测波长为258 nm;柱温为30℃。
1.3.3 样品处理 取血清样品5 000 r/min离心5 min,取上清液0.5 ml置试管中,加入0.5 ml乙腈,漩涡1 min,低温高速12 000 r/min离心5 min,取上清液于0.22μm滤膜过滤,20μl进样。
1.3.4 标准曲线 用空白血清分别配制0.195、0.391、0.781、1.563、3.125、6.250、12.500、25.000、50.000 及100.000 mg/L的百草枯血清标准系列液,分装后于-20℃保存备用。样品处理后测定各浓度的曲线下面积(A)。
1.3.5 专属性考察 分别取兔空白血清、兔空白血清+百草枯对照品溶液、待测兔血清按照上述样品处理方法进样,考察是否存在内源性物质干扰百草枯测定。
1.3.6 回收率考察 取兔空白血清,加入一定量百草枯对照品溶液,配制成浓度为0.50、5.00及50.00 mg/L的样品,样品处理后进行测定,按照标准曲线计算浓度与实际配制浓度比较,计算相对回收率。
取兔空白血清,加入一定量百草枯对照品溶液,配制成浓度为0.50、5.00及50.00 mg/L的样品,样品处理后进行测定,记录百草枯峰面积,作为百草枯血清峰面积。另取百草枯对照品溶液,配制0.5、5.0及50.0 mg/L 3个浓度,各取20μl进样,记录峰面积。计算百草枯血清峰面积和对照品溶液峰面积比值,作为绝对回收率。
1.3.7 精密度考察 取空白血清,加入一定量百草枯对照品溶液,配制成浓度为0.50、5.00及50.00 mg/L的样品,样品处理后进行测定,每个浓度平行测定6次,连续测定3 d,分别考察日内和日间精密度。
1.4 兔百草枯急性中毒模型的复制及血清药物浓度测定
12只新西兰家兔按照随机数字表法分为两组,每组6只,分别灌胃给予100 mg/kg(高剂量组)和20 mg/kg(低剂量组)百草枯,于药后1、2、5、12、24、48及72 h用不加抗凝剂的普通采血管通过中耳动脉采集血液。各管血液在室温放置3 h后收集血清,进行样品处理,所得峰面积代入标准曲线计算血清百草枯浓度。
1.5 统计学方法
数据分析采用PSAW Statistics 18.0统计软件,计量资料以均数±标准差(±s)表示,不同时间点的比较采用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 标准曲线
以百草枯浓度为横坐标,以峰面积为纵坐标,进行线性回归,得线性方程为Y=41 020X+25 621(r=0.999),表明百草枯在0.20~100.00 mg/L浓度范围内线性关系良好,最低检测限为0.2 mg/L。见图1。
2.2 专属性考察结果
实验结果表明,百草枯保留时间在6.5 min,血清的内源性物质对百草枯色谱峰无干扰,分离较好。见图2。
2.3 回收率考察结果
采用该法测定的相对回收率在97.82%~101.20%之间,绝对回收率在84.37%~88.80%之间。见表1。
2.4 精密度考察结果
采用该法测定的日内和日间精密度(RSD)均在5%以内,结果见表2。
2.5 不同剂量百草枯兔灌胃后其血清浓度的变化情况
无论是高剂量组还是低剂量组,百草枯通过胃肠吸收约2 h后,其血清中的药物浓度达到峰值,之后逐渐下降,其中,高剂量组于给药后72 h后检测不出,低剂量组于药后24 h检测不出;高剂量组(100 mg/kg)给药后5、12、24及48 h血清药物浓度分别下降至峰值的32.91%、11.06%、5.96%及2.98%,给药后72 h后检测不出百草枯;低剂量组(20 mg/kg)给药后5和12 h血清药物浓度分别下降至峰值的40.32%和11.83%,给药后24 h检测不出百草枯。见图3。
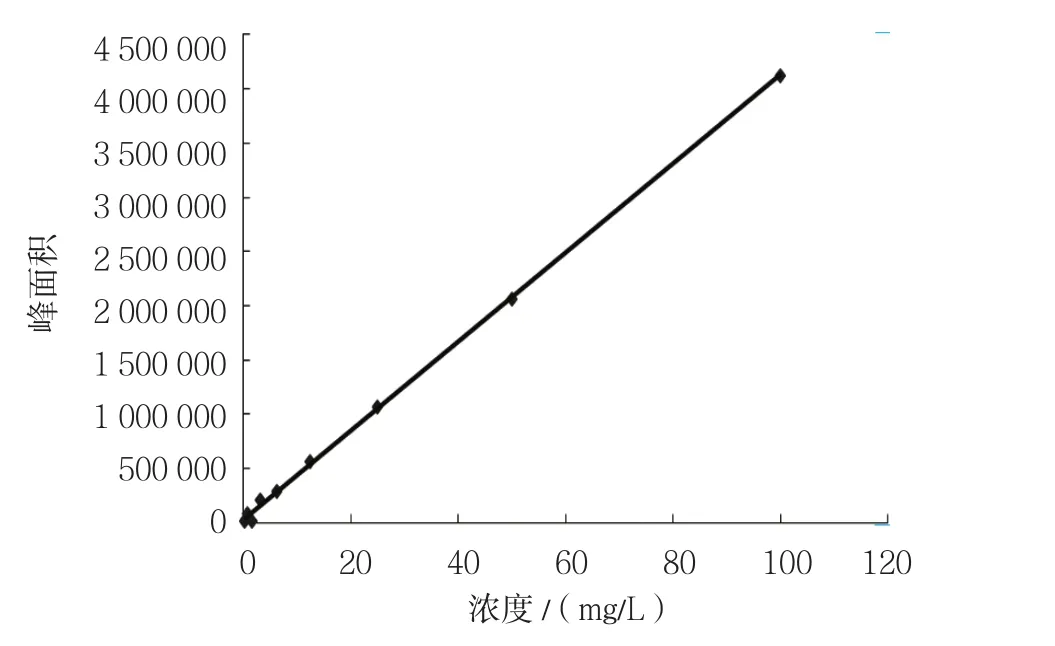
图1 血清百草枯标准曲线
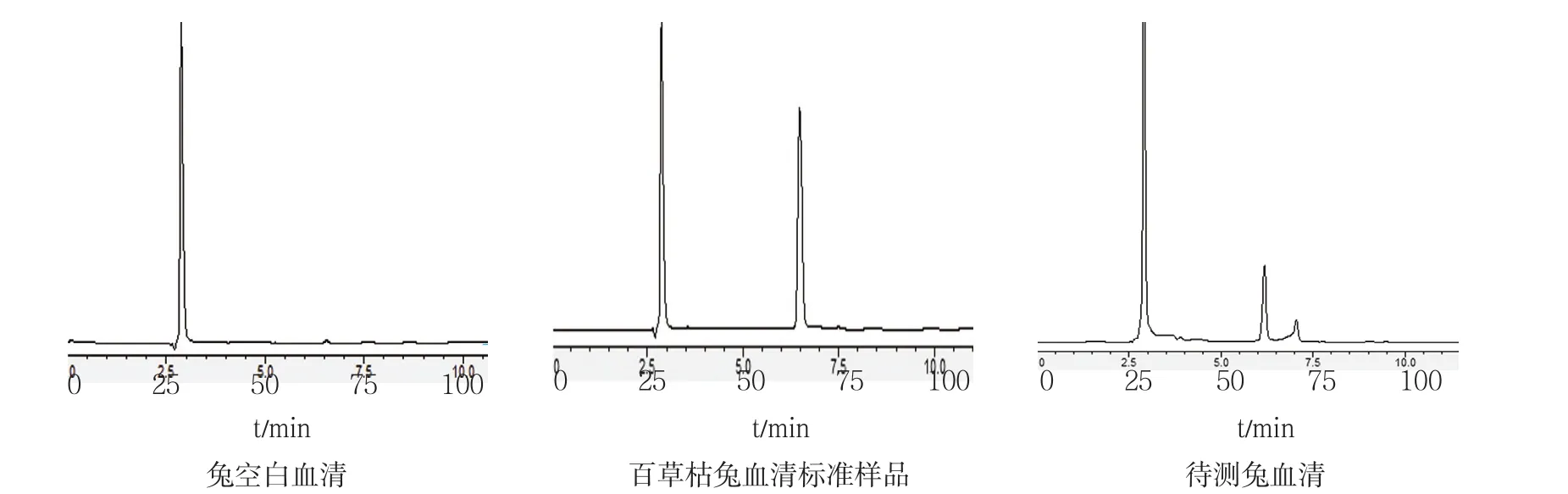
图2 兔血清中百草枯的HPLC图谱
结果显示,①不同时间点间的百草枯浓度差异有统计学意义(F=221.627,P=0.000);②高剂量组与低剂量组的百草枯浓度差异有统计学意义(F=133.618,P=0.000);③高剂量组与低剂量组百草枯浓度的变化趋势差异有统计学意义(F=81.874,P=0.000)。见表 3。
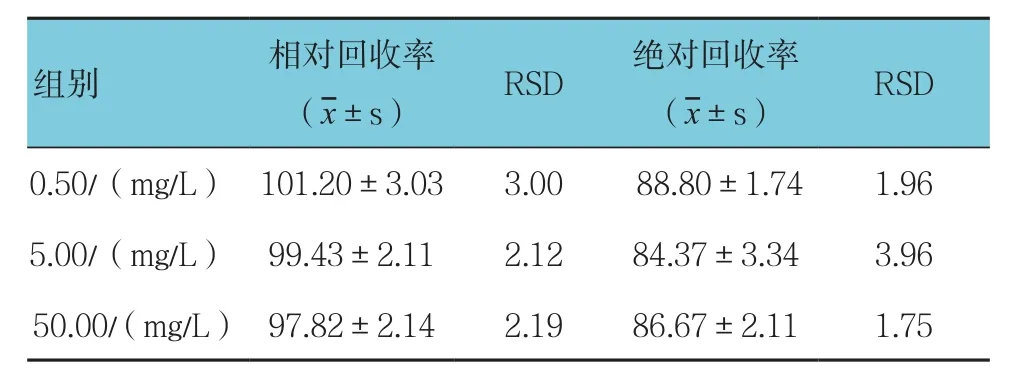
表1 家兔血清中百草枯的回收率 (n =6,%)
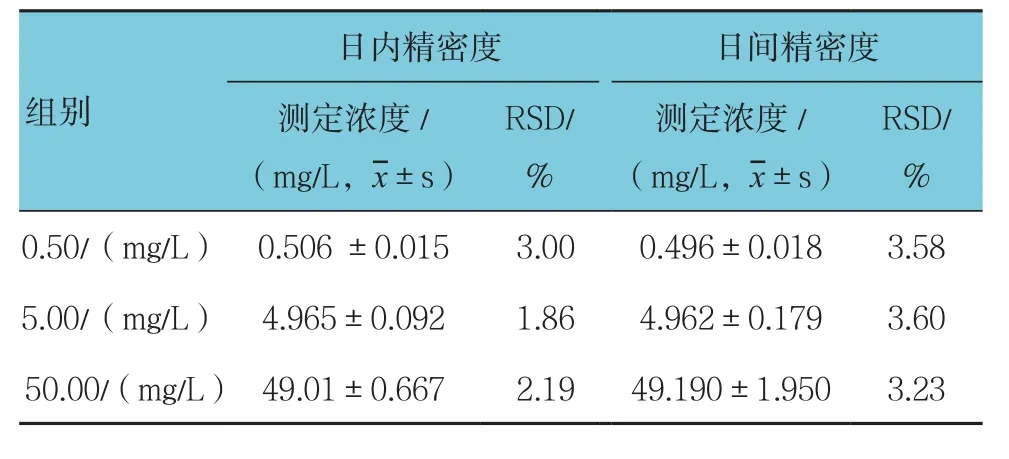
表2 家兔血清中百草枯的精密度 (n =6)
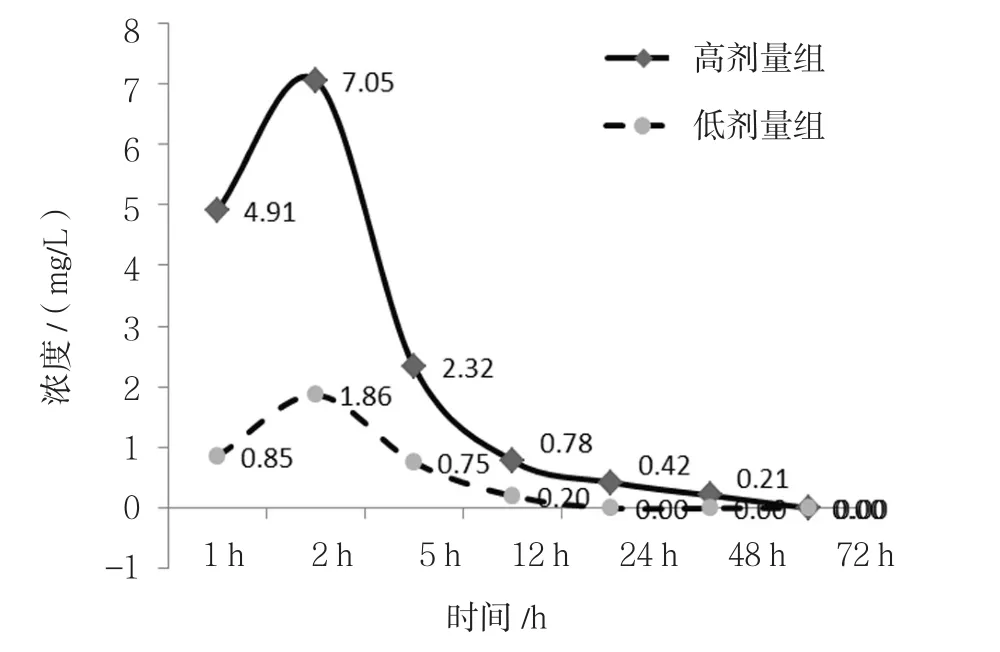
图3 不同剂量百草枯兔灌胃后其血清浓度的变化
表3 不同剂量百草枯兔灌胃后在血清中的浓度-时间变化 (n =6,mg/L,±s)
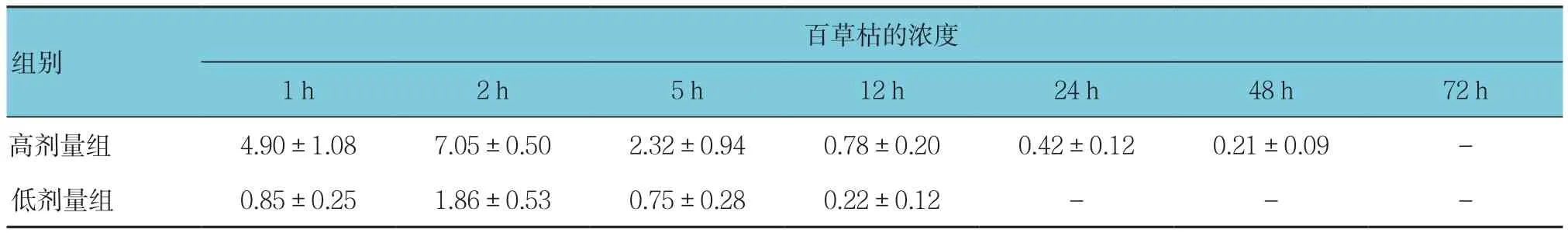
表3 不同剂量百草枯兔灌胃后在血清中的浓度-时间变化 (n =6,mg/L,±s)
注:-为未检测出水平
百草枯的浓度1 h 2 h 5 h 12 h 24 h 48 h 72 h高剂量组 4.90±1.08 7.05±0.50 2.32±0.94 0.78±0.20 0.42±0.12 0.21±0.09 -低剂量组 0.85±0.25 1.86±0.53 0.75±0.28 0.22±0.12 - - -组别
3 讨论
百草枯中毒为急诊科常见病例,并有逐年增多的趋势[5]。百草枯经皮肤、消化道和呼吸道吸收,毒性累及全身多个脏器,严重时可导致多器官功能障碍综合征(MODS),早期表现为急性肺损伤(ALI)或急性呼吸窘迫综合征(ARDS),后期出现肺泡内和肺间质纤维化,是百草枯中毒致死的主要原因,目前尚无特效解毒剂,死亡率极高[2,6]。研究发现[3,7],急性中毒患者的血中百草枯的浓度与预后生存率有关,建立能够快速、准确检测出血液中百草枯浓度的方法,可为临床医生诊断病情,判断预后以及采取适宜急救措施提供帮助。
目前,对百草枯的检测方法主要有气相色谱法[8]、HPLC法[9-12]、分光光度法[13]等,其中HPLC法以其设备不算昂贵及高效、敏感性高、操作自动化的特点成为临床常用的检测百草枯的方法。
虽然已有采用HPLC法测定生物血液百草枯含量的报道,但在具体方法选择及柱子、流动相、样品的预处理方法等方面有一定差异[9-12]。
本文采用反相离子对HPLC,选用ZORBAX300SB-C18柱具有耐低pH的优点,尤其适用于采用pH偏低的流动相分离在酸性溶液稳定的百草枯。流动相采用磷酸盐缓冲溶液作为水相,加入12.5 mmol/L的庚烷磺酸钠作离子对试剂,改变百草枯极性。流动相的比例上,减少了有毒的有机相乙腈的使用比例,用TFA调pH至2.8,进样检测时间10 min内完成,并获得较好的峰形。在样品预处理上,以往有文献报道采用30%高氯酸、乙腈和二氯甲烷依次处理沉淀蛋白,虽然无杂峰干扰,但处理步骤繁琐,样品损失多[8];或采用35%高氯酸沉淀蛋白,虽然步骤简单,但所得图谱杂质峰干扰较多[9]。采用乙腈直接沉淀蛋白的方法,同样简便快捷,且沉淀完全,在检测中未见有明显杂峰干扰。经过本法测定百草枯在0.20~100.00 mg/L浓度范围内线性关系良好(r=0.999)。相对回收率在97.82%~101.20%之间,绝对回收率在84.37%~88.80%之间,日内和日间RSD<5%。
本研究还观察不同剂量百草枯兔灌胃后其血清中的浓度随时间变化情况,结果显示血清中百草枯的浓度随时间的变化趋势及高、低剂量组随时间变化趋势的不同。无论是高剂量组还是低剂量组,百草枯通过胃肠吸收约2 h后,其血清中的药物浓度达到峰值,之后逐渐下降,其中,高剂量组于给药后72 h后检测不出,低剂量组于药后24 h检测不出。重复测量设计的方差分析结果显示,血清中的百草枯浓度有随时间变化和组别变化的趋势并且时间因素的作用随着分组的不同而不同。说明百草枯的血药浓度和蓄积的时间与剂量有关。本结果与以往学者认为,服毒剂量是影响预后强因素的观点是一致的[7,14-15]。其次,百草枯灌胃后2 h左右即达最大浓度,说明救治时间非常重要,假如能及时就诊进行救治,降低百草枯的血药浓度,则可延长患者的生存率,这与临床上关于百草枯越早治疗越有效,中毒后2 h为黄金时期,尽可能在中毒后5 h内全方位治疗的结论相符[14,16]。
实验结果表明,所建立方法的专一性、回收率和精密度均符合规定,测定结果准确,可为研究测定血清中百草枯浓度提供一种检测方法。
参 考 文 献:
[1] 时纯炎, 于秀勤, 李凌. 急性百草枯中毒患者的救治和护理体会[J]. 安徽医药, 2016, 37(7): 896-898.
在临床上,在排除其他原因的前提下,糖尿病患者出现与周围神经功能障碍有关的症状或体征,且以四肢远端感觉障碍为主要表现的病症,即为糖尿病周围神经病变[1]。该病症是糖尿病患者的严重并发症,其可诱发坏疽、溃疡、患肢感染等,严重时还可造成患者截肢,因此及早诊断和治疗意义重大[2]。本文选取我院收治的糖尿病患者50例,按照其有无周围神经病变分为观察组1和观察组2,同期选择健康体检者25例为对照组,即对高频超声在诊断糖尿病周围神经病变中的应用价值进行了探讨,现报道如下。
[2] 唐文杰, 孙海晨, 许宝华, 等. 急性百草枯中毒的急救体会[J].医学研究生报, 2008, 21(4): 394.
[3] SENARATHNA L, EDDLESTON M, WILKS M F, et al. Prediction of outcome after paraquat poisoning by measurement of the plasma paraquat coneentration[J]. QJM, 2009(102): 251-259.
[4] 贾丽君, 徐凌哲, 郭燕. 影响百草枯中毒预后的因素分析[J]. 河北医药, 2016, 38(7): 1010-1012.
[5] 陈桂喜. 百草枯中毒的治疗进展[J]. 医学综述, 2013, 19(11):2023-2025.
[6] 陈国杰, 宋彩霞, 赵新义, 等. 大黄治疗急性百草枯中毒的临床研究[J]. 临床急诊杂志, 2015, 16(6): 469-471.
[7] 王婷立, 石运莹, 张丽, 等. 117例百草枯中毒患者预后与相关影响因素的分析[J]. 现代预防医学, 2012, 39(20): 5442-5444.
[8] 陈姿如, 刘军生, 陈礼明, 等. 血液中百草枯衍生物的气相色谱法测定[J]. 中华劳动卫生职业病杂志, 2008, 26(2): 112-113.
[9] 王朝虹, 王志萍, 何毅, 等. 高效液相色谱法测定生物体液中百草枯[J]. 中国法医学杂志, 2007, 22(6): 388-390.
[10] 刘菲, 勉丽娜, 张婧, 等. 高效液相色谱法测定植物中的百草枯[J]. 中国卫生检验杂志, 2009, 19(6): 1248-1249.
[11] 陈璐, 邹静, 肖洪涛, 等. 高效液相色谱法测定人血清中百草枯浓度[J]. 中国医院药学杂志, 2010, 3(24): 2091-2094.
[12] 王雷, 王本杰, 孔祥麟, 等. 高效液相色谱法测定大鼠血浆中百草枯的含量[J]. 药物分析杂志, 2009, 29(4): 623-626.
[13] 赵燕燕, 刘会芳, 郝丽娜, 等. 血中百草枯的紫外分光光度测定法[J]. 环境与健康杂志, 2007, 24(5): 346-347.
[14] 赵燕燕, 刘会芳, 许鸣华, 等. 百草枯中毒的急救与影响预后的因素分析[J]. 中国急救医学, 2007, 27(8): 733-735.
[15] 宋斌, 李海燕, 曾燕, 等. 百草枯中毒的相关预后因素分析[J].现代预防医学, 2013, 4(8): 1571-1573.
[16] 赵群远. 百草枯中毒机制及治疗研究进展[J]. 中华危重症医学杂志, 2008, 1(2): 127-130.
