纤维素酶固定化的工艺优化
2018-05-10马一方刘研萍李秀金
马一方, 兰 淼, 刘研萍, 李秀金
(北京化工大学 环境科学与工程, 北京 100029)
木质纤维素类是一种结构复杂、性质稳定的可再生生物质资源,占生物质总量的40%~50%[1]。木质纤维素类的主要化学成分为纤维素(40%~50%)、半纤维素(25%~30%)和木质素(15%~20%),这三种成分在共价键和非共价键的作用下构成植物细胞壁的基本骨架,形成天然的“生物质抗降解屏障”[2]。高效转化木质纤维素类在当今资源紧缺的背景下具有重大意义。纤维素酶作为一种高效催化剂,可以将纤维素转化为纤维二糖和葡萄糖等小分子的可溶性糖,实现纤维素的高效利用[3]。酶水解反应条件温和,水解效率高。但是纤维素酶作为一种水溶性制剂,会与产物融合在一起,一方面导致产物的纯度降低,另一方面造成纤维素酶的流失。同时纤维素酶对温度和pH值等条件敏感。因此纤维素酶的循环多次利用和提高稳定性是主要解决的两个问题。刘路宽[4]等人采用介孔分子筛固定纤维素酶,固定率为31.5%,其pH值稳定性、稳定性和操作稳定性提高。陈伟兵[5]以海藻酸钠载体,以KH-550偶联剂,固定化酶的米氏常数与游离酶相比增加了近3倍。米氏常数的增加表明酶分子其与底物的亲和力降低。
本文采用海藻酸钠-聚乙二醇固定纤维素酶,操作简单、固定条件温和、对环境友好。以相对酶活力和酶活固定率为指标对固定化条件进行优化,并以相对酶活力为指标对优化后的固定化酶的酶学性质进行研究,分析固化方法的可行性。
1 材料与方法
1.1 主要实验材料
纤维素酶购自源叶生物,产自绿色木霉,淡黄色粉末,酶活力为11 U·mg-1,4℃保存。海藻酸钠购自国药集团,化学纯。聚乙二醇购自源叶生物,分子量4000,化学纯。
1.2 实验设计
1.2.1 固定化酶的制备及优化
在3.5%(w/w)的海藻酸钠溶液中加入聚乙二醇,混合均匀。取5 mL 3.5%(w/w)海藻酸钠溶液与1 mL纤维素酶液混合均匀后,加入1% 戊二醛作为交联剂,150 r·min-1振荡30 min。4℃静置交联4 h。将上述交联后的溶液通过5 mL注射器加入至2 %(w/w)CaCl2溶液中进行固定,形成凝胶小球。更换CaCl2溶液,于4℃下硬化2 h。用0.9%(w/w)NaCl溶液洗涤固定化酶以去除未被固定的游离酶,吸干表面水分,4℃保存。
以相对酶活力和酶活固定率为指标对酶液浓度、戊二醛用量、固定时间、固定温度和聚乙二醇用量进行优化。
1.2.2 固定化酶的酶学性质分析
以相对酶活力为指标,对上述优化后所制备的固定化酶的最适pH值、最适温度、热稳定性、操作稳定性和米氏常数等酶学性质进行测定分析。
1.3 分析方法
还原糖,CMC-Na酶活:DNS法[6]。
酶活固定率按公式(1)计算[7]:
酶活固定率(%)=
(1)
2 结果与讨论
2.2 海藻酸钠固定化酶条件优化
2.2.1 加酶量对固定化酶的效果影响
加酶量对固定化酶的效果影响见图1。将最大酶活力设定为100%。加酶量由2.5 mg·mL-1增加至12.5 mg·mL-1,固定化酶的相对酶活力随之增加,由53%增加至100%。随着载体所固定的酶分子量的增加,二者之间的结合位点逐步接近饱和,因此当酶液浓度为10 mg·mL-1时,固定化酶的酶活力达到99%,进一步增加酶液浓度,酶活力增加不明显。由于载体与酶分子之间的结合位点有限,因此尽管在固定体系中加大酶液浓度使得被固定的酶分子量增加,但是大部分酶分子会以游离态的形式损失掉[8],因此酶活固定率随着给酶量的增加而逐步降低,由69%降至25%。综合考虑加酶量对固定化酶相对酶活力和酶活固定率的影响,选择酶液浓度为5.0 mg·mL-1用于后续优化实验。

图1 加酶量对固定化酶相对酶活力和酶活固定率的影响

图2 交联剂用量对固定化酶相对酶活力和酶活固定率的影响
2.2.2 交联剂用量对固定化酶的效果影响
交联剂用量对固定化酶的效果影响见图2。将最大酶活力设定为100%。交联剂采用1%(w/w)戊二醛。随着戊二醛用量的增加,固定化酶的相对酶活力和酶活固定率的变化趋势基本一致,呈现出先增加而后降低的趋势。戊二醛作为交联剂,含有的两个醛基官能团,可以与纤维素酶中的氨基发生Schiff交联反应[9]。随着戊二醛用量的增加,酶分子之间交联度增加,在一定程度上可以减少由于酶分子粒径过小而导致的酶流失,提高其固定率。但是当交联剂的用量过大,会导致纤维素酶的交联度过大,使得酶分子的活性中心受到破坏,酶活力降低。当在海藻酸钠∶戊二醛(v∶v)大于1∶0.3时,固定化酶的相对酶活力和酶活固定率不再增加。因此选择海藻酸钠∶戊二醛(v∶v)为1∶0.3用于后续优化实验。
2.2.3 固定化时间对固定化酶的效果影响
固定化时间对固定化酶的效果影响见图3。将最大酶活力设定为100%。固定化酶的相对酶活力和酶活固定率随固定化时间的变化趋势一致,呈现先增加后减低的趋势。当固定化时间为2.5 h时,固定化酶的相对酶活力和酶活固定率均达到最大值。
固定化的过程是海藻酸钠的α-L-古罗糖醛酸(G单元)的Na+与CaCl2的Ca2+由外在内发生离子交换反应的过程。G单元中的2-OH 和5-COOH通过配位键与Ca2+形成“egg-box”结构,生成凝胶将酶分子包埋固定[10]。随着固定化时间的延长,离子交联反应更为充分,载体结构更为致密,可以减少在固定过程中由于载体表面和内部的孔径过大造成的酶分子流失。同时凝胶强度与Ca2+含量呈正相关,可以对酶分子的活性起到保护作用[11]。并且Ca2+也是纤维素酶的激活剂,可以提高纤维素酶的活力[12]。但是当固定化时间大于2.5 h后,随着时间的进一步延长,载体表面的孔径结构过于致密,在一定程度上会阻碍底物进入至载体内部与酶分子充分地接触,传质阻力增加,使得纤维素酶的酶活力降低。因此固定时间为2.5 h用于后续优化实验。

图3 固定化时间对固定化酶相对酶活力和酶活固定率的影响

图4 固定化温度对固定化酶相对酶活力和酶活固定率的影响
2.2.4 固定化温度对固定化酶的效果影响
固定化温度对固定化酶的效果影响见图4。将最大酶活力设定为100%。随着固定化温度的增加,相对酶活力和酶活力均呈现出先增加后降低的趋势。当固定化温度为50℃时,相对酶活力和酶活固定率均达到最大值。随着固定化温度的增加,可以加速海藻酸钠与CaCl2进行离子反应,在一定的固定化时间内,使载体的结构更为致密,提高酶分子的固定率。但是载体一旦过于致密,会增加底物的扩散系数,使得纤维素酶的酶活力降低。同时纤维素酶的活性与温度有关,温度过高会导致纤维素酶的活性中心位点受到影响,从而使酶分子的活力降低;当温度高于50℃时,酶分子的失活率大于酶分子的固定率,在综合作用下,使得纤维素酶的酶活力降低。因此选择固定温度为50℃用于后续优化实验。
2.2.5 聚乙二醇用量对固定化酶的效果影响
聚乙二醇用量对固定化酶效果的影响见图5。将最大酶活力设定为100%。固定化酶的相对酶活力和酶活固定率随聚乙二醇用量的增加,二者均呈现为先增加后降低的变化趋势。当海藻酸钠∶聚乙二醇为1∶1.5(w∶w)时,固定化酶的相对酶活力和酶活固定率均达到最大值,并且与未添加聚乙二醇的固定化酶相比,添加聚乙二醇可以提高酶活力和酶活固定率分别为25%和18%。
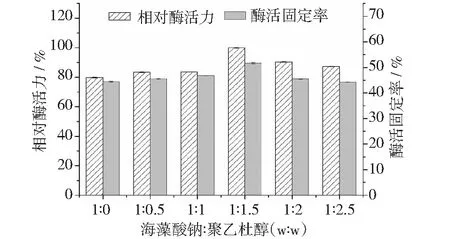
图5 聚乙二醇用量对固定化酶相对酶活力和酶活固定率的影响
聚乙二醇用作致孔剂的原理为其可以在海藻酸钠与Ca2+交联时从固定化体系中溶出,增加载体的孔密度。同时聚乙二醇含有的聚乙二醇基和羟基均可以与载体和酶分子形成氢键,增加固定化酶的亲水性,提高酶活力[13]。随着聚乙二醇用量的进一步提高,当海藻酸钠∶聚乙二醇(w∶w)大于1∶1.5后,载体表面及内部的孔密度过大,会造成酶分子的流失,因此固定化酶的酶活力和酶活固定率均降低。
2.3 固定化酶与游离酶的酶学性质对比分析
2.3.1 pH值对固定化酶和游离酶酶活力的影响
pH值对固定化酶和游离酶酶活力的影响见6。将最大酶活力设定为100%。pH值会影响底物和酶分子的解离和络合、影响纤维素酶的活性中心分子构象,从而影响酶分子稳定性,因此过高或者过低的pH值会使纤维素酶的活性降低[14]。其中,游离酶的最佳pH值为4,固定化酶的最佳pH值为5,比游离酶的最佳pH值增加了一个单位。这种原因可能是由于海藻酸钠在反应体系中具有大量的羧基官能团,可以与H+结合生成羧酸,载体周围聚集大量的H+,使得反应体系较游离酶的反应体系相比向酸性移动,因此为了维持酶分子的最佳pH值使得固定化酶的表观pH值向碱性方向移动。

图6 pH值对游离酶和固定化酶酶活力的影响
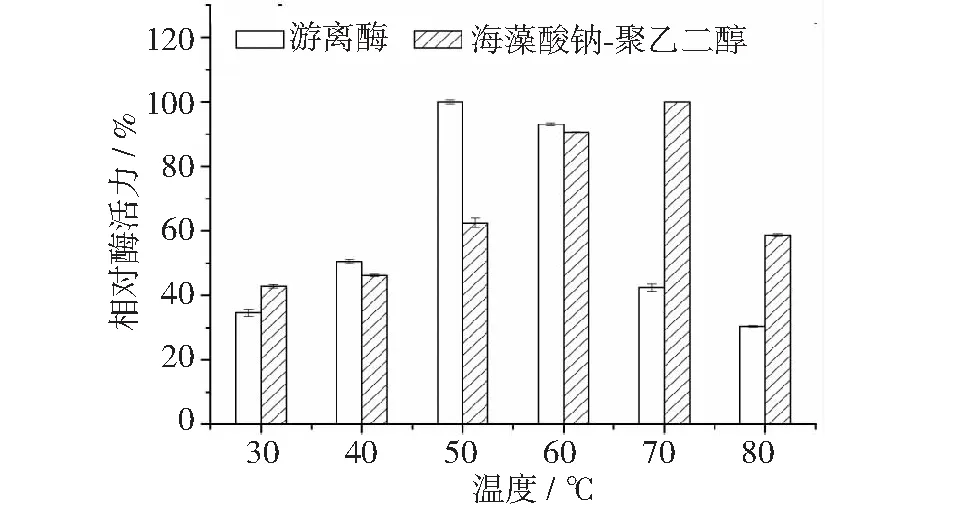
图7 温度对游离酶和固定化酶酶活力的影响
2.3.2 温度对固定化酶和游离酶酶活力的影响
温度对固定化酶和游离酶酶活力的影响见图7。将最大酶活力设定为100%。在温度为30℃~80℃的变化范围内,固定化酶和游离酶的酶活力均为先增加后降低的变化趋势。原因是在酶催化反应过程中,升高反应体系的温度,一方面可以提高底物和酶分子的分子动能,有助于加速二者的吸附、解离和络合,改变反应的平衡常数从而加速酶促反应的进行;而另一方纤维素酶自身的活性位点会受到温度的影响,其活性会随着温度的升高而降低甚至失活,最适温度是两方面综合作用的结果[15]。
游离酶的最适温度为50℃,固定化酶的最适温度为70℃,与游离酶相比,固定化酶的最适温度增加了20℃。因为纤维素酶经过交联固定后,一方面酶分子运动和伸展受到限制,因此其活性中心的稳定性增加,而另一方面,载体可以阻挡过高的温度对酶分子的影响。
2.3.3 固定化酶和游离酶的热稳定性分析
固定化酶和游离酶的热稳定性分析见图8。将最大酶活力设定为100%。固定化酶和游离酶在30℃~80℃下保温2 h,固定化酶和游离酶的酶活力有不同程度的降低。
当温度低于40℃时,游离酶的活力没有明显变化,相对酶活力保持在100%,由40℃升高至60℃时,游离酶的相对酶活力迅速降至39%,进一步升高至80℃,相对酶活力变化不明显,稳定在33%以上。
当温度低于60℃时,固定化酶的相对酶活力保持超过98%,酶活力没有明显的变化。当温度高于60℃之后,固定化酶的酶活力降低较为明显。因为纤维素酶经过交联固定后,一方面酶分子的空间构型更为稳定、活性中心得到保护,另一方面载体可以阻挡高温等不利因素对酶分子的直接接触,从而使固定化酶的热稳定性提高[16]。并且当温度高于固定化酶和游离酶自身的最适温度后,酶活力降低明显。可能是因为低于最适温度的保温,温度可以使酶分子提前预热用于后续酶水解反应,温度高于最适温度后,保温使得酶分子的活性位点和空间构型受到不可逆的影响,使其发生热变性。
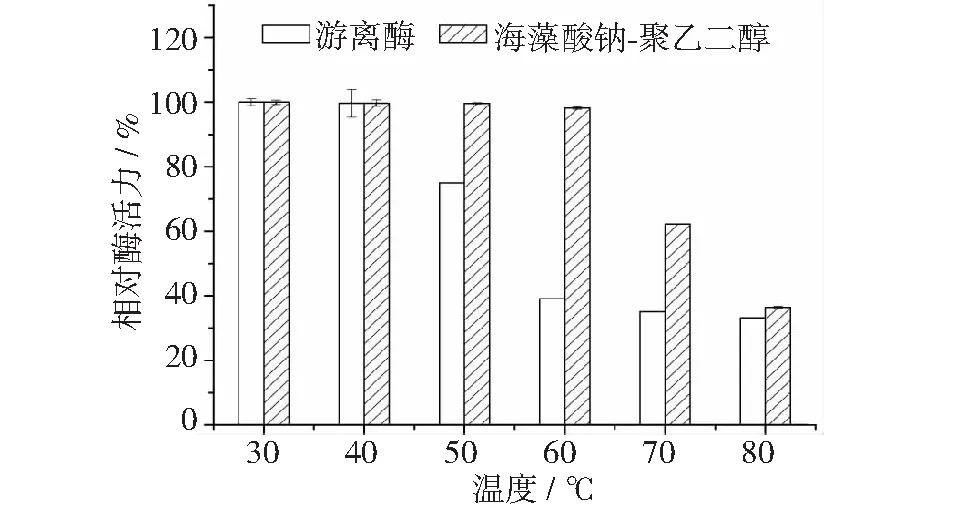
图8 游离酶和固定化酶的热稳定性分析
2.3.4 固定化酶的操作稳定性分析
固定化酶的操作稳定性分析见表1。将最大酶活力设定为100%。在初次使用过后,会有部分未被载体完全固定的浅层游离态的酶分子流失,从而导致酶活力大幅度降低。并且在重复使用的过程中,反应体系的pH值和温度等因素会对载体和酶分子的稳定性造成影响,可能导致酶分子泄露以及酶活性降低[11]。
2.3.5 固定化酶和游离酶的Km对比分析
固定化酶和游离酶的米氏常数Km拟合曲线图9和图10所示。固定化酶和游离酶的Km分别为1.850 mg·mL-1和0.809 mg·mL-1。较游离酶相比,固定化酶的Km增加了125%,说明固定化酶与底物之间的亲和力降低。原因一方面是因为酶分子被固定在载体内部,与底物的接触受限,降低了底物和酶分子之间的亲和力;另一方面是纤维素酶经过交联剂的交联,空间构象和活性中心可能发生改变,导致Km增加[14]。

表1 固定化酶操作稳定性分析 (%)
3 结论
(1)综合考虑相对酶活力和酶活固定率,海藻酸钠-聚乙二醇固定化酶的制备条件为∶酶液浓度=5 mg·mL-1,交联剂采用1%(w/w)戊二醛,海藻酸钠∶戊二醛=1∶0.3(v∶v),海藻酸钠∶聚乙二醇=1∶1.5(w∶w),固定温度和时间分别为50℃和2.5 h。

图9 游离酶的Linear-Burk图
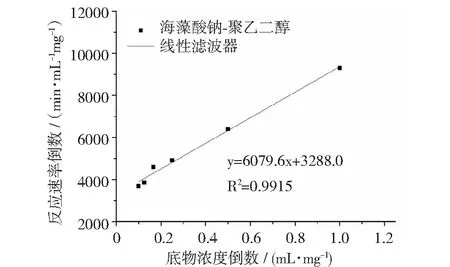
图10 固定化酶的Linear-Burk图
(2)与游离酶相比,固定化酶的最适pH值向碱性方向移动,最适温度提高20℃,热稳定性提高,米氏常数提高1倍。循环水解利用3次后,仍可保留50%的酶活力。说明此固定方法可以有效的将纤维素酶固定,并且酶学性质较游离酶大幅度提升。
参考文献:
[1] 杨 静. 玉米秸秆纤维素酶水解研究及响应面法优化[D].天津:天津大学, 2007.
[2] McKendry P. Energy production from biomass (Part 1): Overview of biomass [J]. Bioresour Technol, 2002, 83(1): 37-46.
[3] Kellock M, Rahikainen J, Marjamaa K.et al. Lignin-derived inhibition of monocomponent cellulases and a xylanase in the hydrolysis of lignocellulosics.[J]. Bioresource Technology, 2017, 232: 181-193.
[4] 刘路宽. 介孔分子筛固定纤维素酶的研究[D].青岛:青岛科技大学, 2013.
[5] 陈伟兵. 海藻酸钠/SiO2复合水凝胶的制备及作为固定化纤维素酶载体的研究[D].福州:华侨大学, 2007.
[6] 徐国涛. 玉米秸秆超声波预处理酶解发酵制沼气研究[D].南宁:广西大学, 2009.
[7] Rahim Siti Noraida Abd, Sulaiman Alawi, Hamzah Fazlenaet al. Enzymes Encapsulation within Calcium Alginate-clay Beads: Characterization and Application for Cassava Slurry Saccharification [J]. Procedia Engineering, 2013, 68: 411-417.
[8] 雷生姣, 潘思轶. 交联海藻酸钠固定化柚(皮)苷酶 [J]. 食品工业科技, 2014, 35(1): 232-236.
[9] 张媛媛, 聂少平, 万 成,等. 日本曲霉产β-D-呋喃果糖苷酶的固定化 [J]. 南昌大学学报(理科版), 2010, 34(3): 243-248.
[10] 何荣军, 杨 爽, 孙培龙,等. 海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J]. 食品与机械, 2010, 26(2): 166-169, 173.
[11] 王 瑾, 李默馨, 李红玲,等. 壳聚糖/海藻酸钠固定化β-葡萄糖苷酶的研究[J]. 食品工业科技, 2009(3): 164-167.
[12] 宋贤良, 温其标, 朱 江. 纤维素酶法水解的研究进展[J]. 郑州工程学院学报, 2001, 22(4): 67-71, 84.
[13] 张 敏. 聚乙二醇表面干预纤维素酶水解纤维素体系的机理研究[D].南京:南京林业大学, 2014.
[14] Vaz R P, Moreira LRDS, Filho E X F. An overview of holocellulose-degrading enzyme immobilization for use in bioethanol production[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: 127-135.
[15] 王 华, 王 莹, 李爱娟,等. 海藻酸钠交联包埋法固定化纤维素酶研究[J]. 江苏农业科学, 2013, 41(3): 325-327.
[16] 郭 锐. 固定化纤维素酶的制备及其性质研究[D].天津:天津大学, 2009.
