2种邻苯二甲酸酯对杜氏盐藻的生长抑制机理研究❋
2018-05-10涂海峰顾书瑞李锋民
唐 燎, 涂海峰, 伍 淼, 顾书瑞, 李锋民❋❋
(1.中国海洋大学近海环境污染控制研究所,山东 青岛266100;2.海洋环境与生态教育部重点实验室,青岛 266100;3.中国海洋大学环境科学与工程学院,山东 青岛266100)
邻苯二甲酸酯(Phthalates acid esters, PAEs)是世界上广泛使用的一类增塑剂,其含量可占塑料制品质量的10%~60%[1]。PAEs通过氢键或范德华力连接到塑料的高分子碳链上,因此在塑料制品使用或处置过程中易浸出并释放到环境中,对生态环境造成影响[2]。其中DEP、DBP均被美国环保局列为优先控制污染物,我国饮用水卫生标准(GB5749—2006)中也规定了这2种PAEs的限值[3]。
大量的塑料制品的消耗和持续的排入,导致水体[4-5]、土壤[5]、空气[6]均受到DEP与DBP的污染。研究表明,DBP和DEP具有环境激素效应,干扰人体的内分泌系统[7-8],削弱精子活力并产生DNA损伤[9];在对小鼠的毒理实验中也发现,DBP能扰乱小鼠的生殖系统[10-11]和神经系统[12],并对小鼠脑组织产生氧化损伤[12]。DBP能影响鱼类胚胎的发育[13-14],诱发畸变。DBP还会导致小麦等植物[15-16]种子的萌发率降低、幼苗根部和叶片的脂质过氧化。环境中的DBP和DEP等PAEs会对生物的生长发育产生威胁。PAEs易在水生生物中富集,在微藻中富集尤为显著[17],而在水生生物的急性毒性实验中,藻类最为敏感[18]。已有研究表明DEP、DBP对三角褐指藻、等鞭金藻三种藻类的生长均有显著的抑制作用[19];铜绿微囊藻对DBP有明显的富集作用[20],低浓度的DBP会促进藻细胞的生长和SOD、CAT活性,高浓度条件下则呈现抑制作用[21];而东海原甲藻、红胞藻在DBP的作用下生长速率显著增加[22]。不同研究所揭示的PAEs对不同藻类生长的影响不同,甚至出现了部分藻类生长受促进而部分藻类生长受抑制的相悖结果;且PAEs对藻类的研究内容多关注藻类生长情况和色素含量,部分研究通过测定酶活性的变化反映藻体所受的氧化胁迫,但缺乏对氧化胁迫的靶器官或作用位点的深入研究。
海洋微藻是海洋初级生产力的重要组成,污染物对藻类的影响也会反馈至更高级的营养级,进而影响海洋生态系统。杜氏盐藻富含β-胡萝卜素和甘油[23],是海洋中一种具有重要应用价值的嗜盐绿藻,尤其在盐田等高盐环境中的具有重要生态地位[24]。本研究分析了DEP与DBP对杜氏盐藻生长、SOD活性、MDA含量和亚显微结构的影响,探究其对海洋微藻的作用位点和作用机理,为揭示PAEs类环境激素对海洋生态系统的影响机制提供理论基础。
1 材料与方法
1.1 实验材料
DEP,DBP购自上海阿拉丁试剂公司(纯度>99.5%,GC),丙酮,甲醇,乙醇,正十二烷,戊二醛溶液均购自国药集团化学试剂有限公司。杜氏盐藻购买自中国科学院青岛海洋所藻种室。本研究均采用f/2液体培养基,盐度29.2,温度(22±2) ℃,光照强度为6 000 lx,光暗循环14L∶10D,培养期间每天摇晃藻液2次,并随机变换位置。
1.2 研究方法
1.2.1 丙酮无效应浓度的确定 本研究采用丙酮作为助溶剂;用f/2液体培养基配制6个浓度系列溶液:0、0.1、0.2、0.3、0.4、0.5 mg·L-1,无菌条件下接种,每隔24 h取样,测定96 h内藻细胞密度(个/mL),计算其无效应浓度值。
1.2.2 DEP与DBP对杜氏盐藻的毒性 取生长状况良好、预培养至对数生长期的杜氏盐藻藻液接种至已灭菌的500 mL空三角锥瓶中,每瓶200 mL藻液,分装时藻密度为6×108cells·mL-1,再分别添加DEP与DBP。浓度梯度设定为:①高浓度组DBP-H为3.2 mg·L-1,DEP-H为32 mg·L-1;②低浓度组DBP-L为1.6 mg·L-1,DEP-L为16 mg·L-1。将处理好的藻液放入光照培养箱中培养,每隔24 h取样,测定96 h内藻密度、β-胡萝卜素含量、SOD活性和MDA含量并观察96 h藻细胞亚显微结构。
1.3 分析测定方法
1.3.1 杜氏盐藻生长密度的检测 以血球计数板计数,并计算藻细胞密度(个/mL)。
1.3.2 藻细胞β-胡萝卜素含量的测定 取出藻液10 mL,4 000 r/s离心10 min弃上清液,加入3 mL正十二烷,充分摇晃震荡,再加入9 mL甲醇剧烈震荡;后4 000 r/s离心3 min,轻取最上层于453、665 nm 波长测量吸光度值,以正十二烷作参比。计算公式如下:

其中, 3.657为校正系数。
1.3.3 藻细胞SOD活性和MDA含量的测定 分别取10 mL藻液,4 ℃、7 000 r·min-1离心15 min,去上清收集藻细胞,加1 mL 于4 ℃冰箱中预冷的0.1 mol·L-1磷酸缓冲液(pH=7.8),超声波细胞破碎仪中超声破碎5 min(振幅50%),此为待测样品。实验采用总过氧化物歧化酶(SOD)试剂盒(A001)、丙二醛(MDA)试剂盒(A003)测定藻的SOD活性和MDA含量,试剂盒均购自南京建成公司,实验过程严格按照试剂盒说明操作。
1.3.4 藻细胞亚显微结构的观察 离心(3 500 r·min-1,10 min)收集藻细胞,参照文献[25]方法固定样品,制作切片。使用透射显微镜(JEOL,JEM-1200EX,日本)观察并拍照藻细胞亚显微结构。
1.4 数据分析
数据处理使用Microsoft Excel 2010,Origin 8.6 画图拟合,Spss19.0 统计软件完成显著性差异分析,p<0.05。
2 结果
2.1 丙酮对杜氏盐藻无效应浓度的确定
丙酮含量对杜氏盐藻的生长影响见图1,相关性分析结果表明在不同浓度的丙酮作用下,藻密度并无显著性差异。依据美国环保署推荐对于急性毒性实验最大溶剂使用量为0.5‰,慢性毒性实验0.1‰ (V∶V)[26]。因此在后续实验中丙酮使用量为0.5 mL·L-1,即0.5‰(V∶V)。

图1 不同浓度的丙酮对杜氏盐藻生长的影响Fig.1 Effect of acetone at different concentrations on the growth of D. tertiolecta
2.2 DEP与DBP对杜氏盐藻生长的抑制
不同质量浓度的DEP与DBP作用下杜氏盐藻的生长曲线见图2。DBP实验组的藻密度呈现先增加后减少,且两暴露组均显著低于对照组(P<0.05)。低浓度组在96 h时藻密度下降,而高浓度组在48 h藻密度下降,96 h时高浓度组的生长抑制率达到86.6%。镜检观察也发现有藻细胞开始发白。DEP暴露下96 h内藻细胞随着培养时间不断增长而增加,但藻密度也显著低于对照组(P<0.05),96 h时高浓度组的抑制率达到51.7%。

图2 不同浓度的DBP与DEP对杜氏盐藻生长的影响Fig.2 Effect of DBP and DEP at different concentrations on the growth of D. tertiolecta
2.3 DEP与DBP对杜氏盐藻SOD和MDA的影响
如图3所示,在DBP的作用下,藻细胞的总SOD活性随浓度增大而增强,均在96 h出现最大值,高浓度组的SOD活性是对照组的3.7倍。对照组和DEP实验组的SOD活性均呈现先增加后降低,于48 h时出现峰值,随培养时间加长逐渐下降,且实验组均显著高于低浓度组对照组(P<0.05)。

图3 不同浓度的DBP与DEP对杜氏盐藻SOD活性的影响Fig.3 Effect of DBP and DEP at different concentrations on SOD activity of D. tertiolecta
2种PAEs对藻细胞对MDA含量的影响见图4,对照组杜氏盐藻的MDA含量96 h内无明显波动。DBP实验组48 h开始才出现明显增加,到96 h出现最大值;且72 h后高浓度组显著高于低浓度组(P<0.05),远高于对照组。DEP实验组的MDA含量均较低,仅略高于对照组,但整体变化幅度不大,均在2×10-6nmol·cell-1以下。

图4 不同浓度的DBP与DEP对杜氏盐藻MDA含量的影响Fig.4 Effect of DBP and DEP at different concentrations on MDA level of D. tertiolecta
2.4 DEP与DBP对杜氏盐藻β-胡萝卜素含量的影响
杜氏盐藻含有丰富的类胡萝卜素(以β-胡萝卜素为主),在极限条件下盐藻中积累的β-胡萝卜素含量最高可达藻体干重的14%[27],对其代谢活动有重要功能。如图5所示,在DBP的作用下,杜氏盐藻的β-胡萝卜素含量较对照组显著降低(p<0.05),24 h时,低浓度组的β-胡萝卜素含量高于高浓度组,而48 h后高浓度组的β-胡萝卜素含量均高于低浓度组;随着时间推移,高浓度组和低浓度组的β-胡萝卜素含量变化不大,96 h时含量略有增加。DEP对杜氏盐藻的影响与DBP则不同,在DEP作用下的杜氏盐藻中β-胡萝卜素含量则均显著高于对照组(P<0.05),各时间段高浓度组的含量均高于低浓度组,且随着时间推移,含量一直上升。
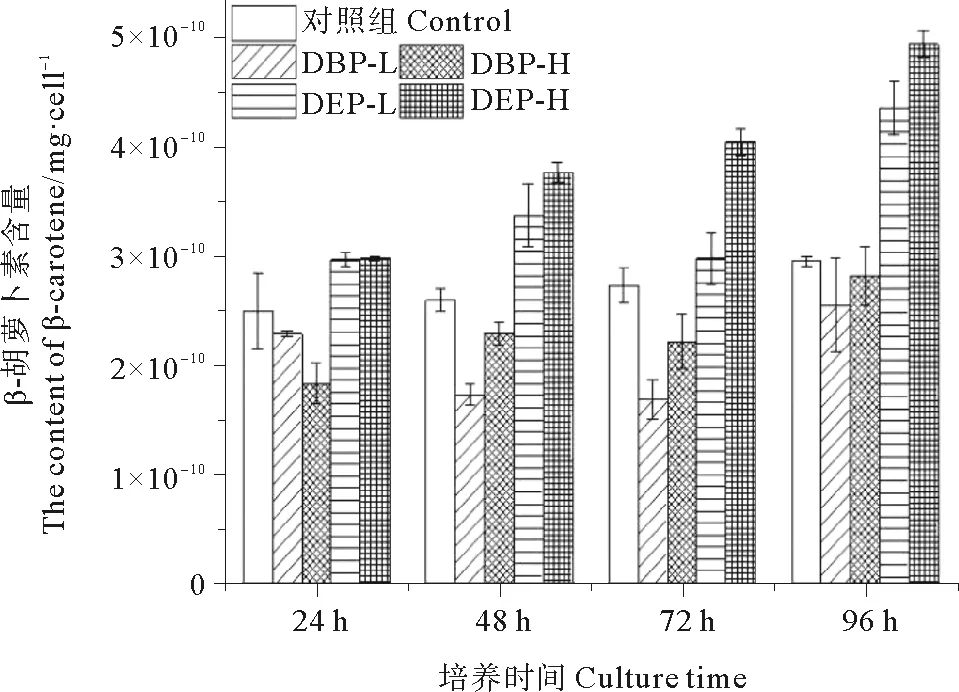
图5 DBP与DEP对杜氏盐藻β-胡萝卜素含量的影响Fig.5 Effect of DBP and DEP at different concentrations on β-carotenel of D. tertiolecta
2.5 DEP与DBP对杜氏盐藻亚显微结构的影响
通过TEM观察亚显微结构,结果见图6。对照组(见图6a、b)藻细胞的细胞核、叶绿体、线粒体等细胞器结构完整、界限清晰,细胞膜完整。DBP低浓度组(见图6c)细胞内淀粉核增多分散,其他细胞器完整;高浓度处理组(见图6d)细胞形态变椭圆,细胞内出现空洞,淀粉核减少,细胞内含物减少,细胞膜边界模糊。DEP组变化则不同,低浓度组最为明显就是淀粉核增多,几乎布满整个细胞,数量为对照组的2倍以上,但细胞外膜结构完整(见图6e)。而在高浓度组(见图6f)淀粉粒数量减少,但体积增大,线粒体严重畸形,但整个细胞膜完整。

(a和b为对照组;c和d分别为DBP1.6 mg·L-1和3.2 mg·L-1处理组;e和f分别为DEP16 mg·L-1和32 mg·L-1处理组。N,细胞核;M,线粒体;P,淀粉核。比例尺为2 μm.a,b:Control group;c,d:Treated with 1.6 mg·L-1and 3.2 mg·L-1DBP;e,f:Treated with 16 mg·L-1and 32 mg·L-1DEP.N:Nucleus;M:Mitochondrion;P:Starch granule.Measuring scale:2μnm.)
图6 DBP和DEP对杜氏盐藻亚显微结构的影响
Fig.6 The details of ultrastructures ofD.tertiolectatreated with DBP and DEP
3 讨论
本研究中的2种PAEs对杜氏盐藻均表现出抑制作用,且抑制程度与PAEs浓度有明显的浓度-剂量效应关系;邱海源等[19]发现邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)、DEP、DBP对盐藻、三角褐指藻和等鞭金藻的生长也有抑制作用,且不同PAEs的抑制强度不同;而黄博珠等[22]的研究却表明DBP对东海原甲藻、海洋小球藻、红胞藻生长都有显著促进作用。说明PAEs对藻类生长的作用机制可能存在差异。
PAEs在生物体内可诱发氧自由基的大量产生,从而引起氧化胁迫。SOD是细胞内清除活性氧的关键酶,也是植物体内抗氧化系统第一道防线[28]。MDA是氧自由基作用于脂质,过氧化最重要的产物之一,具有细胞毒性,能加剧膜的损伤;膜结构氧化越严重,MDA含量越高[29],因此MDA是判定在氧化胁迫下细胞的膜结构是否脂质过氧化的一个重要指标。杜氏盐藻中β-胡萝卜素是光合作用的辅助色素,含量高且具有清除氧自由基的能力[30-31]。大量研究也表明当杜氏盐藻处于强光照[32-33]、氮缺乏[34]、微量元素[35]限制条件下时,就会引起β-胡萝卜素的合成和积累,以此抵御外界环境压力。细胞的亚显微结构观察常被用来研究外源性化合物对生物的损伤机制研究中[36];能够直接观察藻细胞受损的部位和结构变化。因此研究这4项参数有助于分析2种PAEs作用下杜氏盐藻生长受抑制的作用机理。
本研究中在DEP作用下,SOD活性呈现先增强后减弱。Liu等[37]的研究也发现DBP与DEP分别作用下的短裸甲藻(Kareniabrevis)中SOD含量呈现增强后减弱的趋势,认为藻细胞在DBP与DEP的刺激下产生了大量活性氧,初期SOD应激活性增强,用以消除过多的活性氧;后期逐渐积累的活性氧对藻体膜结构破坏或是引起其他细胞生理损伤,导致酶活性减弱。这与本研究现象相似,但后期SOD活性减弱的原因却不全相同。本研究中变化微弱的MDA含量和TEM结果中完整的膜结构表明DEP作用下的藻细胞膜系统并未受到明显氧化损伤,而高浓度DEP作用下的藻细胞中畸形的线粒体、体积变大且团聚的淀粉核说明了后期SOD活性下降的原因可能是淀粉粒物质合成等生理活动引发了藻体代谢紊乱所引起。同时杜氏盐藻在DEP作用下β-胡萝卜素含量迅速增加,β-胡萝卜素能消除过量的氧自由基,削弱氧化胁迫的危害。TEM结果显示DEP作用下的藻细胞淀粉粒增加的尤为明显。蛋白核(淀粉核)是藻类植物蛋白质与淀粉的一种贮藏形态,通常与储存产物有关,藻体大量合成淀粉粒可能也是杜氏盐藻抵御氧化胁迫的一种手段。
与DEP的影响不同,杜氏盐藻在DBP作用下SOD活性迅速增加,且浓度组培养后期并未出现活性减弱现象,可能是由于不同藻类在DBP胁迫下抗氧化能力的差异所致。而藻细胞MDA含量先期平稳而后迅速增加,可能是由于前期细胞内其他的抗氧化反应的平衡,后期平衡被不断积累的氧化损伤打破,脂质过氧化加剧,藻细胞MDA含量迅速增加。在Li等[38]的研究中也发现在5 mg·L-1的DBP刺激下,短裸甲藻中的MDA含量持续上升,认为是藻细胞中过量的活性氧作用在细胞膜上,导致了脂质过氧化。本研究中TEM结果中细胞膜结构出现断裂边界模糊也印证了细胞膜上发生了损伤。β-胡萝卜素含量变化与DEP条件下相反,始终低于对照组。Liu W等[39]的研究发现在低盐(5‰~20‰)条件下杜氏盐藻会产生大量活性氧抑制碳酸酐酶的酶活和基因表达水平,从而抑制了菌体生长和光合作用,不利于β-胡萝卜素的合成。这与本研究中β-胡萝卜素变化有相似结果,DBP作用下SOD活性的迅速升高也反映了藻体内活性氧的大量增加,过量的氧自由基超出了细胞的清除能力,从而抑制了β-胡萝卜素合成。48 h后高浓度组β-胡萝卜素含量高于低浓度组,说明合成β-胡萝卜素也可能是杜氏盐藻抵抗DBP胁迫的一种手段,但在DBP作用下合成的β-胡萝卜素弱于正常水平并不能有效缓解藻体所受的氧化胁迫。TEM结果还显示在高浓度DBP作用下淀粉核减少,细胞内出现空洞,更加证明了藻体氧化损伤严重。
综合对比2种PAEs作用下各参数的变化,发现二者均能引起藻体的氧化胁迫。DEP作用下藻体通过提高SOD活性、增加合成β-胡萝卜素和淀粉粒来抵御过量的氧自由基,藻体未受到明显的氧化损伤,但线粒体出现畸形,表明大量的β-胡萝卜素和淀粉粒合成可能导致的藻细胞代谢发生紊乱,从而加速藻体衰亡。而DBP作用下的藻细胞虽然通过增强SOD活性抵御氧化胁迫,但仍受到严重的氧化损伤。过量的氧自由基抑制了β-胡萝卜素的合成,同时导致了细胞膜结构发生严重脂质过氧化,细胞内含物流失,最终导致细胞死亡。
4 结论
(1)DBP与DEP对杜氏盐藻生长均有明显的抑制作用,且浓度越大,抑制作用越强。
(2)DBP和DEP对杜氏盐藻生长的抑制机制不同,这可能与2种物质的自身结构性质有关。DBP引起了藻体SOD活性持续增加,于96 h出现最大值,此时高浓度组的SOD活性是对照组的3.7倍;藻细胞应激产生的大量氧自由基对细胞膜也有严重氧化损伤,包括变形和破裂,细胞内含物溢出,最终导致细胞死亡。而DEP作用下藻体MDA含量变化微弱,膜结构无明显损伤;在藻生长受抑制的条件下SOD酶活性先增强后减弱,同时藻体通过增加淀粉粒合成和β-胡萝卜素积累从而抵御氧化胁迫,但大量的物质合成等代谢活动可能会加速细胞的衰老甚至死亡。
参考文献:
[1] Earls A O, Axford I P, Braybrook J H. Gas chromatography-mass spectrometry determination of the migration of phthalate plasticisers from polyvinyl chloride toys and childcare articles[J]. Journal of Chromatography A, 2003, 983(1-2): 237-246.
[2] Staples C A, Adams W J, Parkerton T F, et al. Aquatic toxicity of eighteen phthalate esters[J]. Environmental Toxicology & Chemistry, 1997, 16(5): 875-891.
[3] 中华人民共和国卫生部. 中华人民共和国国家标准生活饮用水卫生标准[J]. 城镇供水, 2007(4): 27-31.
Ministry of Health of the People’s Republic of China. The standard for drinking water quality peaplers republic of China[J]. City and Town Water Supply, 2007(4): 27-31.
[4] Liu X, Shi J, Bo T, et al. Occurrence of phthalic acid esters in source waters: A nationwide survey in China during the period of 2009-2012[J]. Environmental Pollution, 2013, (184C): 262-270.
[5] Daiem M M A, Rivera-Utrilla J, Ocampo-Pérez R, et al. Environmental impact of phthalic acid esters and their removal from water and sediments by different technologies-A review[J]. Journal of Environmental Management, 2012, 109(2012): 164-178.
[6] Wang P, Wang S L, Fan C Q. Atmospheric distribution of particulate- and gas-phase phthalic esters (PAEs) in a Metropolitan City, Nanjing, East China[J]. Chemosphere, 2008, 72(10): 1567-1572.
[7] Heudorf U, Merschsundermann V, Angerer J. Phthalates: Toxicology and exposure[J]. International Journal of Hygiene & Environmental Health, 2007, 210(5): 623-634.
[8] Latini G. Monitoring phthalate exposure in humans[J]. Clinica Chimica Acta, 2005, 361(1-2): 20-29.
[9] Pant N, Kumar G, Upadhyay A D, et al. Reproductive toxicity of lead, cadmium, and phthalate exposure in men[J]. Environmental Science and Pollution Research, 2014, 21(18): 11066-11074.
[10] Foster P M, Cattley R C, Mylchreest E. Effects of di-n-butyl phthalate (DBP) on male reproductive development in the rat: Implications for human risk assessment[J]. Food & Chemical Toxicology, 2000, 38(1 Suppl): S97.
[11] Takeuchi S, Iida M, Kobayashi S, et al. Differential effects of phthalate esters on transcriptional activities via human estrogen receptors alpha and beta, and androgen receptor[J]. Toxicology, 2005, 210(3): 223-233.
[12] Yan B, Guo J, Liu X, et al. Oxidative stress mediates dibutyl phthalate induced anxiety-like behavior in Kunming mice[J]. Environmental Toxicology & Pharmacology, 2016, 45: 45-51.
[13] Agus H H, Sümer S, Erkoç F. Toxicity and molecular effects of di-n-butyl phthalate (DBP) on CYP1A, SOD, and GPx inCyprinuscarpio(common carp)[J]. Environmental Monitoring & Assessment, 2015, 187(7): 423.
[14] Xu H, Dong X, Zhang Z, et al. Assessment of immunotoxicity of dibutyl phthalate using live zebrafish embryos[J]. Fish & Shellfish Immunology, 2015, 45(2): 286-292.
[15] Gao M, Dong Y, Zhang Z, et al. Growth and antioxidant defense responses of wheat seedlings to di-n-butyl phthalate and di (2-ethylhexyl) phthalate stress[J]. Chemosphere, 2017, 172: 418-428.
[16] Dueck T A, Van Dijk C J, David F, et al. Chronic effects of vapour phase di-n-butyl phthalate (DBP) on six plant species[J]. Chemosphere, 2003, 53(8): 911-920.
[17] Howard P H, Printup H T. Handbook of Environmental Degradation Rates[M]. Heather Taub. Boca Raton: CRC Press, 1991.
[18] Weyers A, Sokull-Klüttgen B, Baraibar-Fentanes J, et al. Acute toxicity data: A comprehensive comparison of results of fish, daphnia, and algae tests with new substances notified in the European Union[J]. Environmental Toxicology & Chemistry, 2000, 19(7): 1931-1933.
[19] 邱海源, 王宪. 邻苯二甲酸酯对海洋藻类的致毒效应[J]. 厦门大学学报(自然版), 2005, 44(2): 294-296.
Qiu Haiyuan, Wang Xian. Toxic effects of phthalic esters on algae[J]. Journal of Xiamen University, 2005, 44(2): 294-296.
[20] 迟杰, 董林林, 李金娟. 铜绿微囊藻对DBP和DEHP的富集和降解特性[J]. 天津大学学报(自然科学与工程技术版), 2006, 39(12): 1395-1398.
Chi Jie, Dong Linlin, Li Jinjuan. Characteristics of accumulation and biodegradation of DBP and DEHP inMicrocystisaeruginosa[J]. Journal of Tianjin University(Science and Technology), 2006, 39(12): 1395-1398.
[21] 刘春晓, 王平, 李海燕, 等. DBP对铜绿微囊藻生长和抗氧化酶的影响[J]. 环境科学与技术, 2015, 38(2): 7-12.
Liu Chunxiao, Wang Ping, Li Haiyan, et al. Effects of dibutyl phthalate on growth and enzymatic antioxidants ofMicrocytisaeruginosa[J]. Environmental Science & Technology, 2015, 38(2): 7-12.
[22] 黄博珠, 何瑞, 孙凯峰, 等. 邻苯二甲酸二丁酯对海洋微藻生长的影响[J]. 生态毒理学报, 2016, 11 (2): 292-299.
Huang B Z, He R, Sun K F, et al. Effects of dibutyl phthalate (DBP) on the growth of marine microalgae[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 292-299.
[23] Michael A Borowitzka, Qiang H. 18.Dunaliella: Biology, production, and markets[M]//. A Richmond. Handbook of Microalgal Culture: Applied Phycology and Biotech -nology, Second Edition. Hoboken: John Wiley and Sons, Ltd, 2013: 359-368.
[24] Belghith T, Athmouni K, Bellassoued K. Physiological and biochemical response ofDunaliellasalinato cadmium pollution[J]. Journal of Applied Phycology, 2016, 28(2): 1-9.
[25] Morlon H, Fortin C, Floriani M, et al. Toxicity of selenite in the unicellular green algaChlamydomonasreinhardtii: Comparison between effects at the population and sub-cellular level[J]. Aquatic Toxicology, 2005, 73(1): 65-78.
[26] Jay, A. E. Toxic effects of organic solvents on the growth ofChlorellapyrenoidosaandSelenastrumcapricornutum[J]. Bulletin of Environmental Contamination and Toxicology, 1996, 57(2), 191-198.
[27] Borowitzka L J, Borowitzka M A, Moulton T P. The mass culture ofDunaliellasalinafor fine chemicals: From laboratory to pilot plant[J]. Hydrobiologia, 1984, 116-117(1): 115-121.
[28] Baker C J, Orlandi E W. Active oxygen in plant pathogenesis[J]. Annual Review of Phytopathology, 1995, 33(1): 299-321.
[29] Dong J, Wu F, Zhang G. Influence of cadmium on antioxidant capacity and four microelement concentrations in tomato seedlings (Lycopersiconesculentum)[J]. Chemosphere, 2006, 64(10): 1659-1666.
[30] Benamotz A, Shaish A, Avron M. Mode of action of the massively accumulated β-Carotene ofDunaliellabardawilin protecting the alga against damage by excess irradiation[J]. Plant Physiology, 1989, 91(3): 1040-1043.
[31] Carranco Jáuregui M E, Calvo C M L, Romo F P. Carotenoids and their antioxidant function: A review[J]. Archivos Latinoamericanos De Nutrición, 2011, 61(3): 233-241.
[32] White A L, Jahnke L S. Contrasting effects of UV-A and UV-B on photosynthesis and photoprotection of beta-carotene in twoDunaliellaspp.[J]. Plant & Cell Physiology, 2002, 43(8): 877-884.
[33] 张学成, 孟振, 时艳侠, 等. 光照、温度和营养盐对三株盐生杜氏藻生长和色素积累的影响[J]. 中国海洋大学学报(自然科学版), 2006, 36(5): 754-762.
Zhang Xuecheng, Meng Zhen, Shi Yanxia, et al. The Effect of Light, temperature and nutrition on growth and pigment accumulation of three strains ofDunaliellasalina[J]. Periodical of Ocean University of China, 2006, 36(5): 754-762.
[34] Lamers P P, Janssen M, De Vos R C, et al. Carotenoid and fatty acid metabolism in nitrogen-starvedDunaliellasalina, a unicellular green microalga[J]. Journal of Biotechnology, 2012, 162(1): 21-27.
[35] Sushanta Kumar S, Siobhan M, Patrick M. Effect of macro- and micro-nutrient limitation on superoxide dismutase activities and carotenoid levels in microalgaDunaliellasalinaCCAP 19/18[J]. Bioresource Technology, 2013, 147(8): 23-28.
[37] Liu N, Wen F, Li F, et al. Inhibitory mechanism of phthalate esters onKareniabrevis[J]. Chemosphere, 2016, 155: 498-508.
[38] Li F M, Wu M, Yao Y, et al. Inhibitory effects and oxidative target site of dibutyl phthalate onKareniabrevis[J]. Chemosphere, 2015, 132: 32-39.
[39] Liu W, Ming Y, Li P, et al. Inhibitory effects of hypo-osmotic stress on extracellular carbonic anhydrase and photosynthetic efficiency of green algaDunaliellasalinapossibly through reactive oxygen species formation[J]. Plant Physiology & Biochemistry, 2012, 54: 43-48.
