溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制❋
2018-05-10常志成温海深张美昭李吉方张凯强王晓龙
常志成, 温海深, 张美昭, 李吉方, 李 昀, 张凯强, 王 伟, 刘 阳, 田 源, 王晓龙
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
溶解氧作为维持水生动物生存的基本条件,是影响水生动物生长、呼吸、物质和能量代谢等的重要环境因子[1]。水体周期性低氧和连续性低氧是水产养殖中的常见现象[2],在人类活动的影响下,近岸海域底层水体缺氧现象也呈不断上升趋势[3-4]。而养殖动物在低氧环境下,易引起机体的应激反应,尤其是低氧后突然恢复到常氧状态更易加剧氧化胁迫,导致机体氧化损伤[5]。为避免低氧给机体带来的损伤,鱼类已经形成了较为完备的生理响应,包括增加呼吸效率[6]、增强血氧亲和力[7]、提高血氧循环率[8]、改变代谢率以降低能量消耗[9]等来应对低氧环境。研究低氧条件下鱼类生理水平变化及其应激效应不仅对水产养殖具有指导意义,还可为探讨鱼类适应低氧环境的策略提供参考数据。
花鲈(Lateolabraxmaculatus)俗称海鲈、寨花等,隶属于鲈形目(Perciformes)鮨科(Serranidae)花鲈属(Lateolabrax)[10],是我国重要的海产经济鱼类,在海水、半咸水、淡水或河口地区均可存活与生长[11]。随着花鲈养殖业的快速发展,花鲈在人工育苗[12-13]、繁殖生理以及人工养殖模式[14-15]等方面已经积累了较为丰富的经验。目前关于低氧对水生动物的影响研究主要集中在虾蟹类[16-17]以及部分鱼类[18-20],而低氧对花鲈的生理影响机理鲜有报道。本实验通过研究低氧胁迫与恢复对花鲈幼鱼血液生理生化以及肝脏、鳃和肌肉的氧化应激与能量利用的影响,探讨花鲈对溶氧的适应性,丰富花鲈的生物学与生理学研究内容,为提高花鲈工厂化养殖技术、促进花鲈苗种的选育以及健康养成提供理论支持,以期为花鲈养殖产业的健康发展提供重要的参考依据。
1 材料与方法
1.1 试验鱼种
试验所用花鲈为东营市利津县双瀛水产苗种有限责任公司鱼苗繁育基地繁殖的幼鱼,试验选用体质健壮、活力旺盛的幼鱼进行,试验用鱼体长为(21.43±0.77)cm、体重为(149.20±19.22)g。运回实验室后放置于500 L的塑料圆桶(d=0.8 m,depth=1 m)暂养2周,暂养期间连续充气保持溶氧在7.5~8.0 mg/L,温度保持在19~21℃,盐度30,模拟自然光周期14L∶10D。每天09:00和17:00投饵2次,投饵后清理残饵并换水。试验开始前一天停止投食。
1.2 试验设计
试验在3个500 L的塑料圆桶内进行,开始试验前通过往3个圆桶内连续快速注入氮气来降低溶氧含量,利用YSIDO200溶氧仪来实时监测溶氧量的变化,通过调节注入空气和氮气的多少来维持所需要的溶解氧含量。在溶氧量达到2 mg/L时从暂养桶往试验圆桶内放置约40尾花鲈幼鱼,等花鲈适应10 min后开始计时,此时溶氧含量(1.56±0.24)mg/L。试验分为低氧胁迫与常氧恢复两个阶段,低氧胁迫时间分别为3、6、12和24 h , 常氧恢复时间在低氧胁迫24 h取样后立即进行,复氧时间分别为3和12 h ,恢复常氧后溶氧含量(7.72±0.18)mg/L。
1.3 样品采集与处理
在低氧胁迫与常氧恢复的各时间点进行取样,其中在暂养桶中所取样品作为对照组,每个时间点每个试验桶各采样3尾,将其用放置于MS-222(200 mg/L)的海水中进行快速麻醉,每尾鱼尾静脉采血约2 mL,其中抽取约0.5 mL注入含有0.1 mL EDTA-K2的分子管中制成抗凝血用于测血液生理指标,其余约1.5 mL血液放于4 ℃静置4~8 h,采用12 000 r/min,4 ℃,离心 10 min,取上清血清-20 ℃保存用于测血液生化指标。
采血后快速解剖分别取花鲈的肝脏、鳃、肌肉于1.5 mL离心管中,迅速放置于液氮中,待测。将组织样品在液氮条件下,用杵子研磨成粉末,放置于离心管上并准确称重,按重量体积比 1∶9(g/mL)向样品中加入生理盐水,振荡混匀后采用转速为 2 500 r/min,4 ℃,离心10 min,取上清液,保存于-20 ℃冰箱中,在 1 周内进行相关抗氧化酶指标的测定。
1.4 样品测定
血液生理指标测定采用BS-1800全自动血液细胞分析仪(迈瑞,深圳),测定指标包括红细胞数目(Red blood cell,RBC)、白细胞数目(White blood cell,WBC)、血红蛋白含量(Hemoglobin ,HGB)和血小板数目(Blood platelet,PLT)。血清中的生化指标采用BS-180全自动生化分析仪(迈瑞,深圳)及相配套的试剂盒进行测定,包括总蛋白(Total protein,TP),白蛋白(Albumin,ALB),谷丙转氨酶(Glutamate pyruvic transaminase,ALT),谷草转氨酶(Aspartate transaminase,AST),碱性磷酸酶(Alkaline phosphatase,ALP),乳酸脱氢酶(Lactate dehydrogenase,LDH),总胆固醇(Total cholesterol,TC),甘油三酯(Triglyceride,TG)。
试验测定氧化应激以及能量利用指标,包括超氧化物岐化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)、丙二醛(Malonaldehyde,MDA)、蛋白含量以及糖原、乳酸含量所用试剂盒均采购于南京建成生物工程研究所。
蛋白质浓度的测定采取考马斯亮蓝法,考马斯亮蓝遇蛋白质显现蓝色,在 595 nm 波长处测其吸光度,再转换为蛋白质含量。超氧化物歧化酶采用黄嘌呤氧化酶法测定,在显色剂作用下反应系统呈现紫红色,在450 nm 波长处测定其吸光度,通过公式转化为酶活力值。定义 1 mg 组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD 量为一个活力单位(U)。过氧化氢酶采用钼酸铵法测定,过氧化氢与钼酸铵产生淡黄色的络合物,在405 nm 波长处测定其吸光度,计算转化为酶活力。定义1 mg组织蛋白1s分解1 μmol过氧化氢的量为一个活力单位(U)。谷胱甘肽-S-转移酶是通过检测谷胱甘肽在反应体系前后浓度的变化来测定。定义1 mg组织蛋白,在37 ℃反应1 min扣除非酶促反应,使反应体系中谷胱甘肽浓度降低1 μmol/L为一个活力单位。丙二醛采用硫代巴比妥酸法(TBA)进行测定,反应体系产生红色产物,在 532 nm 波长处测其吸光度,计算转换为丙二醛含量。糖原测定是利用糖原在浓硫酸作用下脱水生成糖醛衍生物,后者再与蒽酮作用形成蓝色化合物,再与此法处理的标准葡萄糖溶液比色定量。乳酸测定是以NAD+为氢受体,LDH催化乳酸脱氢产生丙酮酸,使NAD+转化成NADH。其中PMS递氢使NBT还原为紫色呈色物,呈色物的吸光度在530 nm时与乳酸含量成线性关系。
1.5 数据分析
试验数据用平均值±标准差表示,利用 SPSS 13.0 统计软件进行单因素方差分析(One-way ANOVA)以及 Duncan多重比较检验数据差异的显著性,以P<0.05 为差异显著。
2 结果与分析
2.1 低氧胁迫对花鲈幼鱼血液生理生化指标的影响
表1结果显示,白细胞数目在胁迫6、12和24 h后显著上升(P<0.05),血红蛋白在胁迫3、6、12和24 h后含量显著上升(P<0.05),红细胞数目在胁迫3、6和12 h后显著上升(P<0.05),恢复常氧后均与对照组无显著差异。血小板数目在胁迫3 h后显著上升(P<0.05),其余时间无显著差异。
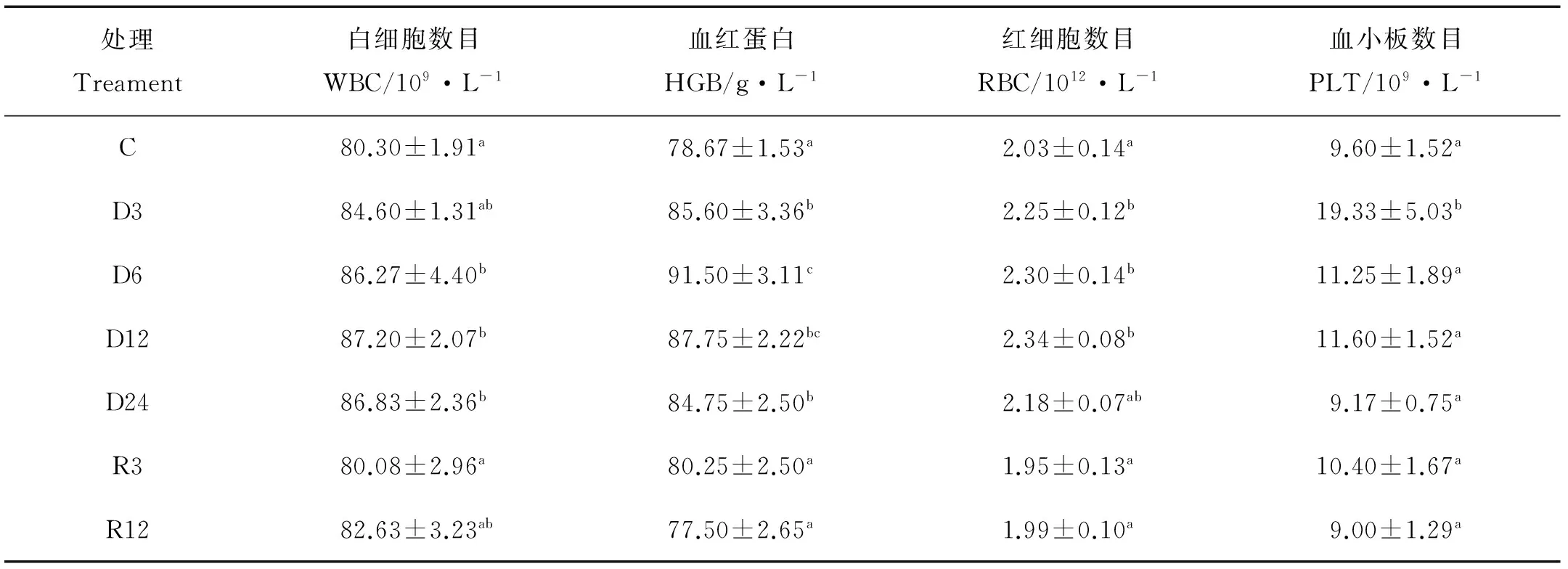
表1 低氧胁迫与恢复对花鲈幼鱼血液生理指标的影响Table 1 Effects of hematological physiology parameters in juvenile Lateolabrax maculatus under hypoxia and recovery
注:C代表对照,D3、D6、D12、D24分别代表低氧胁迫3、6、12和24 h 。R3、R12分别代表胁迫后立即恢复3和12 h。同一列中不同字母上标的数值相互之间差异显著。下同。
Note: C on behalf of the control, D3, D6, D12 and D24, respectively, represent hypoxia stress 3 h, 6 h, 12 h, 24 h. R3 and R12 represent recovery 3 h, 12 h after hypoxia stress. Values with different superscript letters in the same row were significantly different from each other(P< 0.05).The same below.
表2结果显示,低氧胁迫后谷丙转氨酶与谷草转氨酶活力在低氧胁迫3和6 h后显著上升(P<0.05),在胁迫12和24 h以及恢复常氧后与对照组无显著差异。碱性磷酸酶在低氧胁迫后活力有下降趋势,在胁迫6 h后活力显著低于对照组(P<0.05),其他时间点与对照组无显著差异。乳酸脱氢酶活力在低氧3 h后显著上升(P<0.05),在低氧6、12和24 h与对照组无显著差异,在复氧3和12 h后活力又显著高于对照组(P<0.05)。总蛋白、白蛋白与总胆固醇在低氧胁迫12 h后含量显著下降(P<0.05),其余时间无显著差异。甘油三脂在低氧胁迫12 h后含量显著下降(P<0.05),复氧后含量逐渐上升,在复氧12 h后含量显著高于对照组(P<0.05)。
2.2 低氧胁迫与恢复下对肝、鳃、肌组织的氧化应激
表3结果显示,肝组织中,随着胁迫时间的增加,SOD含量逐步增加,在低氧胁迫24 h的SOD含量显著高于低氧胁迫3 h的SOD含量(P<0.05);CAT活力在低氧胁迫阶段没有显著差异,在恢复3 h后活力显著低于初始对照组(P<0.05);GST活力随着低氧胁迫时间的增加而逐步增加,在低氧12和24 h时其活力显著高于对照组(P<0.05),随着复氧时间的增加其活力逐步降低到正常水平,在复氧3 h时活力仍显著高于对照组(P<0.05),在复氧6和12 h差异不显著;肝组织MDA含量在低氧3、6、12和24 h后显著低于对照组(P<0.05),并呈逐渐升高趋势,在复氧3和12 h后其含量仍显著低于对照组(P<0.05)。
鳃组织中SOD活力在低氧胁迫3 h后显著低于初始对照组(P<0.05),在低氧6和12 h后活力显著升高(P<0.05),在24 h后又降低到初始水平,在恢复12 h后含量又显著低于正常值(P<0.05);CAT活力在低氧3和12 h后显著升高(P<0.05),而在复氧3和12 h后活力显著降低(P<0.05);GST活力在低氧3 h时显著高于对照组(P<0.05),在复氧12 h后活力显著低于对照组(P<0.05);MDA含量在低氧3 h和复氧3 h后显著高于对照组(P<0.05),而在其他时间段没有显著差异。
肌组织SOD在低氧12和24 h后活力显著低于初始对照组(P<0.05),复氧后没能恢复到正常水平(P<0.05);肌组织CAT活力在低氧3、6、12和24 h显著低于初始对照组(P<0.05),并呈现逐步降低趋势,在低氧24 h降到最低,复氧3和12 h后活力仍显著低于对照组(P<0.05);GST活力在低氧6 h后显著低于对照组(P<0.05),其他时间无显著变化;MDA含量在低氧6 h后显著高于对照组(P<0.05),而其他时间段也没有显著变化。
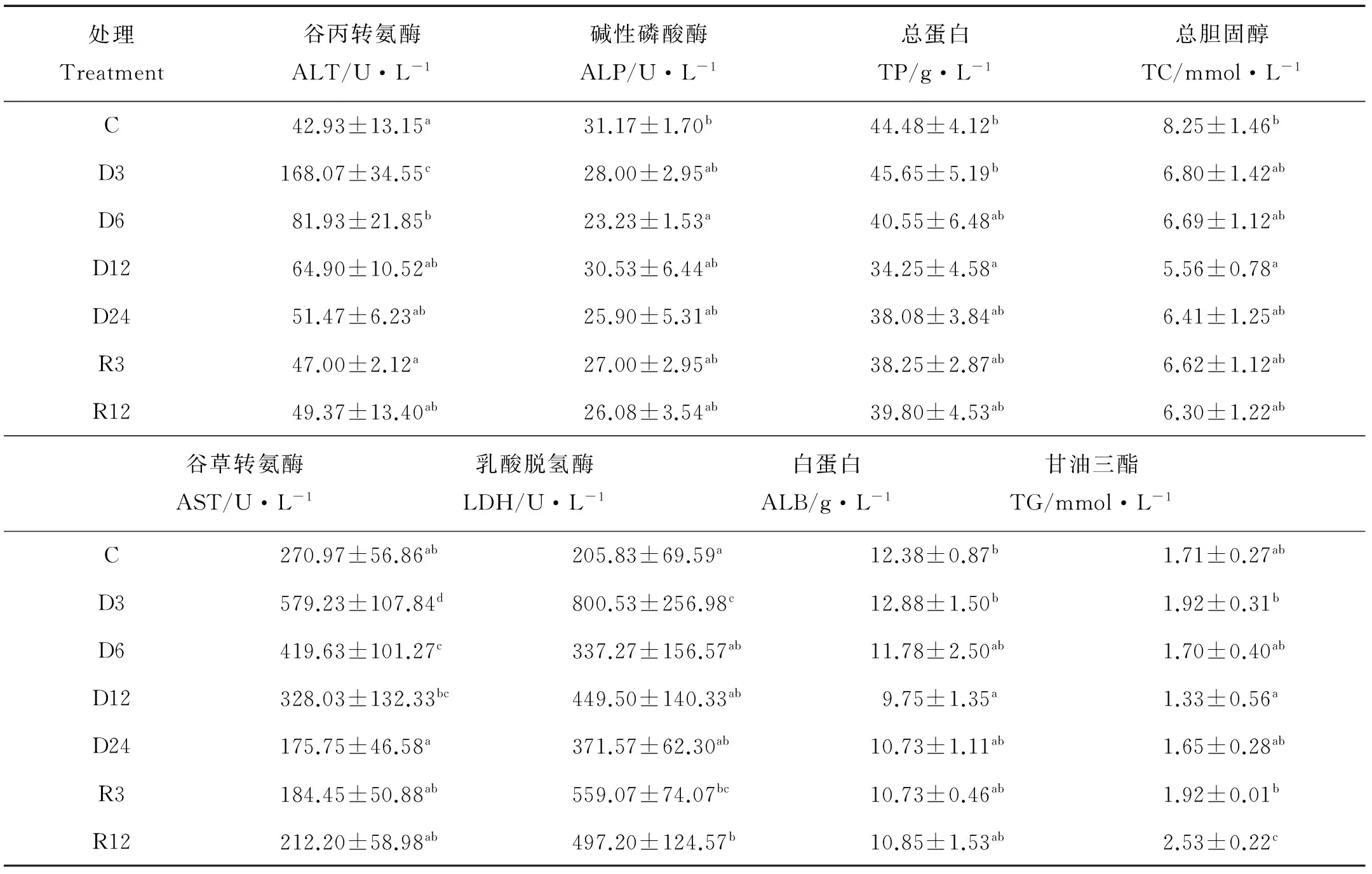
表2 低氧胁迫与恢复对花鲈幼鱼血液生化指标的影响Table 2 Effects of hypoxia and recovery on blood biochemical indexes of juvenile Lateolabrax maculatus
2.3 低氧胁迫与恢复下肝、肌组织能量利用影响
表4结果显示,肝糖原含量在低氧6、12和24 h后显著低于对照组(P<0.05),在复氧3 h后其含量显著升高(P<0.05),而乳酸含量在低氧3 h后显著低于对照组(P<0.05),其他时间点没有显著差异;肌糖原在低氧24 h后含量显著高于对照组(P<0.05),在其他时间段没有明显差异,而乳酸含量在各个时间段中均没有明显差异。
3 讨论
3.1 低氧胁迫对花鲈幼鱼血液生理生化指标的影响
红细胞(RBC)是血液中最主要的成分,主要功能是携带和运输氧气,以满足机体生理活动和运动的需要。血红蛋白(HGB)在血液中是运输氧气的直接载体。本研究中RBC和HGB在低氧时显著上升,这样能够提高对氧的亲和力,提高对氧的输送能力,进而增加对氧的呼吸量来保持稳态,这与在鲫鱼(Carassiusauratus)中的研究结果一致[21]。白细胞(WBC)作为鱼类机体细胞免疫和体液免疫的重要成分,主要作用是保护机体抵御外部和内部的伤害。本研究中WBC在低氧6、12和24 h后显著上升是机体免疫系统对低氧胁迫应答的结果,在低氧3 h未能有显著上升可能是机体先调动其他的防御机制。血小板在正常血液中有较恒定的数量,在止血、炎症反应等生理和病理过程中有重要作用。本试验中PLT在低氧3 h显著上升,之后便下降到正常水平,这说明PLT在低氧胁迫开始时比较敏感,随着胁迫程度加深,其作用可能由其他防御机制所取代。总体来看,低氧胁迫后花鲈血细胞总体上逐渐上升,在复氧后又能够降低到正常水平,这是机体为维持稳态所采取的生理响应机制。
血清中的蛋白质对维持鱼类的生理学和免疫系统功能具有重要作用[22]。总蛋白(TP)能够维持血液正常胶体渗透压与pH值稳定,并与脂肪酸、胆固醇等物质运输以及免疫功能相关[23],白蛋白(ALB)作为营养物质的载体,能为机体提供能量,并且作为机体重要的免疫蛋白,能提高机体的抗病力。本研究TP和ALB均在低氧12 h出现显著下降,这是因为在低氧胁迫下,影响机体的物质代谢和免疫系统,加速蛋白的分解。谷丙转氨酶(ALT)与谷草转氨酶(AST)是是广泛存在于动物细胞线粒体中的重要氨基转移酶,在肝细胞中含量最高,当血清中其活力升高则说明肝功能受到损伤,本试验中ALT和AST在低氧处理后均出现显著上升,说明低氧胁迫对花鲈幼鱼的肝脏损伤较为严重。乳酸脱氢酶(LDH)能在细胞内催化乳酸氧化成丙酮酸,其在组织中的活力大大高于血液中的活力,若血液中LDH活力升高则预示着肝脏、肾脏和肌肉等组织细胞结构发生改变、受到损伤[24],本研究中LDH在低氧3 h显著上升而后又下降到正常水平,说明低氧对组织的损伤较为严重,但可以通过自身调节来修复损伤。碱性磷酸酶(ALP)在生物体内直接参与磷酸基团的转移和代谢过程,对机体内的物质代谢和免疫防护能发挥重要作用[25],ALP在低氧6 h活力显著下降,说明低氧能对花鲈机体免疫系统造成一定程度的破坏。甘油三酯(TG)和总胆固醇(TC)水平受体内蛋白质和脂质代谢的共同影响,本试验中TC和TG均在低氧12 h出现显著下降,这与TP和ALB也在低氧12 h显著下降具有一致性,推测这与机体供能有关,在低氧12 h后鱼体内蛋白质和脂质分解代谢加快,以满足低氧胁迫后对能量的需求。
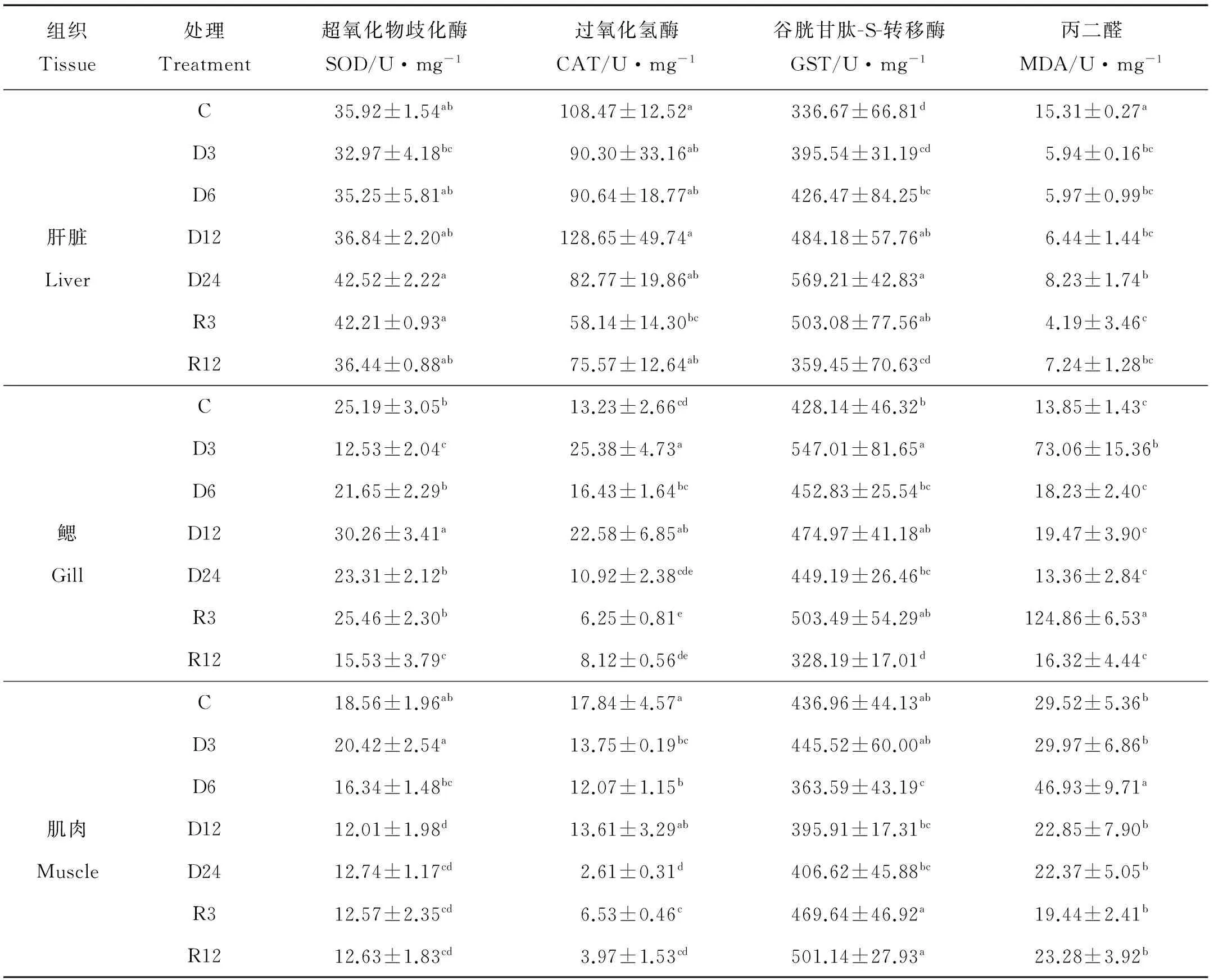
表3 低氧胁迫与恢复对花鲈肝、鳃、肌组织氧化应激的影响Table 3 Effects of hypoxia and recovery on oxidative stress Inliver, gill and muscle tissues of Lateolabrax maculatus
3.2 低氧胁迫对花鲈幼鱼氧化应激的影响
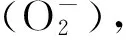
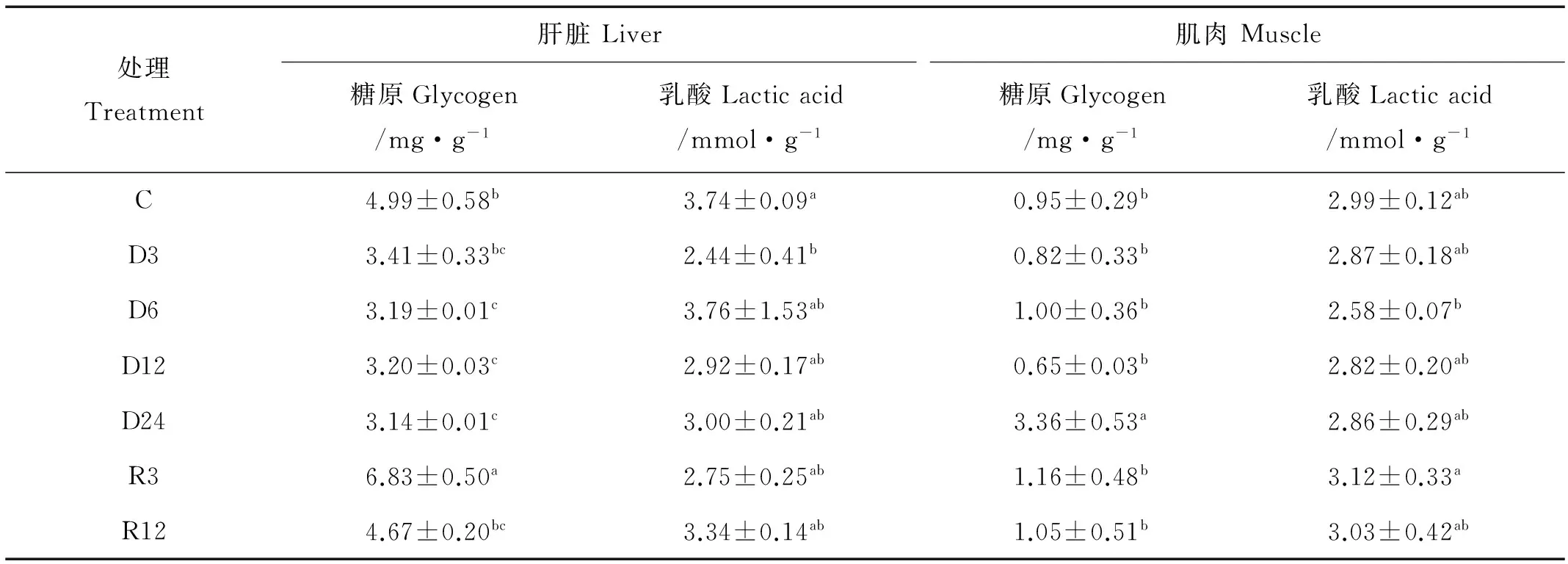
表4 低氧胁迫与恢复对花鲈能量利用的影响Table 4 Effects of hypoxia and recovery on energy utilization of Lateolabrax maculatus
肝组织的SOD和GST活力增加,说明花鲈肝脏在低氧受到损伤,并且发现GST含量变化在肝组织中较为敏感,其可以作为花鲈在应对氧化应激时的酶学指标。肝组织的CAT活力在低氧胁迫时变化不显著以及MDA含量在低氧胁迫时出现下降趋势,这可能与低氧使肝中脂类氧化所产生的过多活性氧(ROS)反过来抑制了酶活性[28]以及肝脏中SOD活力上升有关,SOD清除了大部分的ROS自由基,使得CAT活力变化不显著以及MDA水平有所下降。而在恢复溶氧后,肝脏中的GST活力仍高于对照组,这与鲻鱼(Mugilcephalus)在低氧下的研究结果一致,恢复溶氧后鲻氧化应激反应也较强烈[29],说明花鲈体内的抗氧化防御机制被激活,
鳃组织的SOD活力在开始时显著下降,可能与GST活力升高以及MDA含量升高有关,之后SOD与CAT活力逐渐升高,使得MDA含量恢复到正常水平。在复氧后,SOD、CAT、GST也都恢复到正常水平,说明在恢复溶氧后,鳃中的抗氧化酶失去作用。肌肉中的SOD、CAT、GST活力在低氧胁迫时显著降低,表明肌肉组织中的抗氧化酶发挥的作用有限。但鳃和肌组织中的MDA分别在低氧3 h和低氧6 h后活力显著上升,这与黄颡鱼(Pelteobagrusfulvidraco)的研究中[20]相似,可能由于组织的特异性尽管SOD和GST活力有所上升但其消除过氧化物能力较弱,使得MDA含量仍然上升,这也说明了肝脏中的抗氧化酶的抗氧化能力更高效。
3.3 低氧胁迫对花鲈幼鱼能量利用的影响
由于水生动物利用碳水化合物作为能量代谢底物时,可以获得最高的氧卡系数[32],所以在缺氧时会动用体内的糖原作为能量代谢底物来获得足够的能量。在缺氧胁迫下,鱼类通过急剧降低对能量的需求,利用体内储存的碳水化合物,转化为厌氧代谢模式等方式,能极大延长其在缺氧环境中的存活时间。
糖原为机体内最为重要的供能物质,对维持机体的能量代谢以及重要功能物质的合成有重要作用。而乳酸作为厌氧代谢的一种产物,可以作为评估鱼类低氧耐受能力的一项重要指标[33]。鱼类面临组织缺氧时,通常采用无氧代谢方式满足能量需求[34],与在褐牙鲆(Paralichthysolivaceus)的研究结果一致[19],肝中乳酸在低氧的开始阶段含量显著下降,这可能是乳酸参与了机体的无氧代谢供能,从而使一开始肝中糖原含量没有显著下降,而在之后肝糖原含量在低氧胁迫后逐渐降低,可推测此时由于低氧胁迫使大量肝糖原分解为葡萄糖,用于维持血糖浓度,在复氧后其含量又逐步升高,说明机体已经开始逐步趋于稳态。肌糖原含量在低氧24 h时有所升高且乳酸含量没有变化,可能与肝组织糖原供能已充足,不需要额外的组织供能,可以推测此时肌糖原不参与机体供能,从而使肌肉中积累的乳酸用以转化成糖原。
4 结语
低氧胁迫能够对花鲈机体的生理状态造成显著影响。经历低氧胁迫后的花鲈幼鱼其血液生理生化指标发生显著变化,其不同组织的抗氧化应激能力显著提升,其中肝组织在机体的抗氧化应激防御中发挥了重大作用,肝组织中GST可以作为花鲈在应对氧化应激时的酶学指标。在恢复正常溶氧水平后花鲈的血液生化指标、相关酶的活力和能量供应又能够通过自身的生理调节逐渐恢复到正常水平,说明花鲈具有一定抗逆性,可以进行良种选育。
参考文献:
[1] Wu R S. Hypoxia: From molecular responses to ecosystem responses[J]. Mar Pollut Bull, 2002, 45(1-12): 35-45.
[2] Diaz R J, Breitburg D L. The hypoxic environment[J]. Fish Physiology, 2009, 27: 1-23.
[3] Vaquer-Sunyer R, Duarte C M. Thresholds of hypoxia for marine biodiversity[J]. Proceedings of the National Academy of Sciences, 2008, 105(40): 15452-15457.
[4] Diaz R J. Overview of hypoxia around the world[J]. Journal of Environmental Quality, 2001, 30(2): 275-281.
[5] 李利. 低氧胁迫对日本沼虾呼吸代谢、能量代谢和抗氧化能力的影响[D]. 保定: 河北大学, 2010.
Li L. Effects of Hypoxia Stress on Respiratory Metabolism, Energy Metabolism and Antioxidant Capacity ofMacrobrachiumnipponense[D]. Baoding: Heibei University, 2010.
[6] Randall D. The control of respiration and circulation in fish during exercise and hypoxia[J]. Journal of Experimental Biology, 1982, 100(1): 275-288.
[7] Silkin Y A, Silkina E N. Effect of hypoxia on physiological-biochemical blood parameters in some marine fish[J]. Journal of Evolutionary Biochemistry and Physiology, 2005, 41(5): 527-532.
[8] Gamperl A K, Farrell A P. Cardiac plasticity in fishes: Environmental influences and intraspecific differences[J]. Journal of Experimental Biology, 2004, 207(15): 2539-2550.
[9] Hochachka P W. Oxygen—a key regulatory metabolite in metabolic defense against hypoxia[J]. American Zoologist, 1997, 37(6): 595-603.
[10] 成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 327-332.
Cheng Q T, Zheng B S. Fish System Retrieval of China[M]. Beijing: Science Press, 1987: 327-332.
[11] 温海深, 张美昭, 李吉方, 等. 我国花鲈养殖产业现状与种子工程研究进展[J]. 渔业信息与战略, 2016(2): 105-111.
Wen H S, Zhang M Z, Li J F, et al. Current situation of breeding industry ofLateolabraxmaculatusand development of seed engineering in China[J]. Fishery Information & Strategy, 2016(2): 105-111.
[12] 张美昭, 高天翔, 阮树会, 等. 花鲈人工育苗技术的研究[J]. 青岛海洋大学学报(自然科学版), 2001(3): 339-344.
[13] 谢凤才, 温海深. 花鲈人工繁育关键技术[J]. 现代农业科技, 2012(20): 300-302.
Xie F C, Wen H S. Key techniques of artificial breeding ofLateolabraxmaculatus[J]. Modern Agriculture Science and Technology, 2012(20): 300-302.
[14] 温海深, 钱焜, 张美昭, 等. 花鲈繁殖生理及人工养殖模式探析[J]. 现代农业科技, 2013(5): 281-282.
Wen H S, Qian K, Zhang M Z, et al. Study on reproductive physiology and artificial breeding pattern ofLateolabraxmaculatus[J]. Modern Agriculture Science and Technologgy, 2013(5): 281-282.
[15] 谢凤才, 温海深, 张美昭. 我国海产花鲈繁养现状及淡化养殖技术[J]. 现代农业科技, 2012(19): 267-269.
Xie F C, Wen H S, Zhang M Z. Breeding status and freshwater culture technology ofLateolabraxmaculatusin China[J]. Modern Agriculture Science and Technologgy, 2012(19): 267-269.
[16] 管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响[J]. 河北大学学报(自然科学版), 2010(3): 301-306.
有学者研究发现[10-12],由于利用数字化方法制作,印模无实体模型,可切削瓷块颜色较为单一,技工无法实现在模型上堆加饰瓷,只能依靠外染色调节修复体颜色,所以在颜色匹配方面的满意度仍有欠缺,这也是使用数字化方法修复前牙缺损所面临的比较大的挑战。
Guan Y Q, Li L, Wang H C, et al. Effects of hypoxia on respiratory metabolism and antioxidant capability ofMacrobrachiumnipponense[J]. Journal of Hebei University(Natural Science Edition), 2010(3): 301-306.
[17] 李泽健. 低氧胁迫对中华绒螯蟹能量代谢、呼吸代谢及抗氧化代谢的影响[D]. 保定: 河北大学, 2012.
Li Z J. Effects of Hypoxia Stress on Energy Metabolism, Respiratory Metabolism and Antioxidative Metabolism ofEriocheirsinensis[D]. Baoding: Hebei University, 2012.
[18] 刘旭佳, 黄国强, 彭银辉. 不同溶解氧水平对鲻生长、 能量代谢和氧化应激的影响[J]. 南方水产科学, 2015(4): 88-94.
Liu X J, Huang G Q, Peng Y H. Effect of different dissolved oxygen levels on growth, energy metabolism and oxidative stress ofMugilcephalus[J]. South China Fisheries Science, 2015(4): 88-94.
[19] 李洁, 唐夏, 张灵燕, 等. 溶解氧水平对褐牙鲆幼鱼能量代谢和氧化应激的影响研究[J]. 广西科学院学报, 2015(1): 22-27.
Li J, Tang X, Zhang L Y, et al. Effects of dissolved oxygen levels on energy metabolism and oxidative stress in juvenileParalichthysolivaceus[J]. Journal of Guangxi Academy of Science, 2015(1): 22-27.
[20] 杨凯. 溶氧水平对黄颡鱼生长、代谢及氧化应激的影响[D]. 武汉: 华中农业大学, 2010.
Yang K. Effects of Dissolved Oxygen Levels on Growth, Metabolism and Oxidative Stress ofPelteobagrusfulvidraco[D]. Wuhan: Huangzhong Agriculture University, 2010.
[21] Roesner A, Mitz S A, Hankeln T, et al. Globins and hypoxia adaptation in the goldfish,Carassiusauratus[J]. The FEBS journal, 2008, 275(14): 3633-3643.
[22] Kumar S, Sahu N P, Pal A K, et al. Effect of dietary carbohydrate on haematology, respiratory burst activity and histological changes inL.rohitajuveniles[J]. Fish & Shellfish Immunology, 2005, 19(4): 331-344.
[23] 温海深, 吕里康, 李兰敏, 等. 急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 44-51.
Wen H S, Lv L K,Li L M,et al. Effect of temperature on hematological physiological and biochemical parameters and gene expression in maleSebastesschlegelii[J]. Periodical of Ocean University of China, 2016, 46(11): 44-51.
[24] Bernet D, Schmidt H, Wahli T, et al. Effluent from a sewage treatment works causes changes in serum chemistry of brown trout (SalmotruttaL. )[J]. Ecotoxicology and Environmental Safety, 2001, 48(2): 140-147.
[25] 区又君, 罗奇, 李加儿. 卵形鲳鲹碱性磷酸酶和酸性磷酸酶的分布及其低温保存[J]. 南方水产科学, 2011, 7(2): 49-54.
Ou Y J, Luo Q, Li J E. Distribution and cryopreservation of alkaline phosphatase (AKP) and acid phosphatase (ACP) inTrachinotusovatus[J]. South China Fisheries Science, 2011, 07(2): 49-54.
[26] 熊铧龙. 普安银鲫早期发育中抗氧化能力及Tf基因的表达[D]. 贵阳: 贵州大学, 2015.
Xiong H L. Antioxidant Capacity and Tf Gene Expression in Early Development ofCarassiusauratusgibelio[D]. Guiyang: Guizhou University, 2015.
[27] Aw T Y. Cellular redox: A modulator of intestinal epithelial cell proliferation[J]. Physiology, 2003, 18(5): 201-204.
[28] Lushchak V I, Bagnyukova T V. Hypoxia induces oxidative stress in tissues of a goby, the rotanPerccottusglenii[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 148(4): 390-397.
[29] 熊向英, 黄国强, 彭银辉, 等. 低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响[J]. 水产学报, 2016(1): 73-82.
Xiong X Y, Huang G Q, Peng Y H, et al. Effect of hypoxia on growth performance, energy metabolism and oxidative stress ofMugilcephalus[J]. Journal of Fisheries of China, 2016(1): 73-82.
[30] Lushchak V I, Bagnyukova T V. Effects of different environmental oxygen levels on free radical processes in fish[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 144(3): 283-289.
[31] Lushchak V I, Bagnyukova T V, Lushchak V, et al. Hypoxia and recovery perturb free radical processes and antioxidant potential in common carp (Cyprinuscarpio) tissues[J]. The International Journal of Biochemistry & Cell Biology, 2005, 37(6): 1319-1330.
[32] Jobling M. Fish bioenergetics[J]. Oceanographic Literature Review, 1995, 9(42): 785.
[33] 何伟, 曹振东, 付世建. 温度和低氧对白鲢乳酸与糖水平的影响[J]. 重庆师范大学学报(自然科学版), 2013(5): 27-31.
He W, Cao Z D, Fu S J. Effects of temperature and hypoxia on lactate and carbonhydrate level in silver carp(Hypophthalmichthysmolitrix)[J]. Journal of Chongqing Normal University (Natural science), 2013(5): 27-31.
[34] 朱晏苹, 曹振东, 付世建. 力竭性运动后瓦氏黄颡鱼幼鱼乳酸和血糖变化[J]. 重庆师范大学学报(自然科学版), 2010, 27(2): 14-17.
Zhu Y P, Cao Z D, Fu S J. Muscle lactate and blood glucose levels of juvenile darkbarbel catfish (PelteobagrusvachelliRichardson) in response to exhaustive exercise[J]. Journal of Chongqing Normal University (Natural Science), 2010, 27(2): 14-17.
