移植2枚冻融胚胎发生单卵单胎合并单卵双胎并成功减胎一例
2018-05-09胡卫华姜根风徐庆阳
胡卫华,姜根风,徐庆阳
(皖南医学院第一附属医院弋矶山医院生殖医学中心,芜湖 241001)
近年来,辅助生殖技术(ART)普及应用且不断发展,解决了大部分不孕不育夫妇的生育问题,同时增加了多胎妊娠的发生,双胎最多见,其中大部分是由于多个胚胎移植导致的异卵双胎(dizygotic twins,DZT)。还有一种少见的现象即单卵双胎(monozygotic twins,MZT),是胚胎发育早期的某个阶段单个受精胚胎分裂成两个胚胎的结果。多胎妊娠对母儿均有严重不良影响,其中MZT的产科并发症及不良妊娠结局的风险更高。为降低多胎妊娠率、改善多胎妊娠结局,多胎妊娠减胎术(multifetal pregnancy reduction,MFPR)是首选的补救措施。本文报道1例冻融胚胎移植(FET)周期移植2枚胚胎获三胎妊娠(单卵单胎合并单卵双胎)并成功减一胎的病例,结合文献总结分析多胎妊娠中MZT发生率、不良影响、ART中影响MZT发生的相关因素及治疗。
一、临床资料
患者赵某,28岁,因“FET助孕治疗获宫内三胎妊娠”,要求行多胎妊娠减胎术。BMI 20.70 kg/m2;月经史:初潮13岁,7 d/28~60 d,量中;孕产史:0-0-0-0。患者因“原发性不孕症、多囊卵巢综合征、亚临床甲状腺功能减退、3次人工授精”未获孕于我中心行IVF-ET助孕治疗,长效长方案,形成胚胎7枚,全胚冷冻。患者2016年7月7日行首次FET助孕治疗,自然周期,移植2枚优质胚胎(2枚8CⅠ级胚胎),获宫内3胎妊娠。2016年8月12日我中心阴道超声检查(TVS)提示:宫内三胎妊娠,大小约7~8周,单卵双胎(GS1、GS2)+单卵单胎(GS3)(图1)。
患者坚决要求保留2胎,根据胎儿位置及减胎原则,与患者夫妻协商后决定减灭单卵双胎中的1胎。我中心完善相关检查,于2016年8月18日(移植后6周,孕8+3周)行TVS引导下MFPR,17G双腔COOK取卵针在B超定位下对准目标胎儿——单卵双胎中的1胎(GS2,图1中黑色箭头所指)迅速进针,穿刺心脏部位,确定穿刺针位于胎心后,先加负压300 mmHg,穿刺针塑料导管内无任何吸出物,进一步证实针尖位于胎心内,后改为20 ml注射器人工抽吸,可见管内少许胚芽组织,胚体略缩小,撤去负压检查吸出物,确认为部分胚胎组织,以穿刺针穿入胚体加100~120 mmHg负压,持续1~2 min,通过对胚体的机械破坏导致胎心消失。减胎过程顺利,术后20 min观察GS1、GS3见胎心,GS2未见胎心。术后予黄体支持及抗感染治疗。减胎术后8 d复查TVS示:宫腔内双活胎(三胎减一胎术后)(图2)。患者成功减胎并持续妊娠,2017年2月11日孕33+5周于外院行剖宫产术,术中见2个羊膜囊、2条脐带分别连着2枚部分融合的胎盘,剖宫产分娩2名健康男活婴,体重分别为2 050 g、2 200 g。现母婴情况良好,两男婴外貌特征不相像。

箭头示减胎目标图1 减胎术前TVS影像图
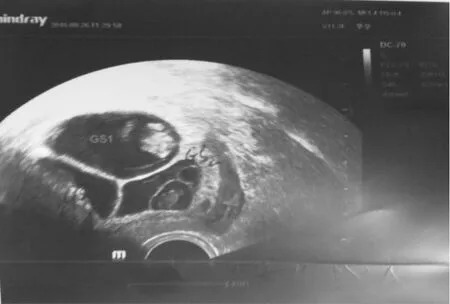
图2 减胎术后8天TVS影像图
二、讨论
多胎妊娠是指一次妊娠子宫腔内同时有2个或2个以上胎儿,双胎最多见,三胎少见。多胎妊娠是促排卵药物及ART应用的主要并发症之一。多胎妊娠的发生率与种族、遗传因素、年龄、产次、内源性促性腺激素及促排卵药物的应用相关。ART助孕患者多胎妊娠率高达30.5%,其中双胎出生率28.9%,三胎或三胎以上出生率1.6%[1]。
双胎妊娠包括异卵双胎(DZT)和单卵双胎(MZT)。DZT的机制和影响因素是众所周知的,主要与遗传因素、卵巢刺激方案及多个胚胎移植等因素相关。MZT发生于一个受精卵分裂成两个单独的胚胎,病因尚不清楚。MZT在自然受孕中非常少见,总发病率仅约0.4%~0.45%[2],同卵三胞胎的发病率更是极为罕见,约0.000023%[3]。1984年Yovich等[4]第一次报道了IVF发生MZT的案例,自那以后,许多研究已证实MZT发生率增加与ART相关。大量的研究表明,ART中MZT发生率是自然受孕的2~12倍[5],ART助孕产生同卵三胞胎也有报道[6]。然而,由于多个胚胎移植和早期胚胎死亡,可能掩盖了MZT实际发生率与ART的相关性。
胎盘情况是MZT妊娠结局的重要影响因素,因为并发症的发生在很大程度上取决于胎盘共享程度。MZT根据胚胎分裂时所处的时期不同,可分为以下4种类型[7]:(1)双绒毛囊双羊膜囊(dichorionic diamniotic,DCDA),双胎有各自的胎盘;(2)单绒毛囊双羊膜囊(monochorionic diamniotic,MCDA),双胎共一个胎盘,但各有各自的羊膜囊;(3)单绒毛囊单羊膜囊(monochorionic monoamniotic,MCMA),双胎共一个胎盘,且处于同一个羊膜囊内;(4)不同程度、不同形式的联体婴儿。在目前的研究中,DCDA、MCDA和MCMA三种类型在MZT中的占比分别为33.3 %、46.7 %和20 %,连体婴儿极为罕见约占1~2 %[8]。
多胎妊娠产科及儿科并发症发生率明显高于单胎妊娠,MZT更是由于并发症的风险显著增加而备受关注。产科并发症包括[9]:恶心呕吐、贫血、妊娠高血压和先兆子痫、羊水过多、胎膜早破及脐带脱垂、胎位异常、胎盘早剥、难产及产后出血的发生率及剖宫产率增加;MZT并发症包括[10]:胎儿生长受限、胎儿发育异常及脐带异常、胎儿早产的发生率、围产儿的发病率和死亡率升高。此外,同卵双胎妊娠特殊的并发症,取决于他们的羊膜性和绒毛膜性。大约9%~15%单绒毛膜双胎会发生双胎输血综合症(Twin-twin transfusion syndrome,TTTS)[11],此外还存在脐带缠绕的危险。随着生育观念的改变,以及我国二孩政策全面放开,高龄不孕症患者比例有明显增加趋势,而高龄女性多胎妊娠风险也显著增高。
近年来ART的日益普及,被认为与MZT发生率增加相关,其增加的确切机制一直有争议。显然,胚胎卵裂的时刻在其中起着重要的作用。然而,目前还没有一个单一的理论可以解释ART助孕治疗后胚胎分裂机制改变导致MZT的发生率增加。以下为目前研究显示ART助孕治疗中可能与MZT发生相关的因素:
1.年龄:各学者对于孕妇年龄对MZT发生的影响有一些分歧。有文献表明,35岁以上孕妇较25岁以下MZT发生率增加12%~22%[12]。然而另有一些学者认为,母亲的年龄和MZT之间没有关联[13]。有研究者提出,随着孕妇年龄的增加,透明带的平均厚度逐渐减小,这可能会改变正常的孵化过程[14],因此认为高龄可能增加MZT的发生率。
2.卵巢刺激:Schachter等[15]报道,使用促排卵药物及IVF中的促性腺激素控制性卵巢刺激和诱导排卵的孕妇,MZT发生率更高。有研究表明,通过诱导排卵的激素刺激卵巢,可导致着床延迟或透明带硬化,可能是MZT增加的原因[16]。
3.透明带:ART中为了提高受精率和着床率以及检测遗传病常应用三种透明带操作技术,包括卵胞浆内单精子注射(ICSI)、辅助孵化(assisted hatching,AH)、以及移植前基因诊断(PGD)。有报告表明透明带的操作增加了MZT的风险[17]。相反,有些研究显示透明带操作与MZT发生率的增加无相关性[18]。
4.温度:有研究已证实,温度波动可影响鱼胚胎发育,增加MZT的发生[19]。在ART中唯一与温度相关的就是胚胎冷冻及解冻复苏。Faraj等[20]曾提到过胚胎冷冻及复苏可能与MZT相关。然而有报道称移植冷冻胚胎与MZT没有关系[21],如果胚胎冷冻复苏可以增加MZT的发生,其可能与透明带硬化直接相关而非温度效应。
5.囊胚移植:由于多胎妊娠风险高,ART必须以提高着床率、减少多胎妊娠率为目标。实现这一目标的方法之一是将部分胚胎体外培养后5~7 d形成囊胚后再行囊胚移植。单囊胚移植的目的是为了实现单胎妊娠,降低多胎妊娠的风险,移植胚胎数目的减少不仅没有降低着床率,且已被证明临床妊娠率高,异卵双胎率可大幅降低[22]。但是越来越多的数据表明,试管婴儿的单卵双胎风险增加,特别是长时间体外培养与囊胚移植后[23]。
6.不利的培养条件:Edwards等[24]研究表明,胚胎体外培养的可以诱发MZT。人类透明带暴露于人工介质中可导致透明带硬化,增加透明带的脆性,体外培养亦可能会干扰细胞间黏附。Cassuto等[25]表明改进培养基可以降低MZT的发病率。
7.其他:自然周期行FET前同房发生多胎妊娠十分罕见,国内未见报道,国外有4例文献报道,且均证实为异卵多胎妊娠:自然周期移植1枚胚胎和自然受孕同时发生造成异卵双胎妊娠2例,异卵四胎妊娠2例[26]。而自然周期行FET前同房发生MZT尚未见报道。
多胎妊娠确诊主要依靠超声检查,由于多胎妊娠的特殊性及复杂性,超声检查容易漏诊及误诊,低估了妊娠风险。因此,孕早、中期,尤其是孕早期,详尽的超声检查极为重要,临床医生必须提高多胎妊娠特别是对于MZT的诊断技术。鉴别单卵双胎合子性的“金标准”是产后的基因检测,而阴道超声可以及早发现多胎妊娠并判断羊膜性及绒毛膜性,以及时行减胎术,降低各种并发症发生率。
卫生部文件(卫科教发[2003]176号)人类辅助生殖技术规范中明确规定,多胎妊娠必须实施减胎术,避免双胎,严禁三胎和三胎以上的妊娠分娩。MFPR是降低多胎妊娠率的首选的安全有效的补救方法。减胎原则为:(1)选择B超影像学上含胚体最小的孕囊;(2)选择最易于穿刺的孕囊;(3)选择接近宫颈位置的孕囊;(4)多胎妊娠中非染色体结构畸形主要发生于单卵双胎,故三胎及三胎以上的多胎妊娠减胎时应首选单卵双胎孕囊,保留单胎[27],可减少保留胎儿染色体异常及畸形发生率。
由于MZT特殊的并发症取决于他们的羊膜性及绒毛膜性,而早期阴道超声难以分辨多胎妊娠孕妇胚胎的绒毛膜性,且80%自然减胎的发生于孕8周左右[28],自然减胎剔除了部分染色体异常的胚胎,因此有人认为应等待至孕8周左右,有一部分患者可自然减胎因而无需施行减胎术。阴道超声判断胚胎的绒毛膜性后实施减胎更安全,减胎后妊娠结局更好。
MFPR常用的途径有经宫颈、经阴道、经腹壁途径,可采用胚体抽吸、机械绞杀及药物注射的方法。特殊的单绒毛膜多胎不可运用药物注射方法,因单绒多胎胎盘间存在丰富的血管吻合支,若只选择其中一胎为被减胎儿,注射的药物可通过血管吻合支进入保留胎儿体内,此外,被减胎儿死亡后,保留胎儿的血液可通过交通支流入死胎,导致活胎失血死亡[29]。
MFPR是必要且安全的。大量研究结果表明[30],减胎术并不增加流产的风险,减胎后孕妇孕期风险降低,妊娠期延长,产科及围生儿并发症发生率降低,MFPR可以明显改善妊娠过程和临床结局。
对单绒毛膜双胎进行减胎,术前需要详实评估B超的情况,与患者夫妇充分沟通,告知继续妊娠及减胎风险,除了感染、出血、减胎失败等常规减胎风险,还有单绒毛膜双胎的特殊风险:因胎盘间存在丰富的血管吻合支,减灭其中一胎可能发生双胎输血综合症(TTTS),影响被保留胚胎血供导致被保留胚胎死亡,需充分知情同意后并签署知情同意书。妊娠早期减胎可选择胚体抽吸及机械绞杀,单卵双胎为单绒毛膜双羊膜囊,且两个胚胎间有一定安全距离者减胎结局好。这对临床医生的操作技术要求极高,需要定位准确、操作迅速、手法轻柔、技术娴熟,尽量减少对被保留胚胎的影响。孕中晚期可选择脐带血流阻断技术完成,目前主要的方式是脐带血管双极电凝和射频消融术。
综上所述,ART增加了多胎妊娠的发生率,与MZT亦有一定相关性。多胎妊娠尤其是MZT,对于母儿均有严重不良影响。对于ART助孕患者,选择性单胚胎或者单囊胚移植与移植2~3枚胚胎的妊娠率无明显差异,且可以降低多胎妊娠发生率[31]。临床医生需不断提高多胎妊娠尤其单卵双胎诊断技术,熟练掌握减胎术操作流程及规范。经ART助孕患者建议常规行早期阴道超声检查,一旦超声诊断多胎妊娠,应判断胚胎的羊膜性及绒毛膜性后,适时行减胎术,可改善多胎妊娠的妊娠过程和临床结局。
【参考文献】
[1] Assisted Reproductive Technology Success Rates.National Summary and Fertility Clinic Reports[R]. National Center for Chronic Disease Prevention and Health Promotion Division of Reproductive Health,2011:11.
[2] Saito H,Tsutsumi O,Noda Y,et al. Do assisted reproductive technologies have effects on the demography of monozygotic twinning?[J]. Fertil Steril,2000,74:178-179.
[3] Imaizumi Y,Nonaka K. Rising trizygotic triplet rates in Japan,1975-1994[J]. Acta Genet Med Gemellol(Roma),1997,46:87-98.
[4] Yovich JL,Stanger JD,Grauaug A,et al. Monozygotic twins from in vitro fertilization[J]. Fertil Steril,1984,41:833-837.
[5] Vitthala S,Gelbaya TA,Brison DR,et al. The risk of monozygotic twins after assisted reproductive technology: a systematic review and meta-analysis[J]. Hum Reprod Update,2009,15:45-55.
[6] Li Y,Yang D,Zhang Q. Dichorionic quadramniotic quadruple gestation with monochorionic triamniotic triplets after two embryos transfer and selective reduction to twin pregnancy: case report[J]. Fertil Steril,2009,92:e13-15.
[7] Benirschke K. The monozygotic twinning process,the twin-twin transfusion syndrome and acardiac twins[J]. Placenta,2009,30:923-928.
[8] Hall JG. Twinning[J]. Lancet,2003,362:735-743.
[9] Reh A,Fino E,Krey L,et al. Optimizing embryo selection with day 5 transfer[J]. Fertil Steril,2010,93:609-615.
[10] Dickey RP. Strategies to reduce multiple pregnancies due to ovulation stimulation[J]. Fertil Steril,2009,91:1-17.
[11] Martin JA,Hamilton BE,Sutton PD. et al. Births: final data for 2005[J]. Natl Vital Stat Rep,2007,56:1-103.
[12] Steinman G. Mechanisms of twinning. Ⅱ. Laterality and intercellular bonding in monozygotic twinning[J]. J Reprod Med,2001,46:473-479.
[13] Skiadas CC,Missmer SA,Benson CB,et al. Risk factors associated with pregnancies containing a monochorionic pair following assisted reproductive technologies[J]. Hum Reprod,2008,23:1366-1371.
[14] Sun YP,Xu Y,Cao T,et al. Zona pellucida thickness and clinical pregnancy outcome following in vitro fertilization[J]. Int J Gynaecol Obstet,2005,89:258-262.
[15] Schachter M,Raziel A,Friedler S,et al. Monozygotic twinning after assisted reproductive techniques: a phenomenon independent of micromanipulation[J]. Hum Reprod,2001,16:1264-1269.
[16] Van der Auwera I,D’Hooghe T. Superovulation of female mice delays embryonic and fetal development[J]. Hum Reprod,2001,16:1237-1243.
[17] Skiadas CC,Missmer SA,Benson CB,et al. Risk factors associated with pregnancies containing a monochorionic pair following assisted reproductive technologies[J]. Hum Reprod,2008,23:1366-1371.
[18] Tarlatzis BC,Qublan HS,Sanopoulou T,et al. Increase in the monozygotic twinning rate after intracytoplasmic sperm injection and blastocyst stage embryo transfer[J]. Fertil Steril,2002,77:196-198.
[19] Stockard CR. Developmental rate and structural expression: An experimental study of twins,‘double monsters’ and single deformities,and the interaction among embryonic organs during their origin and development[J]. Am J Anat,1921,28:115-277.
[20] Faraj R,Evbuomwan I,Sturgiss S,et al. Monozygotic triplet pregnancy following egg donation and transfer of single frozen-thawed embryo[J]. Fertil Steril,2008,89:1260.e9-e12.
[21] Alikani M,Cekleniak NA,Walters E,et al. Monozygotic twinning following assisted conception: an analysis of 81 consecutive cases[J]. Hum Reprod,2003,18:1937-1943.
[22] Thurin A,Hausken J,Hillensjö T,et al. Elective single-embryo transfer versus double-embryo transfer in in vitro fertilization[J]. N Engl J Med,2004,351:2392-2402.
[23] Vitthala S,Gelbaya TA,Brison DR,et al. The risk of monozygotic twins after assisted reproductive technology: a systematic review and meta-analysis[J]. Hum Reprod Update,2009,15:45-55.
[24] Edwards RG,Mettler L,Walters DE. Identical twins and in vitro fertilization[J]. J In Vitro Fert Embryo Transf,1986,3:114-117.
[25] Cassuto G,Chavrier M,Menezo Y. Culture conditions and not prolonged culture time are responsible for monozygotic twinning in human in vitro fertilization[J]. Fertil Steril,2003,80:462-463.
[26] 唐圆圆,刘国霖,滕晓明.移植2枚冻融胚胎后发生3绒毛膜3羊膜囊妊娠1例报道并文献复习[J].生殖医学杂志,2017,26:74-76.
[27] 胡琳莉,黄国宁,孙海翔,等. 多胎妊娠减胎术操作规范(2016)[J]. 生殖医学杂志,2017,26:193-198.
[28] Rodríguez-González M,Serra V,Garcia-Velasco JA,et al. The ‘vanishing embryo’ phenomenon in an oocyte donation programme[J]. Hum Reprod,2002,17:798-802.
[29] 李占娥,孙继美,李红燕.超声引导下选择性妊娠减胎术43例临床分析[J].医学影像学杂志.2009,19:595-598.
[30] 马艳华,邢福琪. 辅助生殖技术与多胎妊娠[J]. 生殖医学杂志,2002,11:250-253.
[31] Practice Committee of the American Society for Reproductive Medicine,Practice Committee of the Society for Assisted Reproductive Technology. Guidelines on number of embryos transferred[J]. Fertil Steril,2009,92:1518-1519.
