蜕膜CXCR6+/-单核-巨噬细胞在人早孕期母胎界面的表型差异
2018-05-09刘倩倩黄煜颜莉莉张鹏张清宇杜美蓉
刘倩倩,黄煜*,颜莉莉,张鹏,张清宇,杜美蓉
(1.青岛大学附属青岛妇女儿童医院,青岛 266000;2.复旦大学妇产科研究所,上海 200000)
人早孕期母-胎界面主要发生三个生理事件:子宫内膜蜕膜化、滋养细胞发育与胎盘形成、母-胎之间的复杂对话。母胎界面形成中,子宫蜕膜聚拢了大量的免疫细胞,参与母胎免疫耐受的形成,其中蜕膜NK细胞(dNK)含量最多,约占50%~70%,蜕膜T细胞(dT)约占10%~15%,蜕膜单核巨噬细胞(dMΦ)约占10%~15%,几乎不含有B细胞[1-2]。与dNK细胞不同的是,dMΦ在整个妊娠过程中数量并不会发生明显的变化[3]。在不同微环境的诱导下单核-巨噬细胞可形成不同的表型,发挥不同的功能。根据表型和功能不同,单核巨噬细胞主要分为两型即经典M1型巨噬细胞,主要表达共刺激分子CD80和CD86,可分泌TNF-a、IL-8等大量的促炎性细胞因子,影响母胎界面滋养细胞的侵袭,不利于胎盘的植入和妊娠的维持[4-5]。在正常母胎界面偏向于分化为非经典的M2型巨噬细胞,主要表达表面分子CD206,可释放大量的抗炎细胞因子如IL-10,抑制母体的免疫反应,参与免疫耐受,有利于妊娠的维持[6-8]。
我们课题组前期研究发现人早孕滋养细胞可以分泌高水平CXCL16,通过与其唯一受体CXCR6相互作用选择性的招募外周单核细胞聚集到蜕膜局部并且保持稳定,从而促进自身的生长和侵袭;然而这些被募集而来的CXCR6+巨噬细胞在蜕膜局部的表型与功能如何,目前仍不明确[9]。因此在前期工作的基础上,我们采用流式细胞术对正常早孕组和自然流产组妇女CXCR6+/-dMΦ的表型进行分析,揭示其在母胎免疫耐受中可能的作用机制。
材料和方法
一、材料
1.实验标本: 于上海复旦大学附属妇产科医院门诊手术室选择正常早孕期(6~10周)行人工流产的患者40例及早孕期无明确原因自然流产患者20例。
正常早孕组的收集标准:20~35岁计划外妊娠;术前无感染、发热等其他基础疾病。不明原因发生自然流产患者的收集标准:20~35岁,排除染色体异常、生殖道畸形、发热等其他疾病。
本研究经过伦理委员会批准,取得患者知情同意后,收集蜕膜组织于DMEM/F12培养液中,1 h内带回实验室进行细胞分离。
2.实验试剂:DMEM/F12培养液、PBS、RPMI 1640培养液(Gibco,美国);Percoll分离液,Collagenase Ⅳ(Sigma,美国);DNase I(Applichem,德国);流式抗体(Biolend,美国):APC anti-human CXCR6、FITC anti-human CD14、BV421 anti-human CD45、PE anti-human CXCR6、PE/CY7 anti-human CD80、CD206。
二、实验方法
1.分离蜕膜免疫细胞群(DIC):将收集到的蜕膜组织置于100 mm的培养皿中,PBS充分洗涤,去除血块,将组织充分剪碎(约1 mm×1 mm×1 mm),吸入50 ml离心管中,加入0.1 % DNase I及0.1% Collagenase Ⅳ,放入37℃摇床震荡消化30~40 min。将消化后的组织依次经过100目、300目、400目的滤网过滤,收集滤液,1 500 rpm离心8 min,去上清液,将细胞重悬于2 ml RPMI 1640细胞培养液中,然后平铺于20%、40%、60% 3个梯度的Percoll分离液上,2 500 rpm离心20 min。40%~60%密度区域的细胞即为分离的蜕膜免疫细胞群,将细胞洗涤并重悬于DMEM/F12培养液中备用。
2.流式细胞术(FCM)检测dMΦ表面分子的表达:将分离的蜕膜免疫细胞用PBS充分洗涤后,根据样本的细胞数和抗体推荐用量加入CXCR6、CD45、CD14及表面分子CD80、CD206流式抗体,4℃避光孵育30 min,充分洗涤后加入适量PBS重悬,采用Beckman流式仪(型号CyAn ADP)检测,Flowjo 7.6.1对结果进行处理分析。
三、统计学处理

结 果
一、双色荧光标记分析dMΦ两组在DIC中的占比
采用CD45、CD14标记dMΦ,首先对蜕膜免疫细胞群“开窗”于CD45+细胞群(图1A),分析其CD14的标记情况(图1B)。流式结果分析显示,不明原因自然流产组CD14+dMΦ在DIC中所占比例为(9.9±1.63)%,正常早孕期组CD14+dMΦ在DIC中所占比例为(8.9±0.88)%,两组差异并无显著性(P>0.05)(图1C)。
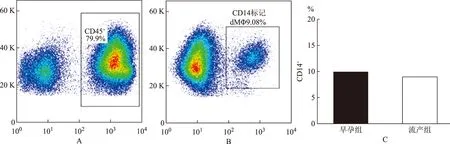
A: CD45标记dMΦ的流式细胞分析散点图;B: CD14标记dMΦ的流式细胞分析散点图;C:两组dMΦ在DIC中占比统计图图1 正常早孕组和不明原因自然流产组妇女蜕膜单核-巨噬细胞在蜕膜免疫细胞群中的占比
二、三色荧光标记分析正常早孕组和不明原因自然流产组CXCR6+在dMΦ中的表达情况
图2是流式细胞分析散点图。其中双阳细胞为CD14+CXCR6+的dMΦ,在正常早孕组及不明原因自然流产组中均有表达。正常早孕期组中,CD14+CXCR6+在dMΦ的表达率为(40.0±1.90)%;不明原因自然流产组中,CD14+CXCR6+在dMΦ的表达率为(31.22±2.38)%,两组比较差异显著(P<0.05)。
三、多色荧光流式细胞术分析比较两组蜕膜组织中CD14+CXCR6+/-dMΦ的表型差异
结果显示:正常早孕组和不明原因自然流产组中,M2型巨噬细胞表面分子CD206在CD14+CXCR6+dMΦ中表达率较CD14+CXCR6-dMΦ均显著增高(P<0.05),且CD206在正常早孕组CD14+CXCR6+dMΦ和CD14+CXCR6-dMΦ中的表达均显著高于不明原因自然流产组(P<0.05);正常早孕组中,M1型巨噬细胞表面分子CD80在CD14+CXCR6+dMΦ中表达率显著高于CD14+CXCR6-dMΦ(P<0.01),而自然流产组中,CD80在CD14+CXCR6+dMΦ和CXCR6-dMΦ的表达率并无显著性差异(P>0.05)。正常早孕组和不明原因自然流产组相比,CD80在两组CD14+CXCR6+dMΦ的表达无显著性差异(P>0.05),在正常早孕组CD14+CXCR6-dMΦ中的表达显著低于不明原因自然流产组(P<0.01)(图3)。

A: 两组CXCR6+在dMΦ中均有表达流式细胞分析散点图;B:CD14+CXCR6+在dMΦ的表达率统计结果图;两组比较,*P<0.05图2 流式三色荧光标记分析正常早孕组和不明原因自然流产组CD14+CXCR6+在dMΦ的表达情况

A:正常早孕组和不明原因自然流产组中CD206 在CD14+CXCR6+dMΦ表达率;B:正常早孕组中CD80在CD14+CXCR6+dMΦ表达率;两组比较,*P<0.05,**P<0.01图3 正常早孕期与不明原因自然流产组CD14+CXCR6+/-dMΦ的表型比较
讨 论
正常妊娠的过程中,母胎界面的细胞免疫即Th1型免疫反应下调,体液免疫即Th2免疫反应占优势,形成了特殊的免疫耐受环境,对于成功妊娠具有重要作用[10]。单核细胞可从外周迁移到蜕膜局部,分化为巨噬细胞在蜕膜局部大量聚集,通过与滋养细胞和调节性T细胞相互作用,释放大量的IL-10、IL-8、PGE2等细胞因子参与母胎免疫耐受的建立,调节子宫内膜蜕膜化、胚胎的植入和胎盘发育的全过程[11]。本实验发现,对比正常早孕组和不明原因自然流产组,dMΦ的数量并没有明显的变化,可能由于单核-巨噬细胞免疫功能发生改变,呈现高度易激活状态,使母体对胎儿产生强烈的排斥反应,最终导致流产的发生。
近年来,人们发现多种趋化因子及其受体是调节免疫应答的重要分子,对 Th1/Th2 型细胞因子的分化、极化及Th1/Th2 型细胞因子的免疫平衡的调节具有重要作用[12]。CXCR6是目前已知趋化因子CXCL16的唯一受体,在本实验中,相对于正常早孕期组,不明原因自然流产组蜕膜组织中CXCR6+dMΦ在蜕膜的局部的聚集明显减少,提示CXCR6+dMΦ可能在维持早孕期的母胎界面正常妊娠中发挥重要作用。
普遍认为,蜕膜免疫细胞可通过独特的表型和分泌大量的细胞因子参与滋养细胞的增殖、侵袭、和分化,从而在母胎界面形成了独特的免疫耐受微环境[13]。在外周血单核细胞中,80%分化为具有较强抗原提呈功能的经典M1型单核-巨噬细胞,而在正常早孕期母胎界面蜕膜免疫细胞中单核-巨噬细胞在可溶性HLA-G5及细胞因子IL-4、IL-13、IL-10和M-CSF的诱导下更趋向于分化为具有免疫抑制作用的非经典M2型巨噬细胞[3]。有研究发现,在某些肿瘤微缺氧环境中,CXCR6的表达水平与组织局部M2型单核细胞的表达呈正相关,CXCL16/CXCR6可介导单核-巨噬细胞在肿瘤组织中的活性,并且使其更趋向于分化为具有免疫抑制作用的M2型巨噬细胞,参与肿瘤的血管生成和转移[14]。在正常早孕期母胎界面也存在着类似于肿瘤的缺氧微环境,影响着滋养细胞的侵袭和子宫螺旋动脉的生成[15]。我们通过实验发现 M2型巨噬细胞表面标志分子CD206在正常早孕期和不明原因自然流产妇女CXCR6+dMΦ中的表达都要显著高于CXCR6-dMΦ,这提示在早孕期母胎界面CXCR6可介导单核-巨噬细胞趋向于分化为M2型巨噬细胞。同时实验还发现M1型巨噬细胞表面分子CD80在正常早孕期妇女CXCR6+dMΦ中的表达高于CXCR6-dMΦ,而在不明原因自然流产妇女CXCR6+/-dMΦ的表达水平无明显差异,提示CXCR6与母胎界面促炎性M1型巨噬细胞在不明原因自然流产中的高度聚集相关。
由此可见,CXCR6不仅参与募集和吸引母体外周血免疫细胞到达并停留于妊娠子宫,还可能对局部的免疫细胞产生诱导效应,维持M1/M2型巨噬细胞达到一定比例的动态平衡。我们实验还发现,在不明原因自然流产妇女CXCR6+dMΦ中,M2型巨噬细胞比例降低,M1型巨噬细胞在CXCR6-dMΦ中的比例升高,更验证了CXCR6可能参与了早孕期M2型巨噬细胞在蜕膜组织中的形成和分化及蜕膜局部TH2型免疫偏倚的形成,当不明原因自然流产反复发生时,CXCR6的表型和功能特性也会发生改变,从而改变母胎界面的免疫微环境,打破免疫耐受的平衡状态。
总之,在不明原因自然流产中,蜕膜单核-巨噬细胞数量比例并未发生明显变化,CXCR6可能通过介导单核-巨噬细胞的分化,影响母胎界面免疫耐受,此发现为预防和治疗复发性流产提供了新的思路,但其相关功能特性,影响机制和通路还需进一步的实验研究。
【参考文献】
[1] Xu YY,Wang SC,Li DJ,et al. Co-signaling molecules in maternal-fetal immunity[J]. Trends Mol Med,2017,23:46-58.
[2] 黄煜,李大金,朱影.三色荧光标记鉴定早孕蜕膜及外周免疫细胞组成[J].生殖医学杂志,2006,15: 328-332.
[3] Tsai YC,Tseng JT,Wang CY,et al. Medroxyprogesterone acetate drives M2 macrophage differentiation toward a phenotype of decidual macrophage[J]. Mol Cell Endocrinol,2017,452:74-83.
[4] Ning F,Liu H,Lash GE. The role of decidual macrophages during normal and pathological pregnancy[J]. Am J Reprod Immunol,2016,75:298-309.
[5] 唐茂兴,廖爱华.单核细胞亚群与妊娠[J].中国免疫学杂志,2014,30:717-721.
[6] Houser BL,Tilburgs T,Hill J,et al. Two unique human decidual macrophage populations[J]. J Immunol,2011,186:2633-2642.
[7] Kalish SV,Lyamina SV,Usanova EA,et al. Macrophages reprogrammed in vitro towards the M1 phenotype and activated with LPS extend lifespan of mice with ehrlich ascites carcinoma[J]. Med Sci Monit Basic Res,2015,21:226-234.
[8] Yamaguchi T,Fushida S,Yamamoto Y,et al. Tumor-associated macrophages of the M2 phenotype contribute to progression in gastric cancer with peritoneal dissemination[J]. Gastric Cancer,2016,19:1052-1065.
[9] Huang Y,Zhu XY,Du MR,et al. Human trophoblasts recruited T lymphocytes and monocytes into decidua by secretion of chemokine CXCL16 and interaction with CXCR6 in the first-trimester pregnancy[J]. J Immunol,2008,180:2367-2375.
[10] Piao HL,Tao Y,Zhu R,et al. The CXCL12/CXCR4 axis is involved in the maintenance of Th2 bias at the maternal/fetal interface in early human pregnancy[J]. Cell Mol Immunol,2012,9:423-430.
[11] Svensson-Arvelund J,Mehta RB,Lindau R,et al. The human fetal placenta promotes tolerance against the semiallogeneic fetus by inducing regulatory T cells and homeostatic M2 macrophages[J]. J Immunol,2015,194:1534-1544.
[12] 于洁,黄煜,崔竹梅,等.趋化因子CXCL16对人早孕蜕膜免疫细胞的迁移及分泌细胞因子的调节作用[J].现代免疫学,2009,3:235-239.
[13] 朱晓勇,李大金.母胎免疫调节机理的研究进展[J].生殖医学杂志,2000,9: 56-60.
[14] Cho SW,Kim YA,Sun HJ,et al. CXCL16 signaling mediated macrophage effects on tumor invasion of papillary thyroid carcinoma[J]. Endocr Relat Cancer,2016,23:113-124.
[15] 罗健英,乔福元.缺氧对细胞滋养细胞MMP9/TIMP1基因表达及细胞侵袭力的影响[J].华中科技大学学报(医学版),2010,39:216-220.
