乳腺癌肿瘤干细胞体外培养体系的建立
2018-05-09许保海崔熠张瑶楠郭永王乾兴
许保海,崔熠,张瑶楠,3,郭永,3*,王乾兴
(1.遵义医学院细胞生物学教研室,遵义 563003;2.国家卫生计生委科学技术研究所,北京 100081,3.国家卫生计生委男性生殖健康重点实验室,北京 100081)
乳腺癌肿瘤干细胞是乳腺癌组织中极少数具自我更新和多向分化能力的细胞,该细胞具有化疗、放疗及低氧抵抗性,同时具有高致瘤性、高侵袭转移性。乳腺癌干细胞理论为根治乳腺癌开辟了新的治疗途径。传统的体外研究肿瘤细胞是在二维条件下进行的,这种二维细胞培养方式比较方便,为大多数研究者所接受。但是传统的二维平面培养体系采用单层细胞贴壁培养技术实现细胞体外的增殖,细胞的基因表达、信号转导和形态学都与体内存在着差异[1]。三维培养与传统的二维培养相比可以为细胞提供更类似于体内的三维空间环境和胞外基质环境,而且避免了体内实验影响因素多、周期长的问题。在本研究中,我们拟以胶原作为原料的三维支架,建立一种可以避免细胞培养中心因为缺乏氧气、营养而凋亡的乳腺癌三维培养体系。在此三维体系中,通过乳腺癌肿瘤干细胞在胶原材料上的形态学特征、增殖情况,以及乳腺癌肿瘤干细胞标志CD44+/CD24-/low的表达等方面评价,为深入探讨乳腺癌肿瘤干细胞的发生发展以及三维培养为基础的抗肿瘤药物的药敏试验平台提供技术保障。
资料与方法
一、实验材料
1. 细胞系:乳腺癌细胞系MCF-7购自中国医学科学院基础医学研究所基础医学细胞中心。MCF-7细胞用含10%胎牛血清(FBS)的RPMI 1640培养基,37℃、5%CO2、饱和湿度的细胞培养箱中培养。
2. 主要试剂:RPMI 1640培养基、胎牛血清(FBS)、0.25%胰蛋白酶、PBS缓冲液(GIBCO,美国);Rat CD44 Monoclonal Antibody(IM7) APC、Mouse CD24 Monoclonal Antibody(eBioSN3(SN3 A5-2H10)) PE、Mouse IgG1 kappa Isotype Control PE、Rat IgG2b kappa Isotype Control APC(Ebioscinece,美国);三维培养支架材料由中科院遗传与发育生物学研究所再生医学研究组戴建武研究员赠予。
二、实验方法
1.实验分组:根据不同的培养方法分为两组。二维细胞培养组:采用传统二维细胞培养方法培养MCF-7细胞;三维细胞培养组:将MCF-7细胞接种于三维支架材料上培养。
2.细胞三维培养体系[2]:将乳腺癌细胞系MCF-7加入0.25%胰蛋白酶+0.02% EDTA溶液,37℃消化1 min,然后用培养基吹打,制备成单细胞悬液,1 000 rpm,离心5 min,弃掉上清,用培养基稀释细胞到相应浓度。将细胞悬液滴加到预先处理好的三维支架材料上,37℃培养1 h,然后再加入细胞培养基,并在培养箱中静置培养。静置培养24 h后更换培养基,并将三维细胞材料转移到培养箱中的小摇床上培养,摇床转速控制在50~60 rpm,每天换一次培养基。
3.激光共聚焦显微镜(Confocal)观察法:将培养有MCF-7细胞的三维培养材料取出,室温下用PBS清洗3次,5 min/次,在避光的环境下加入200 μg/ml的荧光素双醋酸酯(FDA)浸染1.5 min,避光用PBS清洗3次,5 min/次,放到盖玻片上,在Confocal荧光显微镜(ZEISS LSM710,德国)下观察。
4.细胞増殖实验:将细胞进行消化、收集、重悬,使用96孔板每孔加入100 μl(含 3 000个细胞),置于37℃、5%CO2培养箱中培养;24 h后每孔再加入10 μl CCK-8溶液,在细胞培养箱内继续培育1 h;在450 nm波长测定各组各个复孔的吸光度(OD值)。平均值为各孔的校正吸光度值。培养时间为横坐标,OD值为纵坐标,绘制细胞增殖曲线。
5.流式细胞术:先用胰酶消化MCF-7细胞,细胞计数后取5×106~1×107个细胞/ml,1 000 rpm,4℃离心10 min,弃上清;加入1 ml冷的PBS,轻轻震荡使细胞悬浮;1 000 rpm,4℃离心10 min,弃上清;PBS重复洗涤细胞两次;将细胞重悬于100 μl结合缓冲液(Binding Buffer),加入5 μl Rat CD44 Monoclonal Antibody APC抗体和0.3 μl Mouse CD24 Monoclonal Antibody PE轻轻混匀,4℃ 避光孵育 40 min,每10 min混匀一次;对照组为同性对照抗体Mouse IgG1 kappa Isotype Control PE、Rat IgG2b kappa Isotype Control APC。上述细胞均用PBS洗涤2次,离心,弃上清液,用300 μl PBS重悬,再流式细胞检测仪上检测。
三、统计学处理

结 果
一、三维培养乳腺癌肿瘤干细胞形态特性
将三维培养的MCF-7细胞,通过胶原酶消化1.5 h后,1 000 rpm离心5 min收获细胞,将其再次二维培养,观察其在二维条件下的细胞形态特性,并与二维条件培养的对照细胞进行比较,结果如下:在二维条件下,MCF-7细胞平展地粘附在塑料培养板上,呈多边形、铺路石样的上皮细胞形态(图1A);将细胞接种到三维支架材料上培养7 d后,再次将细胞二维培养,细胞展现出三角形或者长梭形,还有很多不规则形态,部分细胞还伸展出长浸润性伪足(图1B)。
二、激光共聚焦显微镜观察MCF-7在三维支架材料上的生长状态
结果显示,MCF-7细胞(绿色荧光,FDA染色)均匀地生长在三维支架材料上(图2 A、B、C)。局部放大后发现,MCF-7细胞生长在三维支架材料上的细胞形态不同于二维培养的细胞形态,清晰可见长伪足,且细胞大小不均一,细胞形态多样(图2D)。

A: 二维培养MCF-7细胞;B:三维培养MCF-7细胞再次二维培养图1 MCF-7细胞形态学观察(×100)

A:绿色荧光(×100);B:明场;C:Merge;D:绿色荧光(×630)图2 MCF-7细胞在三维支架材料上的生长状态
三、三维培养乳腺癌肿瘤干细胞增殖特性
体内实体肿瘤细胞具有持续增殖能力,而二维培养的肿瘤细胞出现接触性抑制现象,与实体瘤细胞生命特征不相符。本实验用CCK-8细胞增殖检测法绘制生长曲线(图3)。二维培养条件下,MCF-7细胞持续增殖到第3 天后进入平台期,而三维培养后的细胞再次二维培养,细胞持续增殖到第4天进入平台期,但三维培养后的细胞增殖速度与二维培养的细胞无显著差异(P>0.05)。
四、流式细胞检测乳腺癌干细胞相关亚群CD44+/CD24-/low的比例
分别对乳腺癌细胞系MCF-7二维培养及三维培养7 d后,通过流式细胞术检测比较不同培养条件下肿瘤细胞群体中肿瘤干细胞所占比例。结果显示,MCF-7细胞三维培养7 d后,CD44+/CD24-细胞所占比例增加,由38.9%增加至60.3%。结果提示,三维培养条件能提高乳腺癌干细胞CD44+/CD24-群体比例(图4)。

图3 CCK-8细胞增殖实验
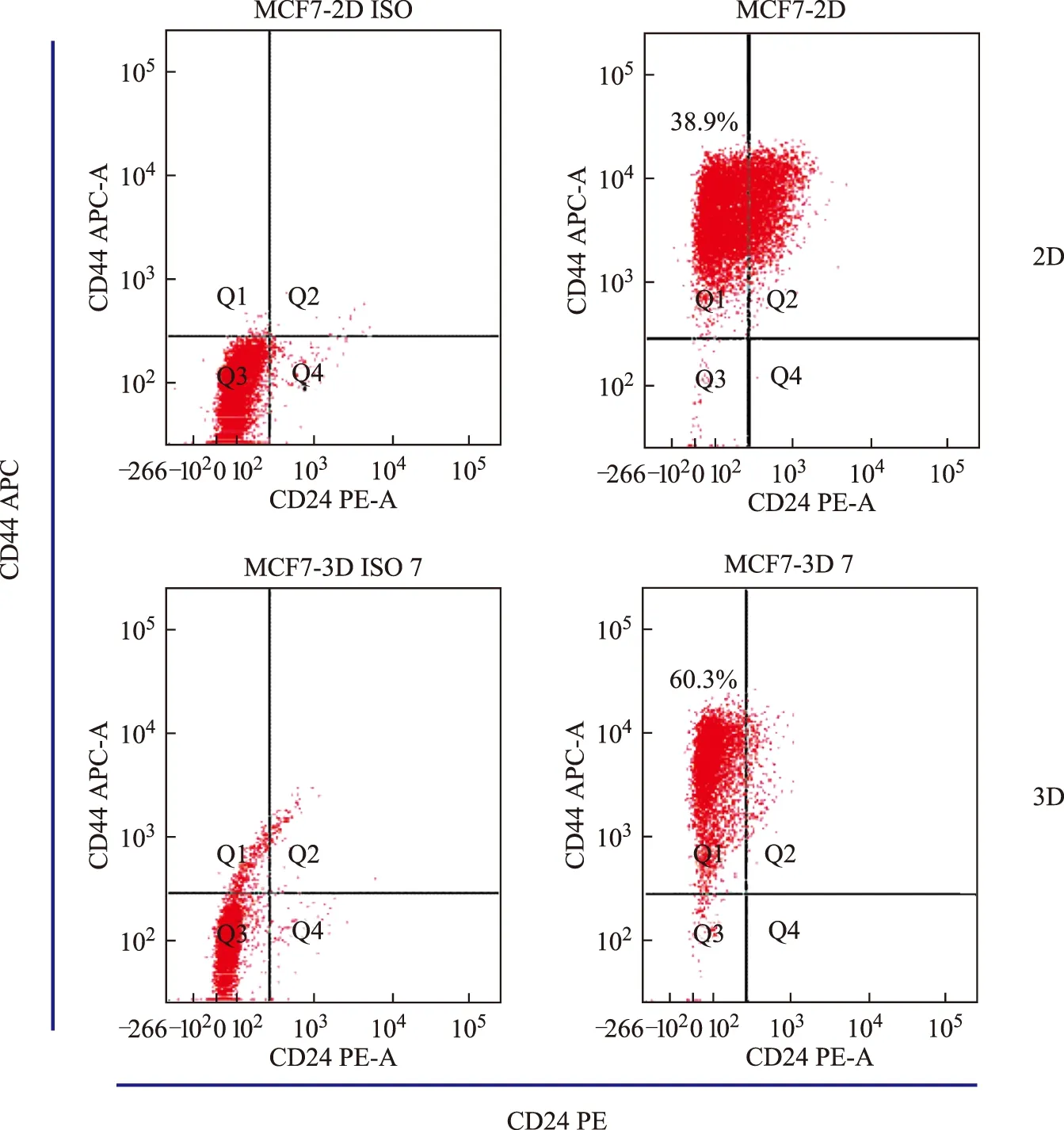
图4 流式细胞仪检测细胞CD44+/CD24-/low的含量
讨 论
乳腺癌是女性最常见的恶性肿瘤之一,其发病率和死亡率均居全世界女性肿瘤首位,且乳腺癌发病率呈上升趋势[3]。全球每年大约有20 万患者死于乳腺癌的复发、转移,大约占每年新发乳腺癌患者的20%[4]。传统疗法如放疗和化疗能够消除肿瘤肿块,但对少数具有恶性作用的肿瘤细胞仍然不能起到完全杀死的作用,这些恶性肿瘤细胞仍然能够存活并自我更新,进一步发展为恶性肿瘤,这一类细胞就叫做肿瘤干细胞(cancer stem cells,CSCs),在维持肿瘤生长、血管生成及促进肿瘤侵袭转移中起决定性作用。到目前为止,已在白血病、胶质瘤、前列腺癌、胃癌和肝癌等恶性肿瘤中发现了肿瘤干细胞的存在[5-9]。
已有研究表明,乳腺癌中的确存在CSCs,CSCs表现出的自我更新、分化能力和放化疗抵抗等干性特征是肿瘤复发或转移的主要因素[10-11]。2003年Al-Hajj等[12]首次在乳腺癌标本中分离出乳腺癌干细胞,发现几百个Lin-CD44+CD24-/lowESA+细胞在NOD/SCID小鼠中就可以形成肿瘤。2007年,Ginestier等[13]发现乳腺癌组织中高表达ALDH1的细胞也具有 CSCs特性。2011年,Golebiewska等[14]发现乳腺癌干细胞表现出可以明显增加经过ABCG2(可导致药物抵抗的主要因子)介导的Hoechst染色的“侧群细胞”(SP)的数量。因此,利用乳腺癌干细胞的特征消除乳腺癌干细胞,为化疗抵抗、转移和复发的乳腺癌病人提供一个新的治疗方法[15],就需要我们深入研究乳腺癌干细胞的自我更新和分化演变的生物学机制。
目前,传统的体外研究肿瘤细胞都是在二维环境下进行的,与体内微环境存在着差异,例如细胞增殖、细胞的基因表达、信号转导和形态学等方面均存在差异。有研究发现,在食管癌细胞的三维培养中发现,二维培养的细胞并不表达Claudin-7,而在三维条件下,细胞却高表达Claudin-7和Claudin-4,这种蛋白在体内的恶性肿瘤中是高表达的,与肿瘤细胞的迁移有直接关系。将口腔鳞癌上皮细胞接种到三维材料上培养一段时间,细胞不再是上皮样形态,而是更接近成纤维样,同体内转移肿瘤分离的细胞类似[16]。因此,二维环境下培养的肿瘤细胞不能有效地模拟肿瘤细胞在体内的生存状况。另外,体内进行的动物实验研究周期较长,成本较高,而且由于体内多种因素的制约及体内和外界环境的相互影响往往使动物实验结果变得复杂化。因此,无论是传统的二维培养还是动物学实验,在乳腺癌干细胞研究中都具有一定的局限性。
越来越多的研究者开始将三维培养用于临床前药物体外筛选、肿瘤干细胞维持和分化、信号异常转导等肿瘤基础领域的研究[17-19]。三维培养在少见恶性肿瘤的临床前药敏试验和药物筛选中尤为重要,可以有效避免不必要的临床前实验,从而减少病人资源和后续研究资金的浪费[20]。研究者们开发出了不同的三维培养模型来培养细胞,去模拟体内组织的微环境,为研究器官的发育以及疾病的治疗提供了一个新的思路[21]。如将肿瘤细胞接种到人工合成材料PLGA三维支架上,可以研究肿瘤细胞的恶性特征与环境之间的关系[22]。而用壳聚糖-藻酸盐制作的三维支架材料,能有效地在体外模拟神经胶质瘤[23]。一些水凝胶例如Matrigel、藻酸盐和透明质酸也被用来制作三维支架材料,培养肿瘤细胞,研究肿瘤细胞的生命特征[24]。胶原是细胞外基质的主要组成部分,能为细胞的粘附和迁移提供粘连位点[25]。除此之外,胶原还有着很好的生物相容性、很低的免疫源性、较好的生物降解性、一定的机械强度[26]。这些特征说明胶原是一种优良的支架材料。传统的方法是将胶原做成水凝胶的方式,培养肿瘤细胞,研究肿瘤细胞的生物学特性[27]。本次实验所用原材料是胶原膜,主要成分为I型和Ⅲ型胶原,将胶原膜重新处理加工,得到胶原海绵支架[2]。它是一种多孔状的三维支架网状结构,孔径大小为50~150 μm之间,这种多孔结构能为细胞的粘附和增殖提供足够的三维空间。在本研究中,在二维条件下,MCF-7细胞平展的粘附在塑料培养板上,呈多边形、铺路石样的上皮细胞形态,这种情况下细胞是单层生长,细胞和细胞之间的连接很少,仅仅存在于细胞间的接触点。将细胞接种到三维支架材料上培养,在三维条件下,细胞展现出多边形的或者球形的形态,还有很多不规则形态,部分细胞还伸展出长浸润性伪足。这种浸润性伪足的出现,可能与细胞获得迁移和侵袭能力相关。另外,在三维上培养的肿瘤细胞,细胞核出现了多形性,中心区少量细胞出现凋亡,这些现象同体内实体肿瘤细胞的特性更为类似。CD44+/CD24-/low表型的细胞是乳腺癌干细胞相关亚群,也是CSCs的特征之一[28]。本实验采用流式细胞技术对两组的细胞分别进行了CD44+/CD24-/low表型细胞的比例的检测。结果发现,三维培养条件下培养的MCF-7细胞,其CD44+/CD24-/low细胞的比例为60.3%,而二维的仅仅为38.9%,MCF-7细胞经三维培养后CD44+/CD24-/low细胞群的比例明显增加,可初步认定以胶原为支架的三维培养体系能够有效维持乳腺癌肿瘤干细胞干性。该模型可运用于探讨乳腺癌肿瘤干细胞的发生发展的机制,以及三维培养为基础的抗肿瘤药物的药敏试验平台。
【参考文献】
[1] Coyle WJ. Studying the human microbiome: beyond the petri dish[J]. Curr Gastroenterol Rep,2008,10:393-394.
[2] Chen L,Xiao Z,Meng Y,et al. The enhancement of cancer stem cell properties of MCF-7 cells in 3D collagen scaffolds for modeling of cancer and anti-cancer drugs[J]. Biomaterials,2012,33:1437-1444.
[3] Chao YL,Shepard CR,Wells A. Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J]. Mol Cancer,2010,9:179-198.
[4] DeSantis C,Ma J,Bryan L,et al. Breast cancer statistics,2013[J]. CA Cancer J Clin,2014,64:52-62.
[5] Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3: 730-737.
[6] Singh SK,Hawkins C,Clarke ID,et al. Identification of human brain tumour initiating cells[J]. Nature,2004,432: 396-401.
[7] Collins AT,Berry PA,Hyde C,et al. Prospective identification of tumorigenic prostate cancer stem cells[J]. Cancer Res,2005,65: 10946-10951.
[8] Zhao Y,Feng F,Zhou YN. Stem cells in gastric cancer[J]. World J Gastroenterol,2015,21:112-123.
[9] Song K,Wu J,Jiang C. Dysregulation of signaling pathways and putative biomarkers in liver cancer stem cells(Review)[J]. Oncol Rep,2013,29:3-12.
[10] Geng SQ,Alexandrou AT,Li JJ. Breast cancer stem cells: multiple capacities in tumor metastasis[J]. Cancer Lett,2014,349: 1-7.
[11] De Los Angeles A,Ferrari F,Xi R,et al. Hallmarks of pluripotency[J]. Nature,2015,525: 469-478.
[12] Al-Hajj M,Wicha MS,Benito-Hernandez A,et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A,2003,100:3983-3988.
[13] Ginestier C,Hur MH,Charafe-Jauffret E,et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J]. Cell Stem Cell,2007,1: 555-567.
[14] Golebiewska A,Brons NH,Bjerkvig R,et al. Critical appraisal of the side population assay in stem cell and cancer stem cell research[J]. Cell Stem Cell,2011,8:136-147.
[15] Chen YH,McGowan LD,Cimino PJ,et al. Mouse low-grade gliomas contain cancer stem cells with unique molecular and functional properties[J]. Cell Rep,2015,10:1899-1912.
[16] Berndt A,Hyckel P,Könneker A,et al. 3-dimensional in vitro invasion model for oral squamous epithelial carcinomas. Evaluation of tumor and stromal cell properties as well as extracellular matrix[J]. Mund Kiefer Gesichtschir,1998,2:256-260.
[17] Uzel SG,Amadi OC,Pearl TM,et al. Simultaneous or sequential orthogonal gradient formation in a 3D cell culture microfluidic platform[J]. Small,2016,12: 612-622.
[18] Godugu C,Singh M. AlgiMatrix-based 3D cell culture system as an in vitro tumor model: an important tool in cancer research[J]. Methods Mol Biol,2016,1379:117-128.
[19] Lee SM,Han N,Lee R,et al. Real-time monitoring of 3D cell culture using a 3D capacitance biosensor[J]. Biosens Bioelectron,2016,77: 56-61.
[20] Imamura Y,Mukohara T,Shimono Y,et al. Comparison of 2D-and 3D-culture models as drug-testing platforms in breast cancer[J]. Oncol Rep,2015,33:1837-1843.
[21] Li Q,Chow AB,Mattingly RR. Three-dimensional overlay culture models of human breast cancer reveal a critical sensitivity to mitogen-activated protein kinase kinase inhibitors[J]. J Pharmacol Exp Ther,2010,332: 821-828.
[22] Fischbach C,Chen R,Matsumoto T,et al. Engineering tumors with 3D scaffolds[J]. Nat Methods,2007,4: 855-860.
[23] Kievit FM,Florczyk SJ,Leung MC,et al. Chitosan-alginate 3D scaffolds as a mimic of the glioma tumor microenvironment[J]. Biomaterials,2010,31:5903-5910.
[24] Poincloux R,Collin O,Lizárraga F,et al. Contractility of the cell rear drives invasion of breast tumor cells in 3D Matrigel[J]. Proc Nati Acad Sci U S A,2011,108: 1943-1948.
[25] Egeblad M,Rasch MG,Weaver VM. Dynamic interplay between the collagen scaffold and tumor evolution[J]. Curr Opin Cell Biol,2010,22: 697-706.
[26] Cross VL,Zheng Y,Won Choi N,et al. Dense Type Ⅰ collagen matrices that suppor cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro[J]. Biomaterials,2010,31:8596-8607.
[27] Szot CS,Buchanan CF,Freeman JW,et al. 3D in vitro bioengineered tumors based on collagen I hydrogels[J]. Biomaterials,2011,32: 7905-7912.
[28] Fillmore CM,Kuperwasser C. Human breast cancer cell lines contain stem-like cells that self-renew,give rise to phenotypically diverse progeny and survive chemotherapy[J]. Breast Cancer Res,2008,10:R25-39.
