健脾益肾愈呆方改善血管性痴呆大鼠学习记忆能力及氧化应激作用机制研究
2018-05-09徐文娟郭梦兰王冠璐聂麟懿丁港李志鹏孙琳张钧惠杨晨栋
徐文娟,郭梦兰,王冠璐,聂麟懿,丁港,李志鹏,孙琳,张钧惠,杨晨栋
1.滨州医学院中西医结合学院,山东 烟台 264003;2.烟台中医医院脑病科,山东 烟台 264000
血管性痴呆(Vascular dementia,VD)是指由缺血性卒中和出血性卒中造成记忆、认知和行为等脑区低灌注的脑血管疾病所致的严重认知功能障碍综合征[1]。随着人口老龄化及脑血管疾病发病率的升高,卒中后VD的发病率逐年上升[2]。目前已明确VD的发生发展机制主要和慢性缺血导致的神经元、脑白质损伤、能量代谢障碍、突触传递功能异常等有关[3],其中在对VD的发病机理研究中氧化应激损伤越来越引起人们的关注,而核因子E2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2)信号通路和NADPH氧化酶(NADPH oxidase)中的犬尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1(NOX1)在慢性脑缺血诱导的氧化应激中发挥着相当重要的作用[4]。
近年来,中医药防治VD取得了部分进展,具有一定的潜力和优势,其主要方法有活血化瘀法,如血栓通、黄芪、川芎嗪、丹参、参附注射液、银杏叶提取物等,以及复方益智汤、补肾逐瘀汤、醒脑胶囊等从不同途径发挥益智作用,改善患者的学习记忆能力[5]。因此本研究以双侧颈总动脉永久性结扎(Bilateral common carotid artery occlusion,2VO)致慢性脑低灌注大鼠VD模型为研究对象,运用健脾化痰、开窍益肾治法,研究自拟健脾益肾愈呆方对VD记忆学习能力改善作用及其作用机制,为进一步完善中医药治疗VD提供实验依据。
1 材料与方法
1.1 实验动物 SPF级SD大鼠60只,体质量230~270 g,购自济南朋悦实验动物繁育有限公司,合格证号:SYXK(鲁)20130020;动物生产批号:37009200006098。试验期间大鼠常规饲养,自由进食进水,日光照射,饲养于滨州医学院实验动物中心,SPF级实验室。
1.2 仪器和试剂 MT-200 Morris水迷宫检测仪器(成都泰盟科技有限公司);Tecan Infinite F200/M200型多功能酶标仪(瑞士Tecan公司);低温离心机(美国Thermo公司);徕卡显微镜(德国 Leica公司);Rotor-Gene Q实时荧光定量PCR仪(德国QIAGEN公司)。超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醇(MDA)检测试剂盒(南京建成和碧云天生物科技公司),Trizol试剂盒(Gibco公司),逆转录-聚合酶链反应(RT-PCR)试剂盒和RT-PCR引物(Thermo Fisher Scientific公司)。
1.3 模型制备 采用2VO法致大鼠慢性脑缺血损伤,构建血管性痴呆大鼠模型,同时设立假手术组(Sham组)10只;术后21天采用Morris水迷宫实验筛选血管性痴呆大鼠模型[6],以假手术组大鼠逃避潜伏期平均值作参考值,计算造模组大鼠隐匿平台逃避潜伏期平均值与参考值的差占比,差占比>20%为成功VD大鼠模型。
1.4 动物分组与干预 将造模成功的39只大鼠随机分为4组:模型组10只(Vehicle组),灌胃给予生理盐水;健脾益肾愈呆方高剂量组10只(高剂量组,YD-H组),灌胃给予健脾益肾愈呆方9.8 g/(kg·d);健脾益肾愈呆方低剂量组10只(低剂量组,YD-L组),灌胃给予健脾益肾愈呆方4.9 g/(kg·d);多奈哌齐组9只(DON组),灌胃给予多奈哌齐(Donepezi)0.77 mg/(kg·d)。连续给药4周后进行水迷宫学习记忆行为学测试,然后处死动物提取相关组织进行其他指标的检测。
中药制备:健脾益肾愈呆方药物组成:半夏、白豆蔻各9 g,茯苓20 g,人参、龙骨、菟丝子各10 g,石菖蒲、远志、天冬、炙甘草各6 g,熟地黄15 g,龟板18 g,桑螵蛸12 g,陈皮8 g,药材由烟台市中医医院提供颗粒剂药物,蒸馏水溶解,装瓶密封,置4℃冰箱备用。
1.5 Morris水迷宫实验 采用Morris水迷宫方法测试大鼠学习记忆能力,将水池等分为四个象限,选第二象限正中放置直径10 cm的平台,没入水下2 cm,水池外参照物保持固定,并且隔绝自然光,用迷宫中灯光照明。实验包括隐蔽平台实验及空间探索实验2部分:①隐蔽平台实验:每只大鼠每天训练4次,连续训练5天,记录大鼠找到平台的时间(潜伏期),3次测得潜伏期均数作为当天的成绩,进行统计分析;②空间探索实验:隐蔽平台实验结束后,于第6天撤去平台。记录每只动物第1次到达平台位置的时间(潜伏期),以及60 s内穿越平台所在位置的次数,作为衡量其学习记忆能力的指标。
1.6 标本的采集及氧化应激标志物检测 腹腔注射麻醉大鼠,进行腹主动脉取血,立即于冰台上快速断头处死,取脑组织,分离脑皮质和海马组织,称重。将脑皮质剪碎,置于匀浆器中,加生理盐水,研磨匀浆,静置,在4℃低温离心机中4 000 r/min离心10 min,取上清液,按照试剂盒说明书测定脑中SOD、GSH-PX、MDA的含量。
1.7 病理组织形态学观察 大脑标本经固定、脱水、包埋、切片后进行HE染色,在光学显微镜下观察各组大鼠脑皮层、海马组织病理形态变化。
1.8 RT-PCR检测脑组织中Nrf2、NOX1和血红素加氧酶-1(Heme oxygenase-1,HO-1) mRNA的表达水平 取脑组织置液氮中研磨至粉末,转入离心管中,加入1 mL Trizol,充分振荡溶解,抽提总RNA,将RNA反转录成 cDNA。取 1 μL作为模板进行RT-PCR反应。Nrf2上游引物5'-ATATACGCAGGAG AGGGAAG-3',下游引物 5'-TCCCATCCTCATCACG TAAC-3',片段长度 222 bp。NOX1上游引物 5'-GTGGCTTTGGTTCTCATGGT-3',下游引物5'-TGAG GACTCCTGCAACTCCT-3',片段长度224 bp。HO-1上游引物5'-GGGTCCTCACACTCAGTTTC-3',下游引物5'-CCAGGCATCTCCTTCCATTC-3',片段长度228 bp。GAPDH上游引物5'-TGAACGGGAAGCTCACTGG-3', 下 游 引 物 5'-TCCACCACCCTGTTGCTGTA-3',片段长度270 bp。RT-PCR反应条件:95℃预变性5 min;95℃,30 s;55℃,30 s;72℃,1 min(30 cycle);72℃,10 min。
1.9 统计学方法 所有资料数据用SPSS19.0统计软件进行统计处理。计量资料以(x±s)表示,计数资料用χ2检验,计量资料用方差分析或t检验。
2 结果
2.1 各组大鼠逃避潜伏期时间比较 见表1。实验第1天,各组大鼠的逃避潜伏期无统计学差异(P<0.05);实验第2天至第5天,与假手术组比较,模型组大鼠的逃避潜伏期明显延长,差异有统计学意义(P<0.05),提示造模成功。与模型组比较,从第3天开始,YD-L组和DON组逃避潜伏期显著缩短(P<0.05),YD-H组自第2天起其逃避潜伏期就明显缩短(P<0.01)。

表1 各组大鼠逃避潜伏期时间比较(x±s)s
2.2 各组大鼠空间记忆能力比较 见表2。在水迷宫实验的第6天进行空间探索实验,与假手术组比较,模型组大鼠在目标象限停留时间百分比(即平台所在象限停留时间与总时间的比值)显著减少(P<0.05)。与模型组比较,YD-H组和YD-L组大鼠在目标象限停留时间百分比均有所增加(P<0.01)。与假手术组比较,模型组大鼠在60 s内穿越平台所在位置的次数降低(P<0.05);与模型组比较,YD-H组、YD-L组和DON组大鼠在60 s内穿越平台所在位置的次数增加(P<0.01)。
2.3 各组大鼠海马组织CA1区形态学比较 见图1。假手术组大鼠海马CA1区神经元细胞形态结构完整,排列致密整齐,胞浆清亮,胞核清晰,染色质丰富。模型组大鼠神经元细胞排列疏松紊乱、数量减少,形态不规则,呈梭形、多角形,胞核浓染固缩,部分细胞核仁不清或消失,细胞变性、坏死和脱落明显。与模型组比较,健脾益肾愈呆方干预后(尤其是YD-H组),上述形态学变化有所改善,大鼠海马CA1区神经元排列尚紧密均匀,细胞结构较为完整,边界较清晰,胞核饱满,核固缩减少。

表2 各组大鼠空间记忆能力比较(x±s)
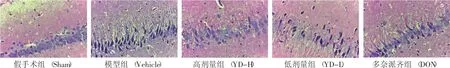
图1 HE染色显示大鼠海马CA1区的形态学变化(×400)
2.4 各组大鼠脑组织氧化应激标志物含量比较 见表3。与假手术组比较,模型组大鼠脑组织中SOD和GSH-PX含量降低,MDA含量升高,差异均有统计学意义(P<0.05)。与模型组比较,YD-H组、YD-L组和DON组大鼠脑组织中SOD和GSH-PX含量明显升高,MDA含量明显降低,差异均有统计学意义(P<0.01)。

表3 各组大鼠脑组织氧化应激标志物含量比较(x±s)
2.5 各组大鼠脑组织Nrf2、NOX1和HO-1 mRNA的表达水平比较 见表4。与假手术组比较,模型组大鼠脑组织中Nrf2和HO-1 mRNA表达降低,NOX1 mRNA升高,差异均有统计学意义(P<0.05)。与模型组比较,YD-H组、YD-L组和DON组大鼠脑组织中Nrf2和HO-1 mRNA表达明显升高,NOX1 mRNA明显降低,差异均有统计学意义(P<0.01)。
3 讨论
目前尚无防治VD的特效药物或措施,临床上常用改善脑循环药物、脑细胞代谢复活剂、胆碱能药物等。药物治疗只能相对减轻VD症状,延缓其进一步恶化[7]。

表4 各组大鼠脑组织Nrf2、NOX1和HO-1 mRNA的表达水平比较(x±s)
中医古籍中没有血管性痴呆的病名,相关描述散见于健忘、善忘、呆症、癫狂等病证中。人至老年,脏腑功能减退,年高阴气自半,肝肾阴虚或肾中精气不足,不能生髓,髓海空虚,髓减脑消,而成痴呆,同时脾胃功能受到影响则会导致津液生成受阻,最终导致脑髓不能得到充养。因此本课题组认为痴呆,脾虚为本,痰湿内盛为标,肾精亏虚,脑髓失养贯穿始终,当健脾化痰,开窍益肾。自拟方健脾益肾愈呆方,主要成分茯苓、人参、白术和菟丝子具有抗氧化、抗衰老和免疫调节等作用,熟地黄、石菖蒲能够提高小鼠学习及记忆能力,龟板具有抗缺氧等作用。诸药合用,有补脾益气、宣窍化痰、滋阴补肾之效,同时具有改善微循环、清除自由基、抗氧化、免疫调节及改善记忆力等作用。
认知障碍是VD的重要特征,因此本研究采用2VO的方法成功制备了VD大鼠模型,Morris水迷宫测试显示VD模型组大鼠出现了明显的空间学习记忆下降的现象。而经过健脾益肾愈呆方干预后,可显著改善VD大鼠的认知功能障碍。而且VD大鼠海马组织CA1区形态学观察中,发现模型组大鼠神经元细胞排列疏松紊乱、数量减少,形态不规则,细胞变性、坏死和脱落明显;健脾益肾愈呆方干预后,上述形态学变化有所改善,大鼠海马CA1区神经元排列尚紧密均匀,细胞结构较为完整,边界较清晰,胞核饱满,核固缩减少,与Morris水迷宫检测结果相一致。可见,健脾益肾愈呆方可以减轻慢性脑低灌注诱导海马CA1区神经元发生的损伤,进而改善大鼠空间认知功能障碍,提高VD学习记忆能力。
氧化应激损伤在慢性脑低灌注诱导VD发生发展过程中有重要的影响。机体内部ROS水平和抗氧化还原能力之间的平衡失调,导致与学习、记忆相关的海马组织结构和功能异常,引起认知障碍,最终致痴呆[8]。本研究中模型组大鼠脑组织中SOD和GSH-PX含量明显降低,MDA含量明显升高也证实这一影响。Nrf2属于转录因子家族,是氧化应激的主要调节因子。在生理条件下,Nrf2在胞浆中通过Kelch样环氧氯丙烷相关蛋白-1(Keap1)起负调节作用,最终激活了ARE依赖的基因和抗氧化还原酶,主要有HO-1、NAD(P)H苯醌氧化还原酶、谷胱甘肽-s-转移酶等[9~10],从而提高机体应对氧化应激的能力,产生神经保护作用。研究表明Nrf2功能障碍是引起慢性脑缺血诱导的氧化应激损伤的重要因素[11]。NOX酶是一种新发现的重要氧化剂来源,NOX家族在中枢神经系主要存在的是NOX1、NOX2和NOX4。NOX来源的ROS可进一步使ROS产生增加,而过量的ROS将会导致氧化应激,引起神经元内蛋白、脂质和DNA的氧化损伤[12~13]。本研究中模型组大鼠脑组织中Nrf2和HO-1 mRNA表达降低,NOX1 mRNA升高,证明了Nrf2信号通路和NOX1在VD大鼠慢性脑低灌注诱导的氧化应激中发挥着重要的作用。
健脾益肾愈呆方干预后大鼠脑组织中SOD和GSH-PX含量明显升高,MDA含量明显降低,同时大鼠脑组织中Nrf2和HO-1 mRNA表达明显升高,NOX1 mRNA明显降低,说明健脾益肾愈呆方可能是通过激活Nrf2信号通路和下调氧化应激相关蛋白NOX1的表达,提高机体抗氧化能力和减少ROS的产生,减轻大鼠海马神经元损伤和氧化应激,进而产生神经保护作用。
[参考文献]
[1]翁映虹,黄坚红.血管性痴呆的定义及诊断进展[J].广东医学,2010,31(14):1881-1882.
[2]曲艳吉,卓琳,王华丽,等.1980-2011年中国社区55岁及以上人群中血管性痴呆流行病学的Meta分析[J].中国卒中杂志,2013,8(7):533-542.
[3]He XL,Wang YH,Bi MG,et al.Chrysin improves cognitive deficits and brain damage induced by chronic cerebral hypoperfusion in rats[J].Eur J Pharmacol,2012,680(1-3):41-48.
[4]Kumar H, Kim IS, More SV, et al.Natural productderived pharmacological modulators of Nrf2/ARE pathway for chronic diseases[J].Nat Prod Rep,2014,31(1):109-139.
[5]张玉红.血管性痴呆中医药治疗进展[J].天津药学,2012,24(3):76-78.
[6]宫志华,刘明霞,宫丽丽,等.人参皂苷Rg2抗MTD大鼠海马神经元凋亡的研究(英文)[J].现代生物医学进展,2010,10(6):1069-1075.
[7]刘慧.多奈哌齐治疗血管性痴呆的临床疗效[J].中国医药指南,2015,13(36):118.
[8]Carayol N,Vakana E,Sassano A,et al.Critical roles for mTORC2-and rapamycin-insensitive mTORC1-complexes in growth and survival of BCR-ABL-expressing leukemic cells[J].Proc Natl Acad Sci,2010,107(28):12469-12474.
[9]Gan L,Johnson JA.Oxidative damage and the Nrf2-ARE pathway in neurodegenerative diseases[J].Biochim Biophys Acta,2014,1842(8):1208-1218.
[10]Komatsu M,Kurokawa H,Waguri S,et al.The selective autophagy substrate p62 activatesthe stress responsive transcription factor Nrf2 through inactivation of Keap1[J].Nat Cell Biol,2010,12(3):213-223.
[11]Joshi G,Johnson JA.The Nrf2-ARE pathway:a valuable therapeutic target for the treatment of neurodegenerative diseases[J].Recent Pat CNS Drug Discov, 2012, 7(3):218-229.
[12]Nixon RA,Wegiel J,Kumar A,et al.Extensive involvement of autophagy in Alzheimer disease:an immuno-electron microscopy study[J].J Neuropathol Exp Neurol,2005,64:113-122.
[13]Pickford F,Masliah E,Britschgi M,et al.The autophagy-related protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice[J].J Clin Invest,2008,118(6):2190-2199.
