F3′5′H对马铃薯花青素合成的调控
2018-05-09,,,,
, , , ,
(1. 山东师范大学 生命科学学院, 山东 济南 250014; 2. 山东省农业科学院 a.蔬菜花卉研究所/山东省设施蔬菜生物学重点实验室/国家蔬菜改良中心山东分中心,b.生物技术研究中心, 山东 济南 250100)
花青素(anthocyanin)又名花色素,属类黄酮化合物,具有较好的水溶性,是植物的根茎、果实和花瓣等的主要显色物质。迄今为止,科技人员已发现50多种花青素,植物中常见的花青素有6 种,如矮牵牛色素(petunidin)、翠雀素或飞燕草色素(delphindin)、矢车菊色素(cyanidin)、 天竺葵色素(pelargonidin)、 芍药色素(peonidin)和锦葵色素(malvidin)。 在自然界中, 花青素通常与各种单糖化合形成糖苷, 并以糖苷化合物的形式存在, 单独以游离状态形式存在的花青素极少[1]。 花青素具有杀菌、 清除氧自由基、 抗衰老以及降低心脑血管、 癌症和糖尿病等疾病的发病概率等功效[2], 因此, 花青素在食品保健和医药等领域具有重要的价值, 受到科技工作者高度关注[3-5]。
马铃薯(SolanumtuberosumL.)是我国第五大粮食作物,营养丰富,享有“地下苹果”美誉。与普通栽培的马铃薯相比,紫色和红色马铃薯除富含淀粉、维生素以及人体必需的23种氨基酸以外,还含有大量的花青素[6]。马铃薯中的花青素对健康有很多益处。通过对小鼠的研究表明,马铃薯中的花青素能够显著提高超氧化物歧化酶的活性和抗氧化能力,从而使身体免受伤害[7-8]。近年来,随着人们对富含花青素马铃薯认识的提高,马铃薯花青素生物合成研究受到科研人员的重视,成为该领域的研究热点[9-10]。
在马铃薯花青素的合成研究中,花青素的合成途径已基本明确(图1),其生物合成不仅受类黄酮3′, 5′羟化酶基因F3′5′H、 二氢黄酮醇-4-还原酶基因DFR、 查尔酮合酶基因CHS(CHSJ和CHSG)、 查尔酮异构酶基因CHI、 类黄酮3羟化酶基因F3H和类黄酮-3-O-葡萄糖基转移酶基因3GT等结构基因的控制[10], 而且还受到R2R3 MYB、 类似于MYC的螺旋-环-螺旋的bHLH和WD40重复蛋白等转录因子的调控[11-12]。F3′5′H编码类黄酮3′,5′羟化酶,该酶属于细胞色素P-450总科,主要催化二氢黄酮醇在3′、 5′位置上各氧化上一个羟基[13]。在马铃薯中,F3′5′H控制矮牵牛色素类型的紫色或蓝色花青素的的合成[14-15]。R2R3MYB转录因子是含有2个MYB结构域的MYB蛋白[16],在马铃薯中已经克隆了R2R3MYB转录因子AN1,它通过激活DFR、F3′5′H等结构基因的表达来促进花青素的合成[11]。bHLH转录因子属于MYC转录因子,StbHLH1已经定位到马铃薯的9号染色体上,并且发现它能够增强花青素的合成[10,12]。WD40重复蛋白具有β螺旋桨蛋白组结构,已经从马铃薯Chieftain中克隆出WD40重复蛋白基因StAN11(HQ599506),它可以明显上调DFR的表达量使块茎的红色加深[17]。 此外, MYB、 bHLH和WD40可以形成MYB-bHLH-WD40(MBW)复合体调节花青素的合成。MYB提供脱氧核糖核酸(DNA)的特殊连接结构域,bHLH在一定程度上决定着激活基因的种类,WD40在总体上调控这3种转录因子形成的复合体MBW[18]。
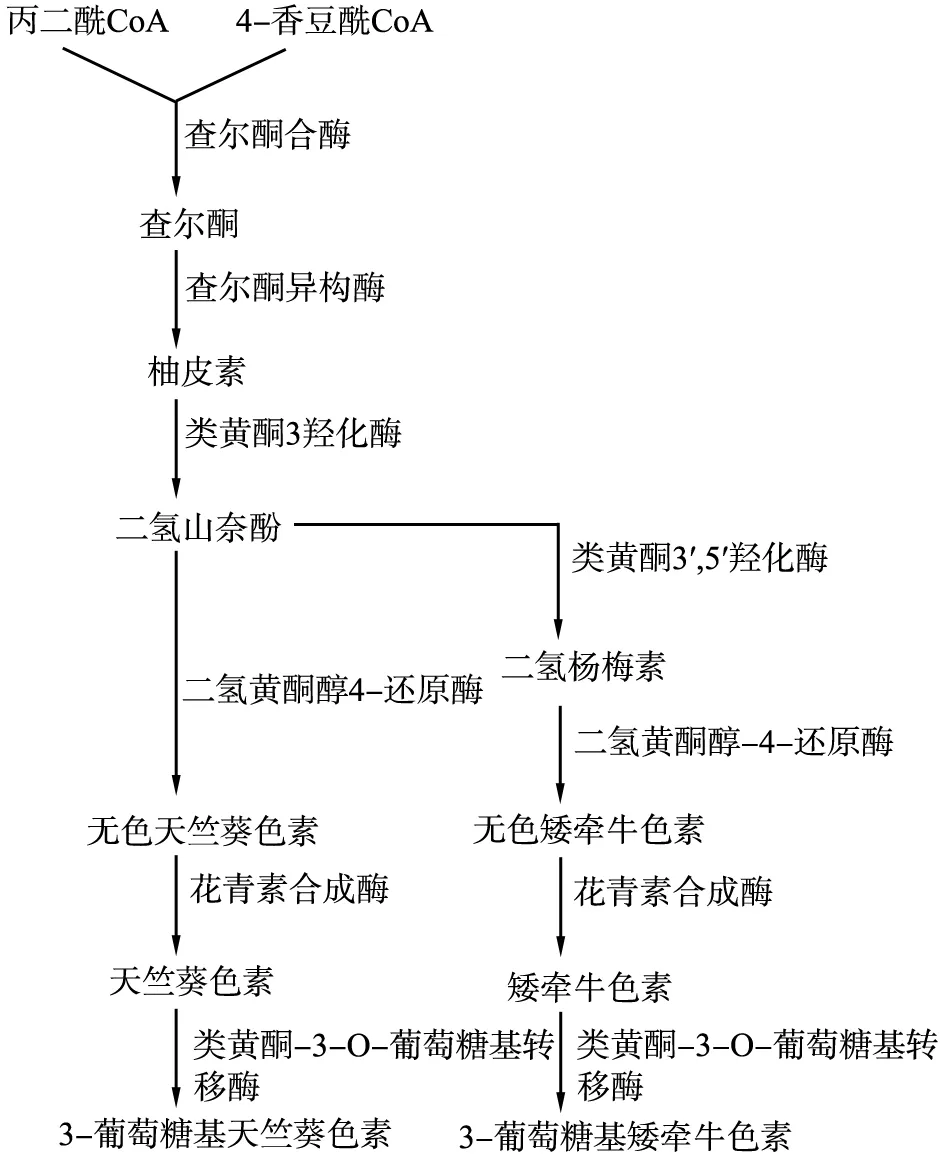
图1 马铃薯花青素合成途径
当前, 尽管马铃薯花青素的合成途径已基本清晰, 但是对不同花青素之间生物合成流向的研究较少。 研究花青素流向机制对丰富花青素的合成途径具有重要意义, 因此, 本文中利用紫色马铃薯及其红色突变体为材料, 对马铃薯紫色花青素和红色花青素之间的转化调节进行研究, 以期丰富花青素的代谢途径, 并为富含花青素马铃薯的育种提供参考。
1 材料与方法
1.1 供试材料
马铃薯四倍体材料SD92,俗称黑金刚,紫色薯皮和薯肉。SD140是由SD92切片再生的突变体,红色薯皮和薯肉。SD92和SD140种植于温室70 d收获,收获后的块茎洗净后用吸水纸干燥,迅速切成片后用液氮速冻,置于-80 ℃保存备用。
1.2 供试方法
1.2.1 核糖核酸提取和互补脱氧核糖核酸的合成
采用改良的Trizol法提取核糖核酸(RNA), 具体步骤如下: 1)取0.1 g材料加入液氮研磨, 然后加入1 mL Trizol和2 μL β-巯基乙醇混匀,室温放置10 min,4 ℃, 以12 000 r/min转速离心分离10 min; 2)取上清于1.5 mL离心管中, 加入200 μL氯仿, 室温放置10 min,4 ℃,以12 000 r/min转速离心分离10 min;3)取上清于1.5 mL离心管中,加入1/4体积的氯仿和等体积的1.5%十六烷基三甲基溴化铵+15%醋酸钾混合液后颠倒混匀,室温放置10 min,以12 000 r/min转速离心分离10 min;4)取上清, 加入等体积的异丙醇, 颠倒混匀, 室温放置10 min, 以12 000 r/min转速离心分离10 min; 5)弃上清, 加入1 mL的75%预冷乙醇短暂离心分离,洗涤沉淀,室温晾干;6)干燥后用20 μL 焦磷酸二乙酯-水溶解,-80 ℃保存。140 V电泳15 min,凝胶电泳检测RNA的完整性,利用Implen P330 (Germany)测定RNA的质量和浓度。
采用DNase I(Thermo,USA)对提取的RNA消化,降解残留的DNA,具体步骤参照说明,并用聚合酶链式反应(PCR)检测消化结果。取1 μL消化完全的RNA为模板进行反转录得到互补脱氧核糖核酸(cDNA),反转录采用PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit(TaKaRa),具体步骤参照试剂盒说明。
1.2.2 基因检测及分析
F3′5′H基因的反转录聚合酶链式反应(RT-PCR)检测:以马铃薯延伸因子基因EF1-α(AB061263.1)作为内参基因[19],检测F3′5′H[AY675558(PGSC0003DMT400001124)]的表达。首先参照AB061263.1和AY675558序列,利用Primer5.0设计特异性引物(表1), 以1 μL反转录产物为模板进行PCR反应。 PCR 程序为: 95 ℃预变性 3 min; 95 ℃变性 30 s,58 ℃退火30 s,72 ℃延伸 2 min,30个循环;最后72 ℃延伸10 min。
采用荧光定量方法对F3′5′H和转录因子基因MYB、MYC、WD40的表达量进行分析。首先根据F3′5′H[AY675558(PGSC0003DMT400001124)]、MYB[NM_001288222 (PGSC0003DMT400022661)]、MYC[XM_006366182(PGSC0003DMT400002963)]、WD40 [HQ599506]序列设计特异性的荧光定量PCR引物(表1),然后进行实时荧光定量聚合酶链式反应(qRT-PCR)。参照Glais L和侯志强对马铃薯实时荧光定量中内参基因选择的研究结果[20-21],选择18S核糖体核糖核酸(rRNA)为内参基因。qRT-PCR反应体系为50 μL,其中25 μL超级荧光染料SYBR混合液(CWBIO)、1 μL的cDNA、1 μL浓度为10 μmol/L的正向引物、1 μL浓度为10 μmol/L的反向引物、22 μL的二次蒸馏水。qRT-PCR反应在iCycler iQ(Bio-Rad, Hercules,CA,USA)中进行,程序为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸1 min,37 个循环, 3次重复。 采用EXCEL2007对两种材料中的基因荧光定量数据进行显著性差异检验。

表1 实验所用引物
1.2.3F3′5′H编码区序列及启动子序列测序及分析
以SD92和SD140 DNA为模板, 用高保真聚合酶Trans Taq DNA Polymerase High Fidelity(HiFi), 参考马铃薯基因F3′5′H的DNA序列AB496976.1和 PGSC0003DMG400000425 设计特异性引物扩增F3′5′H编码区; 参考PGSC0003DMG400000425(http://solanaceae.plantbiology.msu.edu/cgi-bin/gbrowse/potato/#search)前面2 000 bp序列设计特异性引物(表1)扩增启动子序列。以SD92的cDNA为模板,对PCR产物进行凝胶电泳检测,用PCR回收试剂盒(Biomiga)回收纯化PCR产物,回收后的产物与 PMD18-T(Takara)重组,然后将重组载体转化大肠杆菌DH5α。经菌液 PCR 鉴定为阳性的样品送到上海生工生物科技有限公司测序验证。测序结果用DNAMAN软件进行比对,分析F3′5′H的编码区序列和启动子序列。启动子序列用植物顺式元件数据库Plant-CARE(plant cis-acting regulatory element,http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线预测分析启动子可能存在的顺式作用元件。
2 结果与分析
2.1 RNA的提取结果
利用改良Trizol法提取的总RNA无弥散带,18S、28S和5S条带清晰,表明总RNA完整未降解(图2)。SD92和SD140这2种材料提取的RNA浓度较高,质量浓度分别为410、524 mg/L;两者在波长为260 nm的吸光度A260与280 nm的吸光度A280之比以及260 nm的吸光度A260与230 nm的吸光度A230之比均大于2.0(见表2),表明RNA质量良好,可以用于后续荧光定量分析。
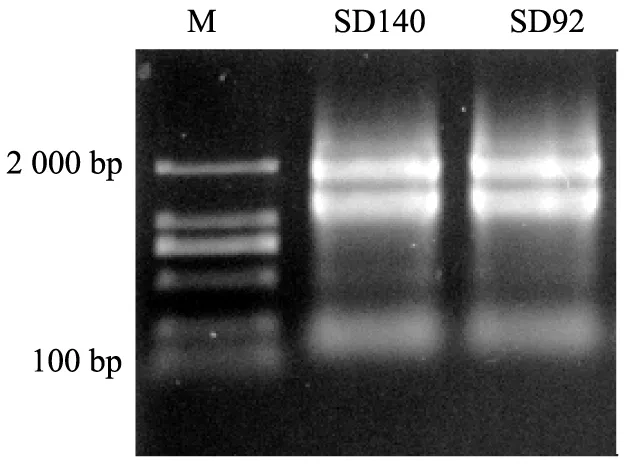
图2 提取核糖核酸完整性检测表2 提取的核糖核酸的品质及浓度
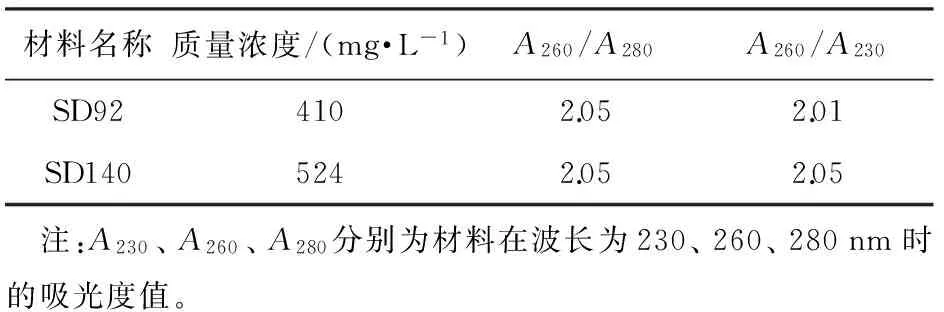
材料名称质量浓度/(mg·L-1)A260/A280A260/A230SD924102.052.01SD1405242.052.05 注:A230、A260、A280分别为材料在波长为230、260、280nm时的吸光度值。
2.2 F3′5′H的表达量分析
利用反转录后的cDNA,在SD140和SD92中进行类黄酮3′, 5′羟化酶基因F3′5′H的RT-PCR和qRT-PCR检测,结果见图3。从图中可以看出,通过RT-PCR检测,F3′5′H在SD140中表达量较低,在SD92中表达量较高。荧光定量PCR结果见图4。可以看出,F3′5′H在SD140中的表达量仅为SD92的40%,两者的差异达到显著水平。
2.3 F3′5′H编码区序列及启动子序列测定及序列分析
鉴于F3′5′H在SD92和SD140的表达量不同,对DNA序列和启动子区域进行测序,结果显示SD92和SD140具有相同的F3′5′H编码区序列和启动子序列(图5)。编码区序列有2 882 bp,与AB496976.1的同源性达到95%。F3′5′H编码区序列中有1 530 bp的编码序列,编码509个氨基酸残基。启动子序列有1 200 bp,为研究调控元件对花青素转化的影响,对F3′5′H启动子进行了分析。定义转录起始位点(TSS)的第一个碱基为+1,将克隆的1 200 bp的序列进行在线预测,结果(图5)显示F3′5′H启动子不仅含有真核生物启动子必须的核心元件TATA-box,还含有其他调控元件,主要有:1)激素应答元件, 如ABRE(脱落酸响应元件)、 ERE(乙烯响应元件)、 TATC-box(赤霉素响应元件)、 TCA-element(水杨酸响应元件); 2)光响应元件, 如Box 4、 Box I、G-Box、 LS7、 chs-CMA1a等; 3)胁迫应答元件, 如HSE(热胁迫)、 TC-rich repeats(干旱胁迫以及病虫害胁迫); 4)结合位点, MBS(MYB结合位点)。
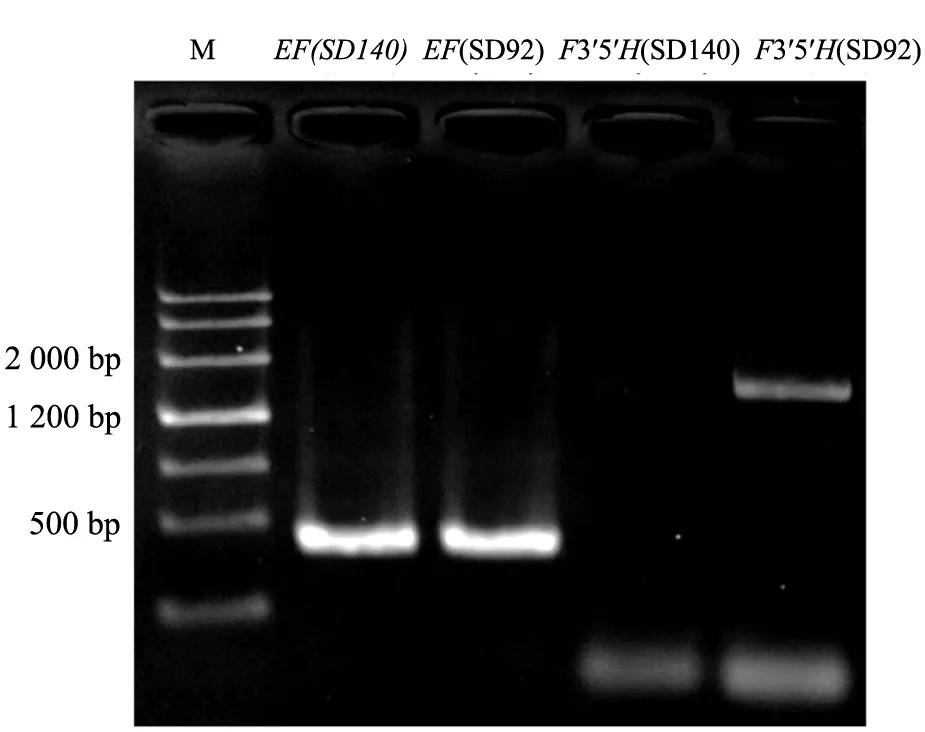
图3 F3′5′H的反转录聚合酶链式反应检测

图4 F3′5′H的实时荧光定量聚合酶链式反应检测
2.4 转录因子表达量的分析
花青素的合成路径受转录因子的影响,实验中通过对F3′5′H启动子序列的分析也发现该启动子区域具有转录因子MYB结合位点, 基于花青素合成路径中MYB转录因子与MYC、 WD40有密切的联系, 分别对SD92和SD140的MYB、MYC、WD40的表达量进行差异分析。荧光定量PCR检测结果表明,这3种转录因子在SD92和SD140中的表达量不同,两者的差异达到显著水平。MYB、MYC和WD40在SD140中的表达量明显高于SD92,分别是SD92的5.03、 3.97、 3.71倍(图6)。

图5 F3′5′H编码区序列及启动子的序列分析(加粗部分为编码序列,斜体部分为非编码序列)
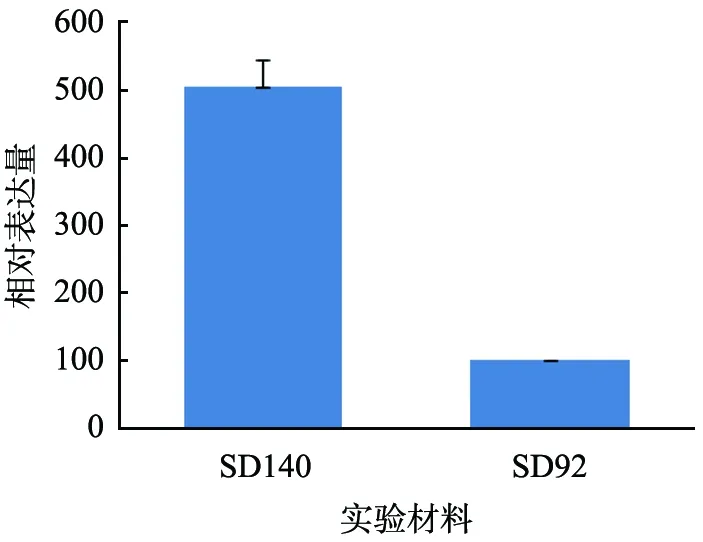
(a) MYB
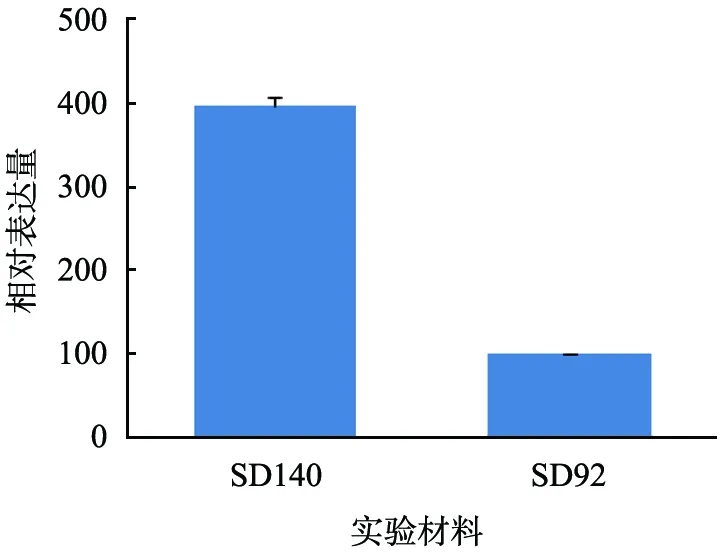
(b) MYC
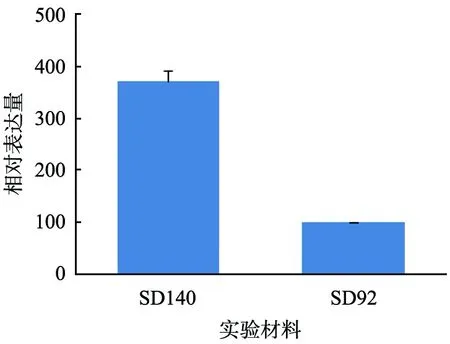
(c) WD40图6 SD140和SD92中转录因子基因表达量分析
3 讨论与结论
在本实验中, SD92突变生成SD140, 马铃薯块茎的皮色和肉色由紫色转变为红色。 在这一变化过程中, 紫色的花青素转化成红色的花青素。 紫色花青素的合成主要受F3′5′H控制[13],F3′5′H是控制花青素合成向不同支路发展的重要开关[22]。 实验中F3′5′H的表达量在SD140中明显降低, 表明马铃薯紫色花青素向红色花青素的转化很可能是由F3′5′H表达量的下降引起的。
早期的研究结果表明,在F3′5′H编码区序列中插入转座子dTstu1可以引起F3′5′H表达量下降[15]。然而,在本实验中,F3′5′H在2种材料中的编码区序列及启动子区域没有差异,说明花青素由紫色向红色的转化不是由于基因序列的不同引起的,可能是由于调控F3′5′H的转录因子变化引起的。转录因子BrMYB和SmMYB可以正向地调控花青素结构基因的表达[23-24],MYB因子CAPRICE也可以通过抑制PAL、CHS、DFR和ANS等结构基因的表达来抑制花青素的合成[25]。本实验中,F3′5′H启动子区序列分析结果表明启动子区域有MYB结合位点,且MYB(PGSC0003DMT400022661)在红色突变体中表达量提高,说明该MYB转录因子可能抑制了F3′5′H的表达,进而促进马铃薯从紫色花青素转化为红色花青素。
在调控花青素合成中,MYB与bHLH或者WD40或者三者形成MBW复合体调控花青素的合成[26]。MYB与MYC转录因子bHLH1具有连接活性,它们一起调节花青素合成晚期基因的表达[27]。在马铃薯块茎中克隆到的R2R3MYB转录因子有共表达因子StbHLH1,它在细胞核中表达,增强了MYB对花青素合成的调节效果[10,12]。本实验中,相对于紫色马铃薯SD92,MYC(XM_006366182)在红色突变体SD140中表达量明显提高,说明MYC通过增强MYB的作用促进了马铃薯紫色花青素向红色花青素的转化。此外,已经在马铃薯中克隆的WD40 重复蛋白基因StAN11能够增强红色花青素的合成[17]。在紫色马铃薯SD92突变为红色马铃薯SD140的过程中,WD40(HQ599506)的表达量提高了,说明它促进红色花青素的合成,这与前人的研究结果是一致的。由于在马铃薯中的MBW复合体能够加强MYB对花青素合成的调节作用[28],因此WD40可能通过MBW复合体增强MYB对红色花青素合成的流向调控。
总之,F3′5′H是马铃薯块茎花青素向红色或紫色合成的重要基因。MYB、 MYC和WD40这3个转录因子可能通过抑制F3′5′H的表达进而调控马铃薯紫色花青素的合成转向红色花青素的合成。MYB和MYC、WD40的功能及之间如何相互作用需要进一步的研究。
参考文献:
[1] MARTIN C, GERATS T. Control of pigment biosynthesis genes during petal development[J]. Plant Cell, 1993, 5(10): 1253-1264.
[2] TSUDA T. Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies[J].Mol Nutr Food Res, 2012, 56(1): 159-170.
[3] JEZEK M, ZÖRB C, MERKT N, et al. Anthocyanin management in fruits by fertilization[J].J Agr Food Chem, 2018[2018-01-10].http://pubs.acs.org/doi/abs/10.1021/acs.jafc.7b03813.doi: 10.1021/acs.jafc.7b03813.
[4] ZHANG Y, BUTELLI E, MARTIN C. Engineering anthocyanin biosynthesis in plants[J]. Curr Opin Plant Biol, 2014, 19: 81-90.
[5] ZHA J, KOFFAS M A G. Synthetic production of anthocyanins in metabolically engineered microorganisms: current status and perspectives[J].Synthetic and Systems Biotechnology, 2017, 2(4): 259-266.
[6] BROWN C R, CULLEY D, BONIERBALE M, et al. Anthocyanin, carotenoid content and antioxidant values in native South American potato cultivars[J].HortScience, 2007, 42(7): 1733-1736.
[7] HAN KH, SEKIKAWA M, SHIMADA K, et al. Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J]. Br J Nutr. 2006, 96(6): 1125-1133.
[8] HAN KH, HASHIMOTO N, HASHIMOTO M, et al. Red potato extract protect from D-galactosamine-induced liver injury rats[J]. Biosci Biotechnol Biochem, 2006, 70(9): 2285-2288.
[9] LIU Y H, WANG K L, DENG C, et al. Comparative transcriptome analysis of white and purple potato to identify genes involved in anthocyanin biosynthesis[J].PLoS ONE, 2015, 7.[2017-05-17].https://doi:10.1371/journal.pone.0129148.
[10] LU Q N, YANG Q. cDNA cloning and expression of anthocyanin biosynthetic genes in wild potato (Solanumpinnatisectum)[J].Afr J Biotechnol, 2006, 5(10): 811-818.
[11] D′AMELIA V, AVERSANO R, BATELLI G, et al. High AN1 variability and interaction with basic helix-loop-helix co-factors related to anthocyanin biosynthesis in potato leaves[J].Plant J, 2014, 80(3): 527-540.
[12] ZHANG Y F, JUNG C S, DE JONG W S. Genetic analysis of pigmented tuber flesh in potato[J]. Theor Appl Genet, 2009, 119(1): 143-150.
[13] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7(7): 1071-1083.
[14] JUNG C S, GRIFFITHS H M, DE JONG M D, et al. The potato P locus codes for flavonoid 3′,5′-hydroxylase[J]. Theor Appl Genet, 2005, 110(2): 269-275.
[15] MOMOSE M, ABE Y, OZEKI Y. Miniature inverted-repeat transposable elements of stowaway are active in potato[J].Genetics, 2010, 186(1): 59-66.
[16] STRACKE R, WERBER M, WEISSHAAR B. TheR2R3-MYBgene family inArabidopsisthaliana[J]. Plant Biol, 2001, 4(5): 447-456.
[17] LI W, WANG B, WANG M, et al. Cloning and characterization of a potato StAN11 gene involved in anthocyanin biosynthesis regulation[J].J Integr Plant Biol, 2014, 56(4): 364-372.
[18] HICHRI I, HEPPEL S C, PILLET J, et al. The basic helix-loop-helix transcription factor MYC1 is involved in the regulation of the flavonoid biosynthesis pathway in grapevine[J]. Mol Plant, 2010, 3(3): 509-523.
[19] 董玉梅, 密其鹏, 焦自高, 等.马铃薯GLDH基因的克隆及序列分析[J].园艺学报, 2011, 38(6): 1111-1120.
[20] GLAIS L, KERLAN C, TRIBODET M, et al. Molecular characterization of potato virus YNisolates by PCR-RFLP[J].Eur J Plant Pathol, 1996, 102(7): 655-662.
[21] 侯志强, 王庆国. 鲜切马铃薯实时荧光定量PCR分析中内参基因的选择[J].安徽农业科学, 2013, 41(12): 5207-5209.
[22] SHIMADA Y, OHBAYASHI M, NAKANO-SHIMADA R, et al. Genetic engineering of the anthocyanin biosynthetic pathway with flavonoid-3′,5′-hydroxylase: specific switching of the pathway in petunia[J].Plant Cell Rep, 2001, 20(5): 456-462.
[23] ZHANG Y G, CHEN G P, DONG T T, et al. Anthocyanin accumulation and transcriptional regulation of anthocyanin biosynthesis in purple bok choy(Brassicarapavar.chinensis)[J].J Agr Food Chem, 2014, 62(51): 12366-12376.
[24] ZHANG Y G, HU Z L, CHU G H, et al. Anthocyanin accumulation and molecular analysis of anthocyanin biosynthesis-associated genes in eggplant(SolanummelongenaL.)[J].J Agr Food Chem, 2014, 62(13): 2906-2912.
[25] WADA T, KUNIHIRO A, TOMINAGA-WADA R. Arabidopsis CAPRICE(MYB)and GLABRA3 (bHLH)control tomato (Solanumlycopersicum) anthocyanin biosynthesis[J].PLoS One, 2014, 9.[2018-01-20]. https://doi.org/10.1371/journal.pone.0109093.
[26] SHIN D H, CHO M, CHOI M G, et al. Identification of genes that may regulate the expression of the transcription factor production of anthocyanin pigment 1(PAP1)/MYB75 involved in Arabidopsis anthocyanin biosynthesis[J].Plant Cell Rep, 2015, 34(5): 805-815.
[27] CHIU L W, LI L. Characterization of the regulatory network of BoMYB2 in controlling anthocyanin biosynthesis in purple cauliflower[J]. Planta, 2012, 236(4): 1153-1164.
[28] FOGELMAN E, TANAMI S, GINZBERG I. Anthocyanin synthesis in native and wound periderms of potato[J]. Physiol Plantarum, 2015, 153(4): 616-626.
