不同蒸煮方式对藜麦营养特性及风味的影响
2018-05-09毛晓慧杨莉榕张金叶冯翠萍王晓闻山西农业大学食品科学与工程学院太谷030801
延 莎 毛晓慧 杨莉榕 张金叶 冯翠萍 王晓闻(山西农业大学食品科学与工程学院,太谷 030801)
藜麦属藜科植物,是南美洲特有的古老物种。几千年前,经过安第斯山脉人驯化,藜麦变成了人们喜爱的谷物食品[1]。藜麦平均蛋白质的质量分数约为16%,淀粉的质量分数为55%左右,脂类以亚油酸为主,同时富含各种维生素和矿物质[2-3]。USDA比较了小麦、玉米、大米、大麦、燕麦和藜麦等常见谷物的营养成分,藜麦显示出绝对优势[4]。此外,藜麦富含皂甙、甾醇和酚类等植物化学物质[5],孩子、老人、乳糖不耐受患者、糖尿病人、高血脂等特殊人群都可食用藜麦并受益[4-6]。藜麦的优势不仅仅是营养价值高,它对气候和土壤条件有极高的抗性[4],对农业的可持续发展具有重要意义[7]。
藜麦的食用基础在国外,目前已有一些藜麦加工与其营养、功能变化方面的相关研究。Anna等[8]通过脉孢菌发酵有色藜麦,所得产品有更多蛋白和膳食纤维,但是脂类物质有所降低。Ramiro等[9]研究不同焙烤条件对藜麦多酚含量、抗氧化性的影响,结果表明高温焙烤后可以增强其抗氧化性,但起主要作用的不是多酚而是一些美拉德产物。Brito等[10]研制一种藜麦无麸质饼干,虽然产品的颜色较深、体积减小,但却富含纤维、必需氨基酸、亚麻酸和矿物质。然而藜麦的食用在国内还属于推广初期[3]。蒸煮是我国居民最常用的烹调谷物方法,蒸煮不仅是熟化的过程,也是各种成分发生变化、产生特殊风味的过程。张玲艳等[11]通过比较蒸、煮对小米中维生素、植酸、多酚的保留率及抗氧化活性,表明对于小米煮是一种较好的加工方式。然而不同蒸煮方式对藜麦营养特性(如维生素保留率、淀粉水解性等)有何影响鲜有报道,风味是食品的重要品质之一,其好坏直接决定了人们的喜好程度,不同蒸煮方式会如何改变藜麦风味也鲜有研究。本实验将对这些问题进行研究,旨在为人们提供更为合理的藜麦食用方式。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
藜麦:青藜1号,采收于2016年秋,由山西清禹鸣商贸有限公司提供。实验选取的样品无蛀虫,无破碎,无交叉污染,保存于密封袋中并置于室温下。
铁氰化钾、氢氧化钠、醋酸钠、盐酸硫胺素、正丁醇、高锰酸钾、没食子酸、乙酸乙酯、葡萄糖、氯化钠,酒石酸钠钾、3,5-二硝基水杨酸、苯酚、亚硫酸氢钠、丙酮等,分析纯:国药集团化学试剂有限公司。
1.1.2 仪器与设备
HZQ-C空气浴振荡器:晋中佳通机电科技有限公司;930型荧光光度计:广州北锐精密仪器有限公司;RE-201D型旋转蒸发器:巩义市英峪仪器厂;HBDG-243L多功能电饭锅:周村海宝电器厂;YS24ED不锈钢压力锅:苏泊尔电器公司;G70F20CN1L-DG微波炉:格兰仕家用电器公司;101-3A电热鼓风干燥箱:北京中兴伟业仪器有限公司;DVB/Carboxen/PDMS萃取纤维:美国Supelco公司;Trace ISQ气相色谱-质谱联用仪:美国Thermo Fisher公司。
1.2 方法
1.2.1 样品制备
藜麦样品用蒸馏水清洗一次,按料液比1:5比例加水后进行蒸煮。参考文献[11],结合实际情况,以熟化为标准,所确定的蒸煮条件见表1。测定营养成分时,用匀浆机将其匀浆成糊状,置于锥形瓶中在4 ℃冰箱中进行保藏。

表1 藜麦蒸煮条件
1.2.2 维生素测定
硫胺素(VB1)检测方法参照GB/T 7628—2008;核黄素(VB2)检测方法参照GB/T 7629—2008。
1.2.3 酚类物质测定
1.2.3.1 游离酚和结合酚的提取
参照徐建国[12]的方法,并稍作改动。称取样品2 g,各3份,参照1.2.1样品制备对藜麦样品进行处理后得到糊状样品溶液,然后依次加入预冷的体积分数为80%的丙酮15 mL,充分混合后在3 500 r/min离心10 min,收集上清于具塞试管中。滤渣用80%的丙酮再次提取,重复提取3次,直至上清几乎无色,收集全部上清,旋蒸至干。用70%甲醇溶解定容至10 mL,即得到游离型多酚提取液。
游离型多酚提取后的剩余残渣进行深度提取。向残渣中加入2 mol/L NaOH,在空气浴振荡箱中振荡1 h,然后用盐酸调节pH至2,再加入乙酸乙酯30 mL,搅拌均匀后静置10 min后3 500r/min离心10 min,收集乙酸乙酯部分,重复操作数次,直至溶液无色。将收集得到的溶液旋干,用70%甲醇润洗数次,并定容至10 mL,即为结合型多酚提取液。
1.2.3.2 没食子酸标准曲线的制作
所得的标准曲线回归方程为Y=0.003 9X+0.003 4,R2=0.999 4,式中:Y为吸光度;X为质量浓度/μg/mL。
1.2.3.3 测定
提取液按照一定体积比进行稀释,吸取稀释后的提取液0.15 mL,加入福林酚试剂1.5 mL,避光反应5 min,再加入1.5 mL 6% Na2CO3于75 ℃下加热10 min,冷却后于725 nm处测定吸光度。多酚含量以每100 g干质量等同于没食子酸的质量(mg)表示。
1.2.4 蒸煮后藜麦淀粉含量的测定
采用DNS法测还原糖含量[13]:以葡萄糖纯品作为标准品,反应后在540 nm处测定吸光度,绘制标准曲线。标准曲线回归方程:Y=0.569X-0.004 2,R2=0.999 0,其中Y为吸光度,X为葡萄糖质量浓度(mg/mL)。
称取1 g样品,加入100 mL 16 mol/L的盐酸和15 mL的蒸馏水混匀,在沸水浴中加热30 min,取1~2滴KI-I2溶液检查淀粉的水解程度,若已水解,则不成蓝色;待水解液冷却之后加入一滴酚酞指示剂,用6 mol/L的NaOH进行中和至溶液呈现微红色,过滤并且稀释至100 mL,得到稀释液,再次从稀释液中吸取10 mL溶液,定容至100 mL,作为样品待测液。取1 mL待测液,加入1 mL蒸馏水和1.5 mL DNS试剂,在沸水浴中反应5 min,立即冷却至室温,用蒸馏水稀释至25 mL,在540 nm测其吸光值,用空白调零,重复3次。

1.2.5 蒸煮后藜麦淀粉的水解指数
体外模拟淀粉消化:参照Goin等[14]的方法,稍作修改。按照1.2.1处理好的样品,加入pH=1.5的HCL-KCI缓冲液10 mL,0.1 g/mL的胃蛋白酶溶液0.2 mL,摇匀后置于40 ℃恒温水浴锅中保温1 h;加入0.5 mol/L的乙酸钠缓冲液,将溶液体积定容至25 mL,再加入α-淀粉酶10 mL,摇匀后将其置于37 ℃恒温水浴锅中进行消化处理;分别在0、30、60、90、120、180 min处吸取1 mL消化液,沸水浴5 min灭酶;在装有消化液的试管中加入1 mL蒸馏水,1.5 mL DNS试剂进行反应,反应液稀释后测量其吸光度,用葡萄糖作为标品,得到各样液中还原糖的含量。
以时间为横坐标,淀粉的水解率为纵坐标绘制淀粉水解曲线。计算各样品和参考食品(白面包,HI=100%)在0~180 min期间淀粉水解曲线下面积比值,得出各样品水解指数(HI),水解曲线下面积(AUC)计算方法参照周一鸣等[15]的方法,具体公式为ACU=C∞(Te-T0)-(Cω/k)[1-exp-k(Te-T0)],C∞为反应平衡时浓度,Te为反应结束时间,T0为反应初始时间,k为一级反应动力常数。其中C∞和k通过淀粉水解曲线方程C=C∞(1-e-kt)计算。
1.2.6 SPME-GC-MS联用技术测定蒸煮后藜麦的挥发性成分
预处理:称取样品1 g,按照1.2.1方法对样品进行处理,后装入20 mL密封顶空样品瓶中,100 ℃平衡20 min,萃取10 min后进样。
色谱条件:HP-5MS毛细管色谱柱(30 m×250 μm,0.25 μm);初始温度45 ℃,保持2 min,以6 ℃/min升至240 ℃,保持5 min。进样口温度270 ℃,载气高纯氦气(99.999%);流速1 mL/min;无分流。
质谱条件:电离方式EI,电子能量为70 eV,离子源温度为280 ℃,接口温度280 ℃,扫描质量范围35~600 u。各组分经过NIST标准谱库检索和Wiley谱库相匹配。
1.3 数据处理
结果均以平均值±标准差表示,多重比较和聚类分析通过IBM SPSS Statistics 22分析。
2 结果与分析
2.1 不同蒸煮方式的藜麦VB1、VB2含量
Koziol等[16]报道的藜麦VB1含量与VB2含量分别为0.38、0.39 mg/100 g。与本研究结果VB1为0.260 6 mg/100 g和VB2为0.193 8 mg/100 g差异较大,可能与测量方法和品种选择有关。并且,加工过程会使VB1和VB2损失,VB1对热加工更为敏感,这与Koziol[16]报道是一致的。VB2耐热性较强,热处理后的含量差异不大,这与党亚丽等[17]的结论相符。
蒸煮时食物所处环境温度升高、在氧气、酶共存的条件下,会加速维生素的氧化破坏作用。经高压和微波蒸煮后,VB1和VB2的稳定性更差[18],其含量要比常压处理的更少。但是,微波处理得到的维生素含量最低(VB1减少了46%,VB2减少了10%),这与Tian等[19]提出的微波加工可保留较多的维生素不相符。造成这样差异的原因可能是由于微波处理中为避免藜麦过分飞溅而用低火使蒸煮时间延长,导致维生素损失多。因此,为避免VB1和VB2大量损失,最好采用常压蒸煮。
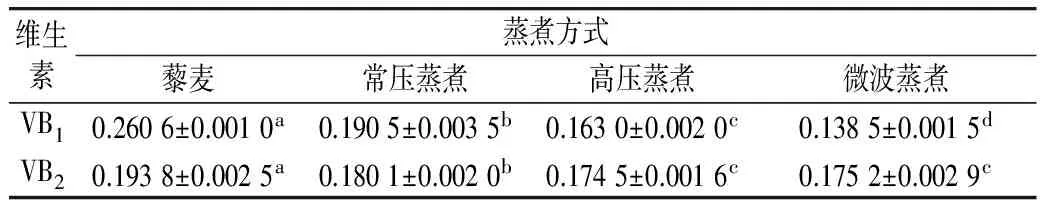
表2 不同蒸煮方式VB1、VB2含量的比较/mg/100 g
注:数值以平均值±SD表示,不同小写字母表示差异显著(P<0.05),余同。
2.2 不同蒸煮方式的藜麦酚类化合物含量
在粮谷中,酚类化合物是重要的活性成分,主要以游离和结合两种形式存在[20]。Fatima等[21]研究了多种有色藜麦的多酚化合物,结果显示不同品种藜麦中游离酚和结合酚的比例相差很大。Nickel等[22]报道藜麦多酚含量为98 mg/100 g,Fatima等[21]测得的有色藜麦多酚含量为250~792 mg/100 g,本实验中藜麦多酚含量为136.253 mg/100 g,且主要是游离酚,占总酚含量的84%。经过不同蒸煮方式处理后,藜麦中的总酚含量都有不同程度下降,其中高压蒸煮后保留的多酚最多,Nickel等[22]的结果也表明高压蒸煮会保留更多的酚类化合物,可能由于在高压下可缩短受热时间。微波蒸煮损失了24.6%的酚类化合物,相比较其他蒸煮方式损失得最多。
藜麦经过蒸煮后,游离酚和结合酚的比例也发生了变化。微波处理后变化最小,游离酚为83.2%,与藜麦原料相比,无显著性差异。高压和常压蒸煮都使藜麦的游离酚减少,结合酚增多,Maillard等[23]也发现进行热处理数小时后的大麦麦芽中结合态的酚酸含量提高。这可能是蒸煮破坏了藜麦籽粒的细胞壁结构,释放出部分更为稳定的结合酚。Tang等[24]报道藜麦中的酚类化合物主要是香草酸和阿魏酸及它们的衍生物,在蒸煮过程中,同时存在着结合型酚类的水解、聚合物的降解作用和游离酚类物质的热降解,而氧气浓度、压力、时间和其他因素都会影响这些过程,蒸煮过程中酚类化合物的变化很复杂,总体来说高压蒸煮有利于酚类物质的保留。

图1 不同蒸煮方式酚类化合物的比较
2.3 不同蒸煮方式的藜麦淀粉水解指数
2.3.1 不同蒸煮方式的藜麦淀粉含量
Semra等[25]报道藜麦的主要碳水化合物是淀粉,质量分数在52%~69%之间,本实验测得的藜麦淀粉含量是66.626 g/100 g。由表3可以看出,经蒸煮后淀粉含量均有所下降。淀粉粒受热会发生吸水、溶胀、破裂,部分淀粉发生糊化,可消化淀粉含量大大增加[26],部分淀粉会水解成葡萄糖,使总淀粉含量下降,其中高压蒸煮较其他方式能使更多的淀粉水解。

表3 不同蒸煮方式淀粉含量的比较
2.3.2 不同蒸煮方式藜麦的水解指数
表4为根据淀粉水解动力学方程计算得到的水解指数(HI)。已有的文献报道藜麦的血糖指数为35[27],属于低血糖生成指数食物。Goni等[14]模拟体外消化淀粉的HI与血糖指数(GI)的关系,表明二者存在显著的正相关性,即HI越大表明食用后在体内血糖升高越快。藜麦原料与蒸煮后的淀粉水解指数差异显著,表明蒸煮过程中会有部分淀粉水解,且经蒸煮后的淀粉更易消化。如图2所示,模拟消化淀粉主要发生在120 min之前,淀粉酶水解淀粉速率快,曲线斜率大,在120 min以后,随着时间的延长,大部分可消化淀粉都被水解,剩余一部分抗消化淀粉不容易被水解,淀粉水解率缓慢上升,最后趋于恒定[26]。常压蒸煮的淀粉水解指数显著低于其他两种蒸煮方式,常压蒸煮可能是更适合糖代谢异常的人使用的烹调方法。

表4 不同蒸煮方式藜麦的水解指数
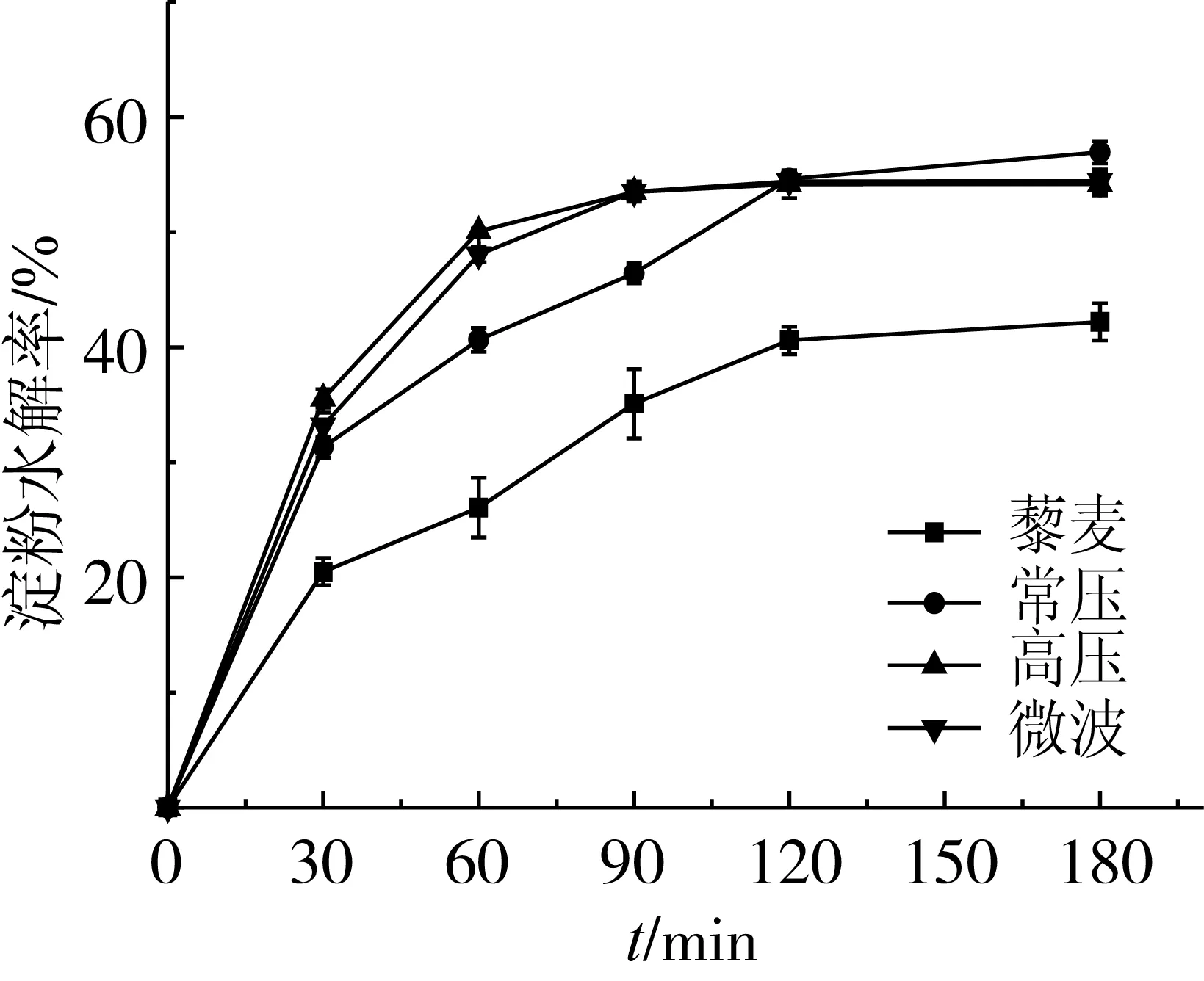
图2 各样品的淀粉水解率
2.3.3 挥发性成分检测
由表5可得,藜麦经常压蒸煮共得到挥发性物质60种,主要包括正辛醛、2-戊基呋喃、壬醛、壬醇、苯乙醛、辛酸乙酯、癸醛、癸酸乙酯、十四酸异丙酯和棕榈酸等化合物,其中醛类物质种类较多且含量最大。藜麦经高压蒸煮后检出48种挥发性化合物,主要有双戊烯、壬醛、癸醛、油酸和烷烃类化合物,如十四烷、十八烷,但是烷烃类化合物对风味贡献不大。微波蒸煮后的藜麦共得到挥发性成分48种,其中含量较多的有双戊烯、壬醛、辛酸乙酯、癸醛、癸酸乙酯、十二醛、肉豆蔻醛、亚油酸和棕榈酸等。有些成分虽含量低,但具有较强的气味活性,如肉豆蔻醛具有温柔的油脂气息,略带柑桔香气[28];十二酸乙酯具有稍带叶样和似花瓣的温和香气,这些物质赋予了藜麦特有的清香风味。
将不同蒸煮方式所得挥发性成分进行聚类分析,见图4,微波蒸煮和高压蒸煮先聚为一类,它们与常压蒸煮结果相差较大。结合气质数据进一步分析,常压蒸煮的挥发性成分总含量最高,香气物质种类最多,而高压蒸煮与微波蒸煮得到的挥发性成分含量低,物质种类较少。即使是三种处理所共有的成分,常压蒸煮组中的含量显著高于其他两组,如壬醛、壬醇、辛酸乙酯、癸醛、癸酸乙酯等。然而,HS-SPME-GC检测出的是所有挥发性成分,其中可能有些成分含量高但不具气味活性或是阈值很低,故对风味贡献不大。

图3 常压蒸煮藜麦挥发性成分总离子流图
注:1为常压蒸煮;2为微波蒸煮;3为高压蒸煮。图4 不同蒸煮方式挥发性成分聚类分析
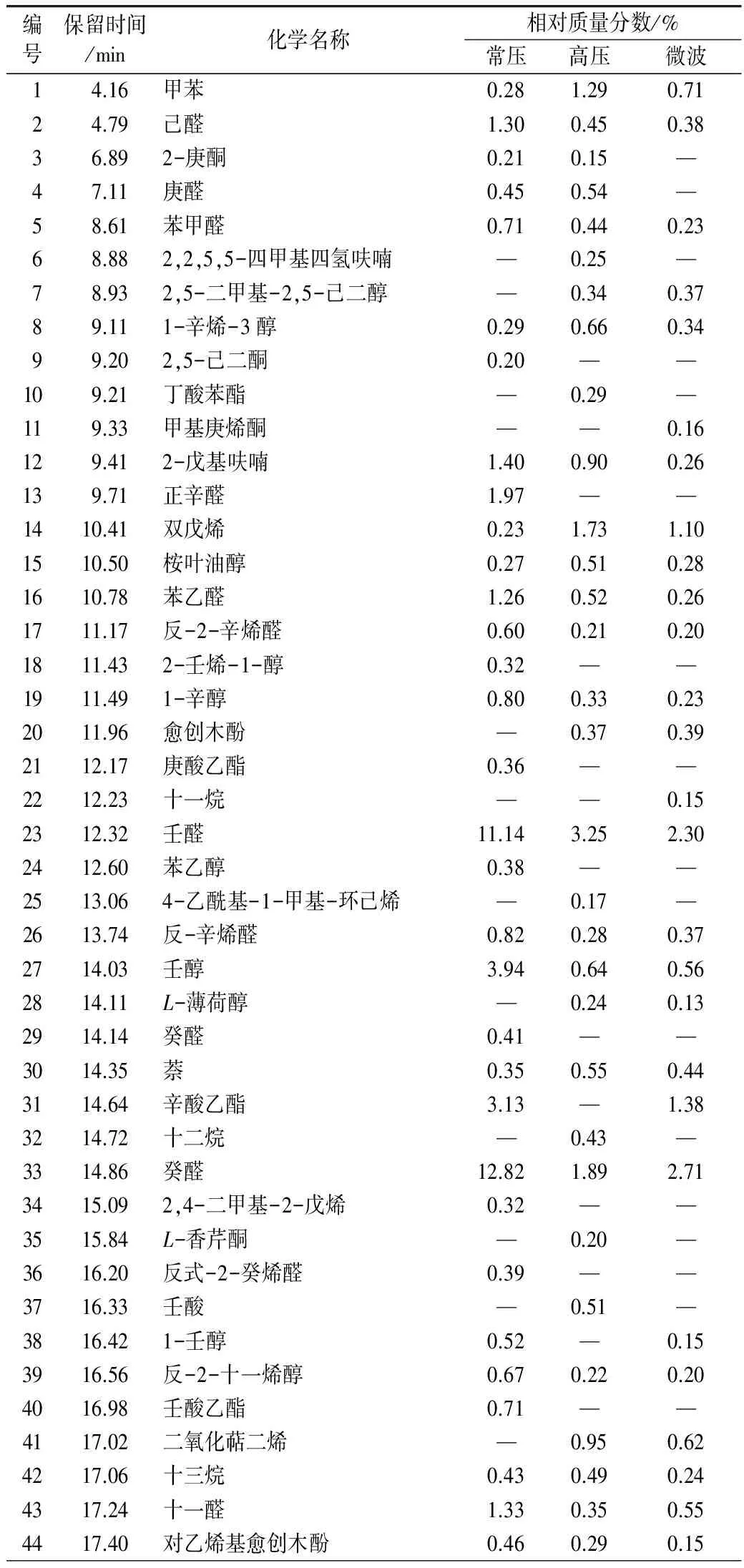
表5 各挥发性成分的种类及含量
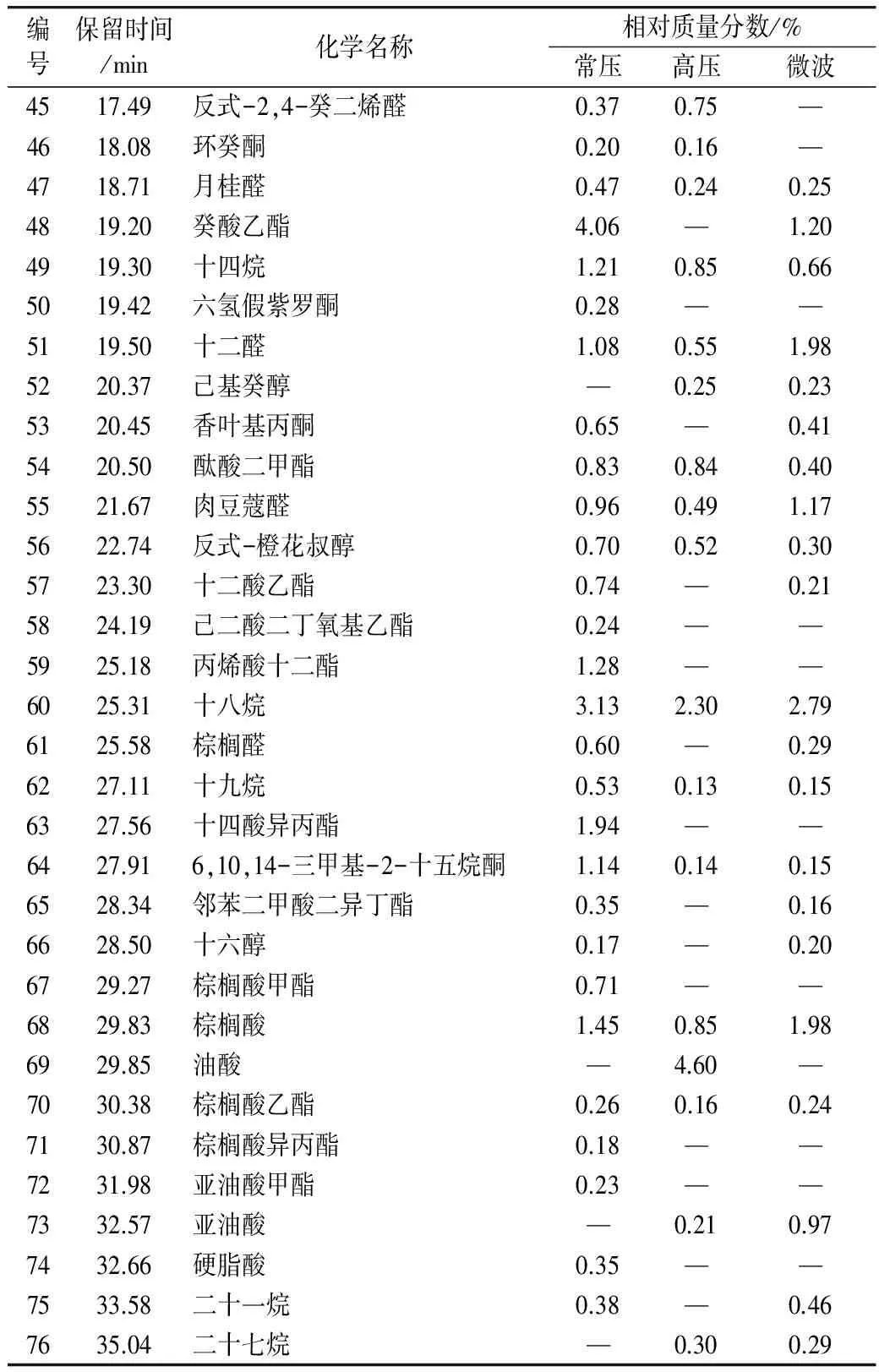
表5(续)
3 结论
比较了常压、高压和微波3种常用的家庭蒸煮方式对藜麦营养特性及风味的影响。经3种蒸煮方式处理后,藜麦VB1含量差异显著,其中常压蒸煮更有利于保留VB1,而微波蒸煮VB1损失最大。热处理对VB2影响较VB1小,且常压蒸煮可保留较多的VB2。3种蒸煮方式都会使藜麦的酚类化合物减少,相比较高压蒸煮能保留较多,其次是常压蒸煮。且经过蒸煮后,藜麦中的酚类化合物的存在形式也会发生改变,游离酚都显著减少,经常压和高压蒸煮后结合酚显著升高,而微波蒸煮后结合酚含量也会减少。已有文献表明,淀粉的水解指数与血糖指数存在正相关关系,常压蒸煮的淀粉水解指数较其他两种方式显著偏低,表明常压蒸煮可能更适合血糖代谢异常的人群。最后,采用SPME-GC-MS联用技术对3种蒸煮方式样品的风味进行分析,共获得76种挥发性成分,主要是醛类、酯类和醇类化合物,其中常压蒸煮藜麦的挥发性物质含量最高,种类最多,赋予藜麦特有的清香风味。因此,常压蒸煮能较好保留VB1和VB2,且有较低的淀粉水解指数,能获得较多的挥发性成分,可能是更适于藜麦的蒸煮方式。
[1]FILHO A M,PIROZI M R,BORQES J T,et al.Quinoa:Nutritional,functional,and antinutritional aspects[J].Critical Reviews in Food Science and Nutrition,2017,57(8):1618-1630
[2]付丽红,李晓斌.基于岭脊分析的藜麦淀粉提取及糊化特性研究[J].农业工程学报,2016,32(18):299-306
FU L H,LI X B.Extraction and gelatinization characteristics of Chenopodium quinoa Willd.Starch based on ridge analysis[J].Transactions of the Chinese Society of Agricutural Engineering,2016,32(18):299-306
[3]任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015,(5):1-5
REN G X,YANG X S,YAO Y.Current situation of quinoa industry in China[J].Crops,2015,(5):1-5
[4]SEMRA N V,NEVIN S.Nutritional and health benefits of quinoa(ChenopodiumquinoaWilld.)[J].Journal of Cereal Science,2016,69:371-376
[5]GRAF B L,ROJAS-SILVA P,ROJO L E,et al.Innovations in health value and functional food development of quinoa(ChenopodiumquinoaWilld.)[J].Comprehensive Reviews in Food Science & Food Safety,2015,14(4):431
[6]ANTONIO V,MARGARITA M,JUDITH V,et al.Nutrition facts and functional potential of quinoa(Chenopodiumquinoawilld.),an ancient Andean grain:a review[J].Journal of the Science of Food & Agriculture,2010,90(15):2541-2547
[7]JACOBSEN S E,MONTEROS C,COREUERA L J,et al.Frost resistance mechanisms in quinoa(ChenopodiumquinoaWilld.)[J].European Journal of Agronomy,2007,26(4):471-475
[8]ANNA S J,BOZENA S,ROBERT D,et al.Fermentation of colored quinoa seeds withneurosporaintermediato obtain oncom-type products of favorable nutritional and bioactive characteristics[J].Cereal Chemistry,2017,94(3):619-624
[9]RAMIRO A C,LEANDRO G D A,Guillermo D M.Effect of roasting conditions on the antioxidant compounds of quinoa seeds[J].International Journal of Food Science and Technology,2016,51:1018-1025
[10]BRITO I L,SOUZA E L,FELEX S S S,et al.Nutritional and sensory characteristics of gluten-free quinoa(ChenopodiumquinoaWilld)-based cookies development using an experimental mixture design[J].Journal of Food Science and Technology-mysore,2015,52(9):5866-5873
[11]张玲艳,李洁莹,韩飞,等.蒸煮对小米营养成分及抗氧化活性的影响[J].食品科学,2017,38:100-106
ZHANG L Y,LI J Y,HAN F,et al.The effects of steaming and cooking on the nutrients and antioxidant activity of millet[J].Food Scicence,2017,38:100-106
[12]徐建国.燕麦发芽过程中多酚含量及其抗氧化活性的变化[J].中国食品学报,2013,13(1):201-205
XU J G.Changes in the phenolic content and antioxidant activity in Oats(AvenaNudaL.)during germination[J].Journal of Chinese Institute of Food Science and Technology,2013,13(1):201-205
[13]田纪春.谷物品质测定理论与方法[M].北京:科学出版社,2006
TIAN J C.The theories and methods of evaluating the quality of cereal[M].Beijing:Scienceg Press,2006
[14]GONI I,ALONSO A G,CALIXTO F S,et al.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437
[15]周一鸣,王宏,崔琳琳,等.萌发苦荞淀粉的理化特性及消化性研究[J].中国粮油学报,2017,32(3):25-29
ZHOU Y M,WANG H,CUI L L,et al.Physicochemical properties and digestibility of germination of buckwheat starch[J].Journal of the Chinese Cereals and Oils Association,2017,32(3):25-29
[16]Koziol M J.Chemical composition and nutritional evaluation of quinoa(ChenopodiumquinoaWilld.)[J].Journal of Food Composition and Analysis,1992,(5):35-68
[17]党亚丽,张中建,闫小伟,等.不同处理方法对牛奶中维生素B2含量的影响[J].食品工业科技,2010,31(11):351-352
DANG Y L,ZHANG Z J,YAN X W,et al.Effects of different treatment on the content of vitamin B2in milk[J].Science and Technology of Food Industry,2010,31(11):351-352
[18]赵洪静,赵月欣.食品加工、烹调中的维生素的损失[J].国外医学卫生学分册,2003,30(4):221-226
ZHAO H J,ZHAO Y X.The loss of food vitamin with processing and cooking[J].Foreign Medical Sciences(Section of Hygiene),2003,30(4):221-226
[19]TIAN J H,CHEN J L,LYU F Y,et al.Domestic cooking methods affect the phytochemical composition and antioxidant activity of purple-fleshed potatoes[J].Food Chemistry,2016,197:1264-1270
[20]吴建永.过热蒸汽法制备轻碾营养米及其理化性质研究[D].南昌:南昌大学,2016
WU J Y.Preparation of lightly milled rice by superheated steam and its physicochemical properties[D].Nanchang:Nanchang University,2016
[21]FATIMA A,ELIZABETH H,ROGER S,et al.Physical features,phenolic comopounds,betalains and total antioxidant capacity of coloured quinoa seeds(ChenopodiumquinoaWilld.)[J].Food Chemistry,2015,183:83-90
[22]NICKEL J,SPANIER L P,BOTELHO F T,et al.Effect of different types of processingon the total phenolic compound content,antioxidant capacity,and saponin content ofChenopodiumquinoaWilld grains[J].Food Chemistry,2016,209:139-143
[23]MAILLARD M N,BEREST C.Evolution of antioxidant activity during kilning:role of insoluble bound phenolic acids of barley and malt[J].Journal of Agricultural & Food Chemistry,1995,43(7):1789-1793
[24]TANG Y,LI X H,ZHANG B,et al.Characterisation of phenolics,betanins and antioxidant activities in seeds of threeChenopodiumquinoaWilld.genotypes[J].Food Chemistry,2015,(166):380-388
[25]SEMRA N V,NEVIN S.Nutritional and health benefits of quinoa(ChenopodiumquinoaWilld.)[J].Journal of Cereal Science,2016,69:371-376
[26]钟耕,陈宗道,Romeo Toledo.不同加工方法对葛根淀粉血糖指数的影响[J].中国粮油学报,2003,18(5):54-57
ZHONG G,CHEN Z D,ROMEO T.Effects ofdifferent processing methods on the glycemic index of kudzu starch[J].Journal of the Chinese Cereals and Oils Association,2003,18(5):54-57
[27]OSHODI A A,OGUNGBENLE H N,OLADIMEJI M O.Chemical composition,nutritionally valuable minerals and functional properties of benniseed(Sesamum radiatum),pearl millet(Pennisetum typhoides)and quinoa(Chenopodiumquinoa)flours[J].1990,50(5):325-331
[28]朱宏.山西老陈醋挥发性成分和流变性质的研究[D].北京:中国农业大学,2016
ZHU H.Research on the volatile compounds and rheological properties of Shanxi aged vinegar[J].Beijing:China Agricultural University,2016.
