河南烟草镰刀菌的分子鉴定及致病性分析
2018-05-09邱睿白静科李成军李淑君李小杰陈玉国胡亚静刘东升
邱睿,白静科,李成军,李淑君,李小杰,陈玉国,胡亚静,刘东升
河南省农业科学院烟草研究所,烟草行业黄淮烟区烟草病虫害绿色防控重点实验室,河南省许昌市永昌大道与青梅路交叉口 461000
镰刀菌(Fusariumspp.)是一类世界性分布的真菌,可以侵染多种植物,引起植物的根腐、茎腐、花腐和穗腐等多种病害。镰刀菌侵染烟草引起的枯萎病和根腐病是世界性的土传真菌病害,在美国、韩国、加拿大、澳大利亚、南非、日本等产烟国普遍发生[1-3]。近两年镰刀菌根腐病在我国烟区的发病范围和发病程度呈上升趋势,目前在云南、河南、湖南、山东、贵州、福建、湖北、安徽等地均有发生[4-11],重病烟田发病率达30%以上[4]。目前,国内外学者在镰刀菌的分类地位与寄主范围、形态学与分子特征、致病机理等方面均有报道[12-16]。河南省烟草镰刀菌根腐病已有报道[4],但有关不同生态区域镰刀菌类型、主要致病菌种类鉴定、菌株致病力的差异及病原菌侵染烟草引起病害的发生、流行规律等均缺乏系统性研究。而明确病原菌的种类及其致病力是指导烟草镰刀菌根腐病防治的基础。rDNA-ITS序列分析可有效弥
补传统形态学鉴定的局限性,目前主要依据结合培养条件的形态学鉴定和真菌18S rDNA的ITS区序列分析解决病原镰刀菌菌种的分类地位[17-18]。因此,本试验选择河南省烟区为切入点,在河南省各大烟区烟草根际土壤中及发病烟株上分离纯化疑似烟草镰刀菌菌株,并对其进行形态鉴定、致病性测定与rDNA-ITS序列测定及分析,旨在明确该病在河南烟区的基本分布及各烟区主要致病菌种类,为今后各烟区防治该病提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
2016—2017年,选择河南省豫南、豫东、豫中和豫西4个生态区的12个烟叶产区,每个烟叶产区选择不同区域、不同田块类型的烤烟烟田,在烟草团棵期、旺长期和成熟期分别进行系统调查和普查,每个烟叶产区选择不同生长期根茎类病害发病较重的9块烟田,取具有典型症状的病株5~10株,截取茎基部与发病根系,同时在每块烟田按5点取样法采取土样(见表1),由河南省农业科学院烟草研究所植物保护研究室进行相关病原菌的分离与鉴定。

表1 采集样品信息Tab.1 Sample information
1.1.2 试剂和仪器
Taq PCR MasterMix(Cat#KT201-02)购 于TIANGEN公司,通用引物ITS1和ITS4由上海生工生物工程技术服务有限公司提供,BIO-RAD PCR仪(美国BIO-RAD公司),Universal Hood Ⅱ凝胶成像系统(美国BIO-RAD公司)。
1.2 试验方法
1.2.1 病原菌的分离
(1)组织分离法。参照文献[19]的方法对病原菌进行分离。在样品病健交界处切取适当大小的组织块,用75%酒精消毒30 s,15%次氯酸钠消毒2 min,再用无菌水清洗3次。无菌吸水纸吸干组织块表面水分后直接接种于含25%乳酸的PDA培养基平板上,25℃恒温培养3~7 d,待组织块周围长出菌落后,挑取边缘菌落进行纯化[11]。依据纯化后的菌落特征分类编号,保存备用。
(2)土壤分离法。参照文献[20]的方法对烟田土壤真菌进行分离。称取混合均匀的土壤1.0 g,放入带有玻璃珠的100 mL三角瓶中,加99 mL无菌水,置摇床震荡10 min使土样均匀分散在稀释液中成为10-2土壤悬浮液,将土壤悬浮液继续稀释成10-3稀释液后涂布于含25%乳酸的PDA培养基平板上,25℃恒温培养3 d,挑取具有镰刀菌特征的菌落进行纯化[11]。依据纯化后的菌落特征分类编号,保存备用。
1.2.2 病原菌的形态学观察
在PDA培养基平板上培养3~4 d的菌株,用打孔器打成直径约4 mm的菌饼,接种于PDA平板中央,25℃恒温培养,观察菌落颜色及形态变化。挑取培养菌丝制作临时水玻片,在光学显微镜下观察菌丝、孢子、产孢细胞、子实体的形态特征,依据Booth分类系统对镰刀菌进行分类鉴定[21]。
1.2.3 分子生物学鉴定
刮取培养基5~7 d的菌丝体50 mg,液氮研磨后转移至EP管中,使用试剂盒提取基因组DNA,提取后的DNA置于-20℃冰箱中保存备用。利用通用引物ITS1和ITS4对所提取的DNA进行PCR扩增,PCR 体 系(25 µL):Taq PCR MasterMix 12.5 µL,10 µL/L 的引物各 1 µL,模板 DNA 1 µL,用 ddH2O将反应体系补至25 µL。PCR反应程序:94℃预变性4 min,94℃变性30 s,55℃退火30 s,72℃延伸1 mim,35个循环;72℃延伸10 min,4℃保存。取5µL PCR扩增产物用2%琼脂糖凝胶电泳检测,观察到合适大小条带后,将所对应的原始扩增产物20 µL送往生工生物工程股份有限公司测序。将测序结果在GenBank上进行BLAST比对,利用 MAGA6.06软件构建系统发育树。
1.2.4 病原菌致病性测定
目前还没有感烟草镰刀菌的鉴别寄主相关报道,本研究选用河南烟区主栽品种中烟100测定病原菌的致病性。烟苗在河南省农业科学院烟草研究所温室大棚培育至4叶期。将致病性鉴定的分离物在PDA培养基上活化培养,从菌落边缘取新鲜的菌丝块,分别接种于麦粒培养基,28℃培养7 d,制成麦粒带菌培养物[22]。接种烟株前,先将灭菌花盆里装一半灭菌土,再将麦粒带菌培养物(每钵接15粒)拌入5 cm左右的表层土中,施足水后在28℃下保湿培养4 d,再移入苗床期健壮的烟苗。将接种的烟苗置于28~30℃人工气候室中保湿培养,拌入无菌麦粒培养物的烟苗为对照,每个处理重复3次,观察发病状况。对发病烟苗采用组织分离法重新分离,镜检观察分离物,完成柯赫氏法则验证[20]。
2 结果与分析
2.1 镰刀菌菌株的分离
2016—2017年,从河南省豫南、豫东、豫中和豫西4个生态区的12个烟叶产区,采集典型烟草镰刀菌根腐病病株222株及土壤样品108份,分离获得镰刀菌,采用单孢分离法进行纯化,共获得纯培养菌株98株,其中50株分离自病株,48株分离自土壤。
2.2 病原菌的形态学特征
根据菌株菌落、菌丝、分生孢子、产孢细胞、子实体等的形态特征及大小,依据Booth分类系统对纯化菌株进行分类鉴定,初步将98个菌株分为尖孢镰刀菌(Fusarium oxysporum)、茄病镰刀菌(Fusarium solani)、层出镰刀菌(Fusarium proliferatum)、木 贼 镰 刀 菌(Fusarium equiseti) 和Fusarium nematophilum5组。
菌株1-80号为尖孢镰刀菌,在PDA培养基上菌落多为白色和粉白色,表面产生大量孢子粉,后期菌落产生橙、紫、深蓝或黑色色素,菌丝致密,部分菌落背面可见明显轮纹;在显微镜下可观察到两种类型的分生孢子,小型分生孢子数量多、卵圆形,多无分隔,5~12 µm×3~3.5 µm;大型分生孢子纺锤形,顶端钩状,基部有足细胞,23~53 µm×2.7~5.5 µm(图1A、A’)。菌株81-90号为茄病镰刀菌,在PDA培养基上菌落为白色,表面产生肉粉色粉孢子团,呈环状排列;在显微镜下小型分生孢子肾形、椭圆形和卵形,无分隔,5.4~17.7 µm×1.4~4.5 µm,大型分生孢子量多、马特形,顶部钝圆,3~5隔膜,34.4~ 50.4 µm×4.3~ 5.8 µm( 图 1B、B’)。 菌 株91-95号为层出镰刀菌,在PDA培养基上为初为白色,后为紫红色,气生菌丝白色、浓密,可形成蓝黑色菌核;在显微镜下小型分生孢子卵状,0~1隔膜,5.7~13.9 µm×2.4~4.8 µm,大型分生孢子呈镰刀形,较直、顶孢较尖,足孢明显,3~5隔膜,20.6~49.0µm×2.3~4.9 µm(图1C、C’)。菌株96、97号为木贼镰刀菌,在PDA培养基上菌落白色,菌丝中间致密周围稀疏,菌落正面产生黄色孢子粉;在显微镜下观察,其小型分生孢子卵圆形,5~12 µm×2~3.5 µm,大型分生孢子纺锤形,中部显著膨大,基部有足细胞,3-5个分隔,23~53 µm×2.5~5.5 µm(图1D、D’)。菌株98号为Fusarium nematophilum,在PDA培养基上菌落白色,菌丝致密,菌丝表面呈现连续环纹;在显微镜下观察仅见大型分生孢子,镰刀形,3~5个分隔,83~115 µm×2.5~5.5 µm(图1E、E’)。
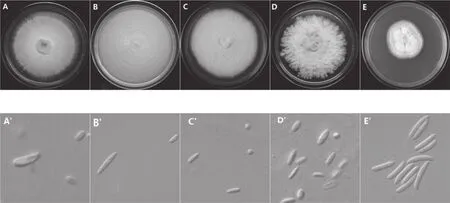
图1 分离镰刀菌在PDA培养基上的形态特征Fig.1 Morphological characteristics of Fusarium spp. on PDA medium
2.3 病原菌rDNA-ITS序列分析
通过真菌ITS1和ITS4通用引物对分离纯化的98个株菌株进行rDNA-ITS序列测定,获得有效序列长度为493~567 bp。将98个DNA序列与GenBank中已登录的镰刀菌序列进行同源性比对,并用MEGA 6.06软件构建系统发育树(图2)。结果表明, 1-80号菌株的rDNA-ITS序列与数据库中登录号为KX421442.1尖孢镰刀菌(F. oxysporum)的亲缘关系最近,同源性达99%以上,分子鉴定结果与形态学鉴定结果一致,从而鉴定菌株1-80号为尖孢镰刀菌;81-90号菌株rDNA-ITS序列与GenBank中KY617036.1茄病镰刀菌(F. solani)序列同源性为100%,与形态学鉴定结果一致,说明81-90号菌株为茄病镰刀菌;91-95号菌株序列与数据库中KY425734.1层出镰刀菌(F. proliferafum)序列同源性在93%以上,结合形态学特征将这5个菌株鉴定为层出镰刀菌;96、97号菌株的rDNA-ITS序列与GenBank中KJ412501.1木贼镰刀菌(F. equiseti)的亲缘关系最近,同源性为99%,与形态学鉴定结果一致,从而确定97、98号菌株为木贼镰刀菌;98号菌株的rDNA-ITS序列与GenBank中KY617040.1F. nematophilumMHE 9 MC菌株序列同源性最高(99%),表明98号菌株为F. nematophilum。

图2 部分菌株rDNA-ITS序列的系统发育树Fig.2 Phylogenetic tree of partial strains rDNA-ITS sequence
2.4 病原菌致病性分析
烟苗接种病原菌7 d后观察烟苗发病情况,供试的98个菌株中,48个菌株处理的烟苗出现典型病症:病株叶片由下向上逐步变黄、皱缩枯萎;病株根茎部呈不同程度腐烂,须根明显减少,对照烟苗均未发病且生长良好(图3)。对发病烟苗进行病原物分离、纯化,镜检观察获得的纯培养物,其形态与接种的病原菌相同,证明所分离到的镰刀菌菌株具有致病性。在引起烟株发病的48个镰刀菌分离物中,尖孢镰刀菌39株、茄病镰刀菌5株、层出镰刀菌3株、木贼镰刀菌1株,其中36个菌株分离自病株,占75%,12个菌株分离自土壤,占25%。豫南致病性镰刀菌包括尖孢镰刀菌、层出镰刀菌和木贼镰刀菌,以尖孢镰刀菌为主;豫中为尖孢镰刀菌;豫东、豫西为茄病镰刀菌和尖孢镰刀菌。

图3 病原菌致病性测定Fig.3 Pathogenicity determination of the Fusarium isolate
3 讨论
镰刀菌根腐病是一种重要的土传根茎类病害,田艳艳等[4]认为引起河南省烟草枯萎病与根腐病的优势病原种群是尖孢镰刀菌和茄病镰刀菌。本研究通过病原菌形态学特征观察、病原菌rDNA-ITS序列分析及致病性测定,认为河南省烟草镰刀菌根腐病病原菌为尖孢镰刀菌、茄病镰刀菌、层出镰刀菌和木贼镰刀菌,其中木贼镰刀菌侵染烟草在河南为首次报道。48种致病性病原菌中尖孢镰刀菌占81.25%,为引起全省烟草镰刀菌根腐病的优势致病菌,这与陈高航[9]报道的湖北省恩施烟草主产区烟草根腐病致病菌是尖孢镰刀菌的结果相符,与桑维钧等[7]研究认为茄病镰刀菌是贵州省烟草根腐病的优势病原菌的结论存在差异。研究发现镰刀菌根腐病致病性菌种种类和致病力差异与植物所生存的生态条件及植物本身抗感性等条件密切相关[9]。贵州烟田微生态环境及主栽烟草品种与河南省存在差异,可能导致两省烟草根腐病的主要致病菌不同;田艳艳等分析待测菌株致病性所使用的烟草品种是小黄金1025,本研究用到的烟苗是中烟100,可能两种烟草品种对不同镰刀菌的抗感性不同,从而导致致病性测定结果的差异,且本研究测定镰刀菌的致病性所使用的烟草品种是目前生产中的主栽品种,切合实际,对生产更具指导意义。在测定菌株致病性时,陈高航[9]、田艳艳等[4]通过划伤烟苗根茎部,为待测菌人为制造入侵点,其结果会造成假阳性,本研究通过无创接种法,菌株自行寻找宿主入侵,贴近自然环境发病情况,试验数据更可靠。本研究共分离纯化出98株镰刀菌,在本实验条件下只有48株在中烟100上有致病性,其余50个菌株无致病性的原因可能是菌株本身不致病,或是烟株发病慢、症状不明显,也可能是中烟100对菌株有抗性,但目前还没有感烟草镰刀菌的鉴别寄主相关报道,纯化镰刀菌菌株对不同烟草品种的致病性有待进一步深入研究。
本研究分离纯化出的木贼镰刀菌经致病性测定能够侵染烟草品种100,这一结果与桑维钧等[7]的测试结果一致。该病原菌还可以引起小扁豆根腐病[23]、苜蓿根茎腐烂病[24]等,但不同烟草品种对木贼镰刀菌的抗感性及其致病性的强、弱有待进一步测定。
4 结论
明确不同烟区烟草镰刀菌根腐病的主要致病菌,对有效控制烟区病害的发生具有重要意义。本研究通过对河南省不同烟叶产区烤烟根腐病病原菌进行分离纯化、鉴定和致病性分析,确定尖孢镰刀菌为全省烟区重点防控对象,豫南烟区还需加强层出镰刀菌和木贼镰刀菌的防控,豫东、豫西需监测茄病镰刀菌的发生及防治。
[1]LaMondia A J. Fusarium wilt of tobacco[J]. Crop Protection, 2015,73:73-77.
[2]Jeong H K. Research on tobacco plant diseases in Korea: An overview[J]. Res. Plant Dis. 2002, 8(2):78-83.
[3]Kynet K, Makabe S, Valentie O N, et al. Synthetic chitinase gene driven by root-specificLjNRT2andAtNRT2.1promoters confers resistance toFusarium oxysporumin transgenic tobacco and tomato[J]. Plant Biotechnol Rep, 2014, 8:151-159.
[4]田艳艳, 王伟杰, 苗圃, 等. 河南烟草镰刀菌的初步分子鉴定[J]。烟草科技, 2014(11):89-92.TIAN Yanyan, WANG Weijie, MIAO Pu, et al. Preliminary molecular identification ofFusariuminfecting tobacco in Henan[J].Tobacco Sciense & Technology, 2014(11):89-92.
[5]陈瑞泰, 朱贤朝, 王智发, 等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学, 1997, 1(14):1-7.CHEN Ruitai, ZHU Xianzhao, WANG Zhifa, et al. A report of investigating and studying tobacco infectious diseases of 16 main tobacco producing provinces (regions) in China[J]. Chinese tobacco science, 1997, 1(14):1-7.
[6]黄声仪, 萧启明, 赵松义, 等. 湖南省烟草侵染性病害的调查研究[J]. 湖南农学院学报, 1992 (S2):470-482.HUANG Shengyi, XIAO Qiming, ZHAO Songyi, et al. Study on tobacco (Nicotiana tabacum L.) infective diseases in Hunan province[J]. Journal of Hunan agricultural college, 1992 (S2):470-482.
[7]桑维钧, 祝明亮, 吴兴禄, 等. 烟草镰刀菌根腐病研究初报[J].山地农业生物学报, 1998, 17(3):140-141, 145.SANG Weijun, ZHU Mingliang, WU Xinglu, et al. A preliminary report of tobacco root rot caused byFusariumSp. Journal of Mountain Agriculture and Biology, 1998, 17(3):140-141, 145.
[8]陈志敏. 福建省烟草根茎病害诊断及防治药剂筛选[D]. 福州:福建农林大学, 2009.CHEN Zhimin. Diagnosis and screening chemicals to control of tobacco root and stem diseases in Fujian province[D]. Fuzhou:Fujian agriculture and forestry university, 2009.
[9]陈高航. 烟草根腐病病原鉴定及其生物学特性观察[D]. 武汉:华中农业大学, 2013.CHEN Gaohang. The identification of tobacco root rot pathogen and its biological characteristics[D]. Wuhan: Huazhong agricultural university, 2013.
[10]李冰. 烟草新病害:茎黑腐病及安徽省烟田土壤几种病原物的分子检测研究[D]. 合肥:安徽农业大学, 2013.LI Bing. New disease of tobacco: Stems black rot and molecular detection of tobacco field pathogens in Anhui province[D]. Hefei:Anhui agricultural university, 2013.
[11]赵杰. 山东省烟草镰刀菌根腐病病原及生物学特性的研究[D].北京:中国农业科学院, 2013.ZHAO Jie. Identification and study on biological characteristics of the pathogen ofFusariumcausing tobacco root-rot in Shandong province[D]. Beijing: Chinese academy of agricultural sciences,2013.
[12]Trabelsi R, Sellami H, Gharbi Y, et al. Morphological and molecular characterization ofFusariumspp. associated with olive trees dieback in Tunisia[J]. 3 Biotech, 2017, 7(28):1-9.
[13]杨莹莹, 刘波, 肖荣凤, 等. 番茄、茄子和辣椒枯萎病原菌分子鉴定及其致病性测定[J]. 热带作物学报, 2012, 33(5):906-912.YANG Yingying, LIU Bo, XIAO Rongfeng, et al. Pathogen molecular identification and pathogenicity testing ofFusariumwilt from tomatoes, eggplants and peppers[J]. Chinese Journal of Tropical Crops, 2012, 33(5):906-912.
[14]韩鲁明, 张金利, 王丽君, 等. 西瓜砧木种传镰刀菌的种类鉴定及其致病性研究[J]. 种子, 2013, 32(1):31-35.HAN Luming, ZHANG Jinli, WANG Lijun, et al. Study on identification of seedborneFusariumspecies of rootstock for watermelon grafting and their pathogenicity[J]. Seed, 2013,32(1):31-35.
[15]韩珊, 朱天辉, 李芳莲. 植物病原真菌毒素作用机理研究进展[J]. 四川林业科技, 2008, 29(6):26-30.HAN Shan, ZHU Tianhui, LI Fanglian. Advances in researches on mechanism of plant pathogenic mycotoxins[J]. Journal of Sichuan Forestry Science and Technology, 2008, 29(6):26-30.
[16]Wollenweber H W, Reinking O A. DieFusarien[M]. Berlin, Paul Parey, 1935.
[17]Tan M K, Niessen L M. Analysis of rDNA ITS sequences to determine genetic relationships among, and provide a basis for simplified diagnosis ofFusariumspecies causing crown rot and head blight of cereals[J]. Mycol. Res, 2003, 107(7):811-821.
[18]朱宏建, 孙元华, 刘燕娟, 等. 片烟贮藏期霉菌的分子鉴定及杀菌剂的室内毒力测定[J]. 中国烟草学报, 2011,17(2):63-66,70.ZHU Hongjian, SUN Yuanhua, LIU Yanjuan, et al. Identification of mold fungi in stored tobacco using molecular biology technique and toxicity of fungicides[J]. Acta Tabacco Sinica, 2011,17(2):63-66,70.
[19]方忠达. 植病研究方法[M]. 3版. 北京:中国农业出版社,1998:11-65.FANG Zhongda. Methodology for plant pathology[M]. Beijing:China Agricultural Press, 1998:11-65.
[20]白静科. 嵩县烟草根际微生物多样性研究[D]. 洛阳:河南科技大学, 2013.BAI Jingke. Studies on microbes diversity in tobacco rhizosphere in Song county[D]. Luoyang: Henan university of science and technology, 2013.
[21]布斯·镰刀菌属[M]. 陈其烘, 译. 北京:农业出版社, 1988.Booth, C. The genus fusarium[M]. CHEN Qihong, translate.Beijing: Agricultural Press, 1988.
[22]樊少华. 甘肃省干旱灌区苜蓿地土壤镰刀菌致病性研究[D]. 甘肃:甘肃农业大学, 2007.FAN Shaohua. The pathogenicity of Fusarium associated with Alfalfa in arid-irrigated area of Gansu province in China[D].Gansu: Gansu agricultural university, 2007.
[23]安欢乐, 燕翀, 徐娜, 等. 3种镰刀菌对小扁豆生长的影响[J].草业科学, 2016, 33(1):67-74.AN Huanle, YAN Chong, XU Na, et al. Effects of threeFusariumspp. on the growth of lentil in Huining county, Gansu province[J].Pratacultural Science, 2016, 33(1):67-74.
[24]辛宝宝, 袁庆华, 王瑜, 等. 不同苜蓿材料对木贼镰刀菌根腐病的抗病性评价[J]. 植物保护, 2016, 42(5):158-164.XIN Baobao, YUAN Qinghua, WANG Yu, et al. Evaluation on resistance of different germplasms of Alfalfa toFusarium equiseti[J]. Plant Protection, 2016, 42(5):158-164.
