弓形虫病诊断方法研究进展
2018-05-09张义伟陈启军
张义伟,鲍 丽,张 婷,李 娇,段 萍,冯 颖,陈启军,姜 宁
(1. 沈阳农业大学畜牧兽医学院,辽宁沈阳 110866;2. 辽宁省血液中心,辽宁沈阳 110000)
弓形虫是顶器复合门原虫,属于孢子虫纲真球虫目,是一种常见的寄生虫,引起的弓形虫病是危害人畜健康和经济发展的人兽共患病之一。免疫力正常的宿主感染弓形虫后,常处于无症状带虫状态,不易被发现,只有检出病原体或血清抗体时才可确诊[1]。临床上一些非典型表现,以及其与边界病的相似之处,会导致误诊和不恰当治疗。弓形虫可引起绵羊和山羊流产或产弱羔及木乃伊胎,临床症状与边界病或羊衣原体病有很多类似之处。牛患弓形虫病虽然少见,但我国、德国、加拿大和新西兰等多个国家签署的有关进口牛卫生条款中,也将其列为须规定检疫的疫病[2]。猪感染弓形虫后会出现高热,呼吸及神经系统症状,怀孕母猪流产,产死胎,甚至死亡。因此,在牛、羊和猪等牲畜的检疫工作中,准确检疫和科学处理可大大减少,因弓形虫导致经济损失。
从血液或体液中分离弓形虫,在组织中检测寄生虫,或通过DNA探针检测特定的核酸,并通过血清学检测由宿主合成的弓形虫特异性免疫球蛋白等,均可作为弓形虫的检测方法[3]。国家质量监督检验检疫总局发布的检验方法主要有间接血凝 试 验(Indirect hem agglutination test,IHA)、酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)、间接免疫荧光测定(Indirect immuno fluorescence assay,IFA)、免疫酶试验法(Immunoenzymatic assay ,IEA)和聚合酶链式反应(Polymerase chain reaction,PCR)。这些检测方法各有优劣。快速诊断与鉴定弓形虫,是防控该病的良好手段,所以找到简单、有效、快速、准确的弓形虫病诊断方法尤为重要。
1 染色试验(Sabin-feldman dye test,DT)
DT于1948年首次应用,曾被视为检测人类弓形虫抗体的金标准,是弓形虫病病原特有的血清学检测方法和最有价值的检测手段,具有良好的特异性、敏感性和重复性。但若选用体外培养的速殖子,由于毒力较弱,也可能出现假阴性。因此,进行检查时必须使用活的、有毒力的速殖子,但由于存在危险性,DT法未能得到广泛引用。Udonsom等[4]收集了210份人血清样本并用常规DT试验和间接免疫荧光抗体染色试验(Indirect fluorescent antibody test,IFAT)进行对比,发现利用从小鼠体内获得的速殖子,应用传统DT试验检测的检出率为4.3%,IFAT检出率为3.8%。而利用从体外培养的速殖子检测显示,DT和IFAT方法的检出率均为2.8%。2005年,Oncel等[5]使用DT和乳胶凝集试验(LAT)对从亚洛瓦2个地区的63只大于1岁的绵羊收集的血清进行了抗弓形虫抗体测试,在所测试的63个样品中,分别有42个(66.66%)和41个(65.08%)通过DT和LAT法确定为血清反应阳性。试验中DT为主要参考方法。所以,即使检测方法逐年增多,DT法仍然是检测弓形虫病的有效手段。
2 间接血凝试验(IHA)
IHA的主要原理是对红细胞致敏的弓形虫可溶性抗原可由阳性血清凝集,可形成抗原-抗体复合物,具有微量、快速、敏感等优点。然而一些急性和先天性感染可能不被检出,且由于可以和血吸虫病患者血清产生交叉反应,导致检测结果特异性不高。但由于有简便快速的特点,IHA常被应用于流行病学调查中[6]。Luo等[7]也利用商业化IHA试剂盒对江西省动物园中的野生动物和13个县的动物进行了弓形虫抗体测定,同时利用该法对我国湖北省4个森林和乡村地区进行了弓形虫流行病学调查[8]。应用这一检测方法,可以更方便研究者进行流行病学调查,从而有助于规划我国各地区对动物弓形虫感染的预防。
3 改良凝集试验(Mend agglutination test,MAT)
MAT法由Dubey[9]建立,被认为是特异敏感的检测方法,所用材料主要是由福尔马林固定的弓形虫速殖子和U型微孔板。MAT还可以用于感染早期抗体的检测。2017年,Fortes等[10]用MAT法调查了巴西南部94个羊群中1 058只山羊的弓形虫感染情况,并与IFAT法和ELISA法进行了比较。结果显示:IFAT、ELISA和MAT的检出阳性率分别为30.0%、33.3%和25.3%。通过统计学分析,3种检测方法结果相关,没有显著差异。而MAT的结果不同,取决于制备抗原的保存剂。以丙酮代替福尔马林可检测急性感染中的IgG抗体。这对获得性免疫缺陷综合征患者和急性腺性弓形虫病诊断有重要意义[11]。此外,MAT还可用于检测屠宰绵羊体液中的弓形虫感染,其灵敏度高于其他血清学试验[12]。该方法简便、准确,便于实验室诊断和流行病学调查,是目前公认的弓形虫检测金标准。
4 间接免疫荧光抗体染色试验(IFAT)
IFAT是一种简单的人或动物体内弓形虫IgM和IgG抗体检测方法[13]。该方法先将弓形虫速殖子与待测血清孵育,之后加入荧光素标记的抗体,结果在荧光显微镜下观测。Dos等[14]和Shaapan等[15]利用该方法检测,发现出敏感性为80.4%~100.0%,特异性为91.4%~95.8%。然而,在这一方法的应用中,荧光显微镜是必须设备,对结果需要人眼主观判断,很有可能产生主观差异。而且,该方法会与类风湿因子等发生交叉反应,特异性差[16]。
5 酶联免疫吸附试验(ELISA)
ELISA是用于检测不同动物血清和肉汁中弓形虫抗体的血清学试验,可以在短时间内进行大量检测。ELISA系统通常包括固相抗原或抗体、酶标记抗原或抗体,以及酶反应的底物,可以进行抗体和抗原修饰。目前,已经有多种类型的ELISA方法可用于检测弓形虫抗体或抗原,如间接ELISA、夹心ELISA和亲和力ELISA法等。
5.1 间接ELISA
在间接ELISA中,先把抗原涂覆到固相上,之后加入含有抗体的样本,再添加一种级联的酶抗体来增强抗原抗体反应,通过生成颜色来量化评价酶的反应(图1)。几乎所有测试都可用于检测抗弓形虫IgG、IgM和IgA抗体[17]。在常规间接ELISA方法中,利用速殖子抗原(Tachyzoite lysate antigen,TLA)作为包被抗原,在检测人和动物抗弓形虫IgG和IgM抗体时,与其他检测方法(如DT、MAT和IFAT)有高度一致性。尽管这一结果令人满意,但在不同实验室和不同产品批次间,检测结果仍然存在差异,且难以评估,因此使用另一种重组蛋白方法,它具有抗原精确、易于标准化的优点。在过去的20多年里,许多的重组抗原,包括致密颗粒抗原GRA1、GRA2、GRA4、GRA6、GRA7、和GRA8,棒状体蛋白ROP1和ROP2,基质蛋白MAG1,微线体蛋白MIC2、MIC3、MIC4、和MIC5,表面抗原SAG1和SAG2等,均已在大肠杆菌和酵母中表达,对于人类或动物ELISA检测具有潜在诊断价值。重组蛋白抗原组合使用较单一抗原,因而检测结果的特异性和敏感性更强,如SAG2A、GRA2、GRA4、ROP2、GRA8和GRA7的组合,很有可能用于人类和动物感染早期IgG 抗体的检测[18],ROP1、SAG1、GRA7、GRA8和GRA6则很有可能用于特异性IgM抗体的检测[19],然而 GRA7和GRA8一般是用来检测特异性IgA抗体的。

图1 间接ELISA系统模式
5.2 夹心ELISA
在夹心ELISA中,先把抗原或抗体包被在固相上,再把抗体或抗原加入反应体系,进行孵育和洗涤后,抗原抗体复合物就会固定在固相上。被捕获的抗体或抗原通过添加酶标记的特异性抗原或抗体来检测。在人类IgM抗体检测时,这种方法比IFAT的特异性和敏感性更强[17]。另一种从两种物种中制备的抗MIC10抗体夹心ELISA法,可以用于检测循环抗原MIC10,用弓形虫病的早期诊断[20](图2)。
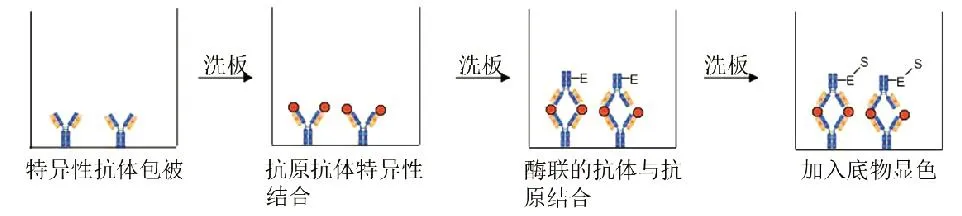
图2 夹心ELISA系统模式
5.3 亲和力ELISA
亲和力ELISA定量试验法早期主要用于风湿病毒感染检测,可以区分风湿病毒的初次感染和以往感染。2001年,Villavedra等利用改进的亲和力ELISA法和聚丙烯酰胺凝胶电泳(SDS-page),结合电洗脱,分离了30~33 KDa的抗原决定簇(根据N端序列数据得出该抗原主要由SAG1和植物几丁质等具有高度同源性的蛋白组成),与全抗原IgG亲和力指数相比,该抗原更能区分弓形虫的急性和慢性感染。Sager等[21]使用亲和纯化的天然刚地弓形虫P30抗原进行IgG的亲和力试验,显示抗体可使抗原的功能性亲和力上升,因而可以确定绵羊急性和慢性弓形虫感染。P30抗原可以从市面上直接购得,省时省力,在弓形虫急慢性感染鉴定中有较高的应用价值。
6 免疫胶体金技术(Immune colloidal gold technique,GICT)
GICT是以胶体金作为示踪标志物,应用于抗原抗体的一种新型免疫标记技术。20世纪70年代[22],免疫化学领域胶体金的引入,为研制特异、敏感、快速、便捷的免疫学检测技术和临床诊断方法奠定了基础。在检测弓形虫阳性血清时,山羊弓形虫病免疫胶体金快速检测试纸条血清稀释倍数可达到1∶5 120,且制备的试纸条与山羊球虫阳性血清、山羊布氏杆菌和日本血吸虫阳性血清均无交叉反应。王艳华等[23]利用自主研制的弓形虫免疫胶体金快速检测试纸条,对猪弓形虫阳性血清、猪瘟阳性血清、猪传染性胸膜炎阳性血清和猪衣原体阳性血清进行检测,发现猪弓形虫病血清与其他血清均无交叉反应,特异性好。且该试纸条在兔子感染后第3天即可检测到抗体,比间接血凝试验(5天)更快,说明该试纸条的灵敏性更高。免疫胶体金快速检测试纸条具有良好的特异性、敏感性、重复性和稳定性,可用于弓形虫病的早期检测和诊断,适合在基层推广应用。
7 干扰素释放反应(Interferon-gamma release assay,IGRA)
IGRA主要应用于弓形虫感染早期,是检测细胞介导的一种抗弓形虫免疫体外诊断手段,操作简易,成本较低。在我国,IGRA主要应用于牛结核病检测[24]。在弓形虫检测方面,目前主要应用于人。在弓形虫感染阶段,机体有很强的Th1型反应[25-26]。这一免疫应答反应的特征是寄生虫会诱导产生大量IL-12和IFN-γ。IGRA可以准确地将感染患者与未感染患者区分,而且即使由弓形虫抗原刺激全血标本仅1天,也会有很强的淋巴细胞活化反应[27]。Chapey等[28]研究发现弓形虫感染患者的IFN-γ分泌明显高于未感染者。Fatoohi等[29]研究发现,将弓形虫感染患者的细胞暴露在有弓形虫可溶性抗原的条件下,会产生大量的IFN-γ,而在女性阴性细胞中不存在IFN-γ分泌上调现象。Cristina等[30]研究发现,与阴性对照相比,从弓形虫血清阳性患者中获得的外周血单个核细胞,在用GST-BAG1重组蛋白质刺激后,IFN-γ的分泌水平会增加8~20倍。在先天性弓形虫病诊断中,Emmanuelle等[28]对在怀孕期间感染患者所生的1岁以下婴儿进行检测,发现检查结果的敏感性和特异性分别为94%和98%。IGRA的发展是弓形虫早期诊断的一项重要进步,强调了评估细胞免疫的重要性,有利于先天性弓形虫病的早期诊断。因此,IGRA将会成为一种潜在有效的人和动物弓形虫感染的早期检测工具。
参考文献:
[1] 候照峰,王尚尚,贾红,等. 弓形虫荧光定量PCR检测方法的建立与初步应用[J]. 中国兽医杂志,2015,51(1):3-6.
[2] 洪雷 . 牛弓形虫病[J]. 中国动物检疫,2000,17,(4):44.
[3] HOLECG L. Toxoplasma gondii recombinant antigens as tools for serodiagnosis of human toxoplasmosis:current status of studies[J]. Clinical&vaccine immunology cvi,2013,20(9):1343-1351.
[4] UDONSOM R,BUDDHIRONGAWATR R,SUKTHANA Y. Is sabin-feldman dye test using t.gondii tachyzoites from animal inoculation still the best method for detecting toxoplasma gondii antibodies?[J]. Southeast asian journal of tropical medicine & public health,2010,41(5):1059.
[5] ONCEL T,VURAL G,BABUR C,et al. Detection of toxoplasmosis gondii seropositivity in sheep in yalova by sabin feldman dye test and latex agglutination test[J].Turkiye parazitolojii dergisi,2005,29(1):10-12.
[6] YAMAMOTO Y I,HOSHINOSHIMIZUS,CAMARGO M E. A novel IgM-indirect hemagglutination test for the serodiagnosis of acute toxoplasmosis[J]. Journal of clinical laboratory analysis,1991,5(2):127.
[7] LUO H,LI K,HUI Z,et al. Seroprevalence of Toxoplasma gondiiinfection in zoo and domestic animals in Jiangxi Province,China[J]. Parasite-journal de la societe francaise de parasitologie,2017,24(7):7.
[8] LUO H,LI K,SHAHZAD M,et al. Seroprevalence of toxoplasma gondii infection in wild boars,wild rabbits,and wild chickens in Hubei Province,China[J]. Korean journal of parasitology,2017,55(1):85-88.
[9] DUBEY J P. Validation of the specificity of the modified agglutination test for toxoplasmosis in pigs[J]. Veterinary parasitology,1997,71(4):307-310.
[10] FORTES M S,LOPES-MORI F M R,CALDART E T,et al. Caprine toxoplasmosis in Southern Brazil:a comparative seroepidemiological study between the indirect immunofluorescence assay,the enzyme-linked immunosorbent assay,and the modified agglutination test[J]. Tropical animal health & production,2017,50(2):1-7.
[11] MONTOYA J G,BERRY A,ROSSO F,et al. The differential agglutination test as a diagnostic aid in cases of toxoplasmic lymphadenitis[J]. Journal of clinical microbiology,2007,45(5):1463-1468.
[12] VILLENA I,DURAND B,AUBERT D,et al. New strategy for the survey of Toxoplasma gondii in meat for human consumption[J]. Veterinary parasitology,2012,183(3/4):203-208.
[13] ARTHUR M J,BLEWETT D A. IFAT detection of IgG specific to toxoplasma in thoracic fluids from aborted lambs:evaluation on routine diagnostic submissions[J].Veterinary record,1988,122(2):29-31.
[14] DOS S T R,NUNES C M,LUVIZOTTO M C,et al.Detection of Toxoplasma gondii oocysts in environmental samples from public schools[J]. Veterinary parasitology,2010,171(1):53-57.
[15] SHAAPAN R M,ELNAWAWI F A,TAWFIK M A.Sensitivity and specificity of various serological tests for the detection of Toxoplasma gondii infection in naturally infected sheep[J]. Veterinary parasitology,2008,153(3/4):359-362.
[16] FILICE G,MERONI V,CARNEVALE G,et al.Comparison of ELISA and indirect immunofluorescence in the detection of IgG and IgM antitoxoplasma antibodies[J]. Boll ist sieroter Milan,1983,62(5):445-450.
[17] TOMASI J P,SCHLIT A F,STADTSBAEDER S.Rapid double-sandwich enzyme-linked immunosorbent assay for detection of human immunoglobulin M anti-Toxoplasma gondii antibodies[J]. Journal of clinical microbiology,1986,24(5):849-850.
[18] LI S,MAINE G,SUZUKI Y,et al. Serodiagnosis of recently acquired toxoplasma gondii infection with a recombinant antigen[J]. Journal of clinical microbiology,2000,38(1):179-184.
[19] AUBERT D,MAINE G T,VILLENA I,et al.Recombinant antigens to detect toxoplasma gondiispecific immunoglobulin g and immunoglobulin m in human sera by enzyme immunoassay[J]. Journal of clinical microbiology,2000,38(3):1144.
[20] DAUTU G,UENO A,MIRANDA A,et al.Toxoplasma gondii:Detection of MIC10 antigen in sera of experimentally infected mice[J]. Experimental parasitology,2008,118(3):362-371.
[21] SAGER H,GLOOR M,TENTER A,et al.Immunodiagnosis of primary Toxoplasma gondii infection in sheep by the use of a P30 IgG avidity ELISA[J].Parasitology research,2003,91(2):171-174.
[22] FAULK W P,TAYLOR G M. An immunocolloid method for the electron microscope[J]. Immunochemistry,1971,8(11):1081.
[23] 王艳华,李克生,才学鹏,等. 弓形虫抗体免疫胶体金快速检测试纸条的研制[J]. 中国兽医科学,2007,37(1):29-32.
[24] 徐剑蓉,陈静,朱国强,等. γ-干扰素释放试验和皮内变态反应试验结合在牛结核病检测中的临床应用[J]. 黑龙江畜牧兽医,2013(11):118-121.
[25] DENKERS E Y. T lymphocyte-dependent effector mechanisms of immunity to Toxoplasma gondii[J].Microbes&infection,1999,1(9):699-708.
[26] SUZUKI Y,ORELLANA M A,SCHREIBER R D,et al. Interferon:the major mediator of resistance against toxoplasma gondii[J]. Science,1988,240(4851):516.
[27] MAHMOUDI S,MAMISHI S,SUO X,et al.Early detection of Toxoplasma gondii infection by using a interferon gamma release assay:A review[J].Experimental parasitology,2017,172(39):43.
[28] CHAPEY E,MDEBIZE W. Diagnosis of congenital toxoplasmosis by using a whole-blood gamma interferon release assay[J]. Journal of clinical microbiology,2010,48(1):41-45.
[29] FATOOHI A F,COZON G J N,GREENLAND T,et al. Cellular immune responses to recombinant antigens in pregnant women chronically infected with toxoplasma gondii[J]. Clinical & diagnostic laboratory immunology,2002,9(3):704.
[30] CRISTINA M D,PORTO P D,BUFFOLANO W,et al. The Toxoplasma gondii bradyzoite antigens BAG1 and MAG1 induce early humoral and cell-mediated immune responses upon human infection[J]. Microbes&infection,2004,6(2):164.
