柠条锦鸡儿CkF5H基因及启动子的克隆
2018-05-09任方媛王瑞刚
任方媛,李 高,张 涛,杨 杞,王瑞刚
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
木质素是维管植物中广泛存在的芳香族多聚物,主要由羟基肉桂醇衍生而来,广泛分布于维管植物中[1]。维管植物生物量的20%~30%是木质素,是含量仅次于纤维素的第二大类有机物质,也是最大的一类次生代谢物质。植物进化过程中木质素的产生被认为是陆生植物繁盛的关键原因之一[2]。木质素主要存在于植物的次生壁中,它与纤维素、半纤维素共价结合在一起,可以使植物细胞有足够的硬度和强度,能够帮助植物免受侵蚀,从而抵抗外界不良环境所带来的危害[3]。在不同种类植物和不同组织中木质素的分布与它的功能密切相关。木质素通常沉积于次生细胞壁中,而不存在于初生细胞壁中[4]。木本植物维管组织高度木质化,以保证为长距离的水分运输提供机械支持力[5]。过去认为,木质素只存在于维管植物中,而近些年来的研究显示,苔藓和红藻中也存在木质素或木质素的类似物,而绿藻中则没有发现木质素[6]。
木质素主要由松柏醇、芥子醇、香豆醇3种醇类单体聚合而来,其中,S型木质素(紫丁香基木质素)是由紫丁香基丙烷单体聚合形成的,而愈创木基丙烷单体聚合形成的是G型木质素(愈创木基木质素),H型木质素(对-羟基苯基木质素)则是对-羟基苯基丙烷单体聚合形成的[7]。当其合成途径受到阻碍或干扰后,一些新的单体形式也会出现,参与到木质素的聚合过程中来[8-9]。H型和G型木质素在所有的维管植物中都存在,而S型木质素目前发现只在显花植物和卷柏属中存在[10]。
阿魏酸-5-羟基化酶(Ferulate 5-hydroxylase,F5H)是合成S型木质素的关键酶,是木质素合成中的第3个细胞色素P450单氧化酶。F5H最早仅在显花植物中发现,最近的研究表明,卷柏中也存在F5H[11]。如果F5H的活性被抑制,S型木质素含量会大大下降甚至消失。拟南芥F5H基因突变体f5h1-2中S型木质素几乎消失[12]。在植物中过量表达F5H基因,木质素的组成中S型木质素会大量增加[13]。由此可见,在S型木质素合成中F5H基因是最为重要的基因。
柠条锦鸡儿(CaraganakorshinskiiKom.)是锦鸡儿属多年生灌木,根系庞大,在内蒙古地区分布极广,在蒙古和西亚也有分布[14]。柠条锦鸡儿抗旱、抗冷、耐盐碱和贫瘠,是我国西北干旱荒漠地区植树造林的重要树种。其根系发达,分蘖能力较强,柠条林可以起到防风固沙、保持水土的作用,此外,它还是一种具有极大生态价值和经济价值的灌木,作为豆科植物,同其他豆科饲草一样具有很高的营养价值,是我国北方地区重要的饲草[15-16]。极强的抗逆性又使得柠条锦鸡儿具备了其他饲用植物没有的优良特性,可以在干旱荒漠地区进行生态造林的同时利用到饲料和工业生产中去,产生巨大的经济价值[17]。
目前,F5H基因已从水稻(Oryzasativa)、紫苜蓿(Medicagosativa)、拟南芥(Arabidopsisthaliana)、杨树(Populustrichocarpa)、番茄(Lycopersiconesculentum)、油菜(Brassicanapus)等植物中分离克隆出来[18-20]。但是关于柠条锦鸡儿的CkF5H基因克隆目前研究甚少。因此,克隆柠条锦鸡儿的CkF5H基因并详细分析,对于研究柠条锦鸡儿中木质素生物合成途径方面具有深远的意义。
本研究以柠条锦鸡儿为材料,通过对CkF5H基因克隆及启动子克隆,并对核苷酸序列及其推导的氨基酸序列的一系列结构、性质进行分析和预测,旨在为该基因的进一步研究提供理论依据。
1 材料和方法
1.1 植物材料
柠条锦鸡儿种子采自内蒙古四子王旗;克隆载体pMD19-T购自TaKaRa公司;CaMV 35S启动子、大肠杆菌感受态DH5α保存于内蒙古自治区植物逆境生理与分子生物学重点实验室。
1.2 试剂盒及部分药品
5′RACE试剂盒(TaKaRa,D315)、3′RACE试剂盒(TaKaRa,D314)、Genome Walking Kit (TaKaRa,D316)、植物基因组提取试剂盒(天根,DP320)、琼脂糖凝胶回收试剂盒(天根,DP209)。
rTaqDNA聚合酶、高保真酶PrimeSTAR®HS DNA Polymerase、反转录试剂购自宝生物工程大连有限公司,限制性内切酶购自Fermentas公司,DNA Marker购自Invitrogen。
EDTA、Tris等化学药品购自上海生工生物工程公司,氨苄青霉素、卡那霉素、庆大等抗生素以及琼脂糖、酵母提取物、胰蛋白胨等购自Oxoid公司。
1.3 试验方法
1.3.1 柠条锦鸡儿基因组DNA的提取 柠条锦鸡儿基因组DNA的提取按照植物基因组提取试剂盒说明进行。
1.3.2 柠条锦鸡儿总RNA的提取与反转录 将生长30 d的柠条锦鸡儿幼苗样品采用TRIzol法提取总RNA,提取到的RNA浓度用超微量紫外分光光度计Q5000检测,RNA的质量是用浓度为1%的琼脂糖凝胶电泳检测。选用OD260/280值为1.9~2.0,OD260/230值大于2的RNA,用M-MLV反转录酶(TaKaRa)合成cDNA第一链。
1.3.3CkF5H基因中间片段克隆 根据已经公布的植物F5H基因的保守区域,设计简并引物F5H1-1和F5H1-3、F5H2-1和F5H2-2,柠条锦鸡儿的cDNA作为模板进行巢式PCR扩增。以F5H2-1、F5H2-2扩增第1轮;F5H1-1、F5H1-3扩增第2轮。
反应条件为:第1轮 :94 ℃预变性,5 min;94 ℃变性,30 s,48 ℃退火,30 s,72 ℃延伸,2 min,72 ℃补充延伸,10 min,30个循环。
第1轮PCR的产物稀释100倍后作为第2轮PCR的模板,F5H1-1、F5H1-3进行第2轮PCR。反应条件为:94 ℃预变性,5 min;94 ℃变性,30 s,54 ℃退火,30 s,72 ℃延伸,1 min,72 ℃补充延伸,10 min,30个循环。
1.3.4 3′RACE扩增 根据测序得到的CkF5H基因各自的中间片段设计各自所用的3′RACE引物。试验操作流程按照3′RACE试剂盒说明书进行。
1.3.5 5′RACE扩增 根据测序得到的CkF5H基因各自的中间片段设计各自所用的5′RACE引物。引物设计要求参照试剂盒说明书,引物序列见表1。试验操作流程按照5′RACE试剂盒说明书进行。
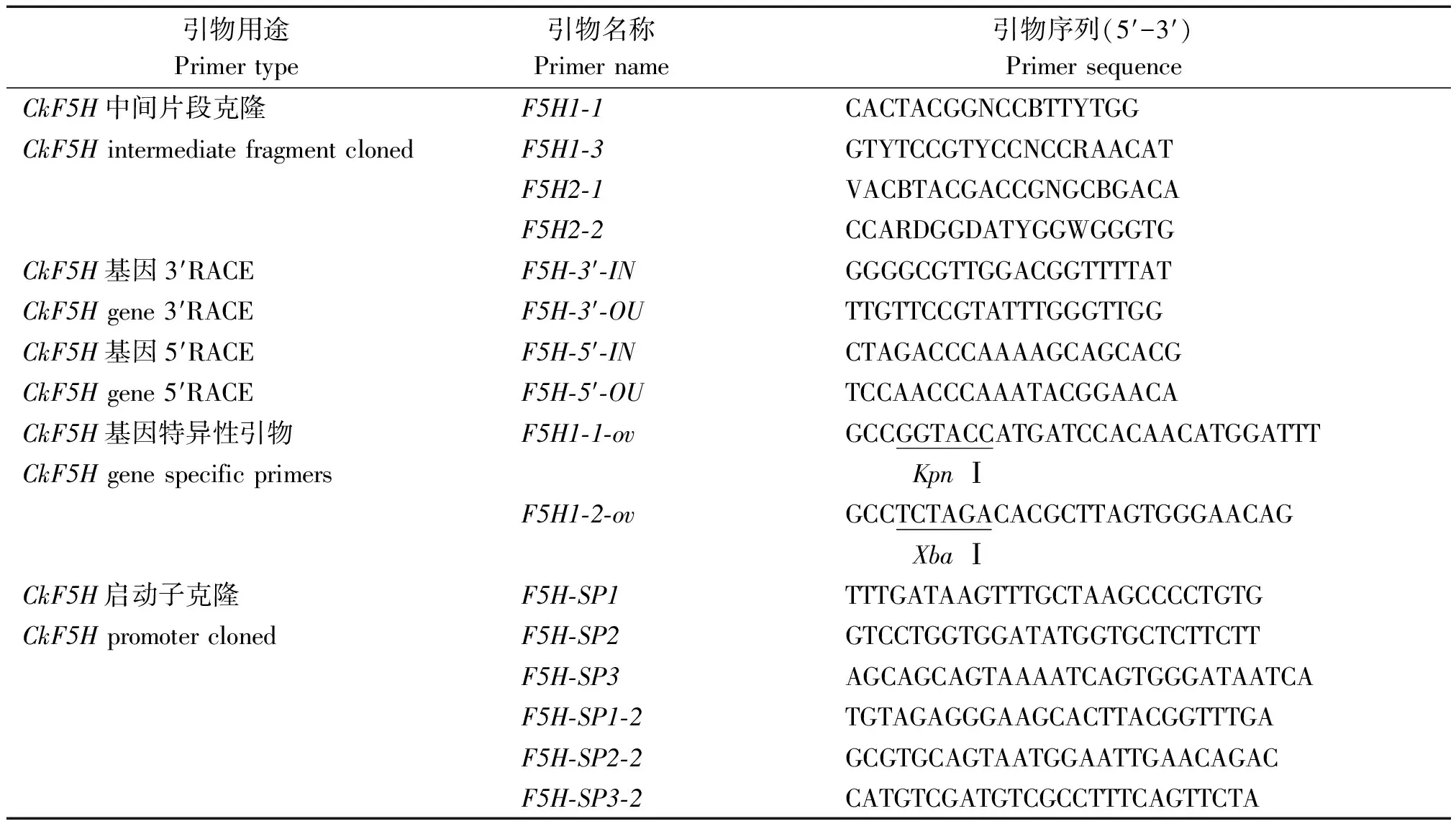
表1 引物序列 Tab.1 Primers sequences
1.3.6CkF5H全长cDNA和gDNA扩增 以柠条锦鸡儿cDNA为模板,以F5H1-1-ov和F5H1-2-ov为特异性引物,利用高保真酶PrimeSTAR(TaKaRa公司) 进行PCR扩增。反应结束后,PCR产物用1%琼脂糖凝胶电泳检测。反应扩增条件:98 ℃预变性,3 min;98 ℃变性,15 s;60 ℃退火,30 s;72 ℃延伸,1 min 40 s;72 ℃补充延伸,10 min,30个循环。CkF5H基因全长gDNA扩增条件同上,但延伸时间为4 min。
1.3.7CkF5H基因启动子的克隆和测序 扩增CkF5H基因启动子序列是利用染色体步移的方法。在CkF5H基因的gDNA序列的5′末端上设计步移引物CkF5H-SP1、F5H-SP2、F5H-SP3,引物序列见表1。用柠条锦鸡儿gDNA作为模板,用试剂盒自带的3种AP引物和特异性引物扩增3轮PCR,具体试验步骤参照试剂盒说明书进行。选择第3轮PCR后获得单一明亮条带的PCR产物进行克隆测序。
为了获得更长的启动子序列,根据第1次步移获得的启动子部分序列,在其5′端再次设计步移引物CkF5H-SP1-2、F5H-SP2-2和F5H-SP3-2,进行第2次的步移。同样选择第3轮PCR后单一明亮条带的产物进行测序分析。
1.3.8CkF5H生物信息学分析 用NCBI的Blast进行CkF5H基因序列比对,分析蛋白保守区域用CDD程序,分析开放阅读框(ORF)用ORF finder工具,DNA序列外显子与内含子具体分布信息是用Spidey (http://www.ncbi.nlm.nih.gov/IEB/Research/Ostell/Spidey/)。
利用ExPasy在线工具ProParam和ProtScale分析蛋白的各种氨基酸含量、理论分子量和等电点等理化参数。用Expasy中的SWISS-MODEL工具(http://swissmodel.expasy.org/) 在线预测CkF5H蛋白三级结构[21-22]。GOR4进行二级结构预测。PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plan-tcare/html/) 进行启动子响应元件的分析。利用Mega 5[23-24]进行系统进化分析,算法采用邻接法,Bootstrap值设置为1 000。
拟南芥基因从拟南芥基因组数据库TAIR(http://www.arabidopsis.org/)中获得,其他植物基因从GenBank数据库中获得。
2 结果与分析
2.1 柠条锦鸡儿CkF5H基因克隆和序列分析
2.1.1CkF5H基因保守片段以及3′-RACE 和5′-RACE扩增 根据简并引物F5H1-1、F5H1-3扩增出1条长度为581 bp的单一条带(图1-A)。以该序列设计RACE引物,分别得到了长为910 bp的3′RACE 产物和627 bp的5′RACE产物(图1-B、C)。将中间片段、3′-RACE 和5′-RACE序列拼接获得1 679 bp的cDNA全长。
2.1.2CkF5H基因cDNA和gDNA全长克隆 以柠条锦鸡儿cDNA为模板,利用特异性引物F5H1-1-ov和F5H1-2-ov进行特异性扩增对RACE结果进行验证,扩增得到CkF5H基因cDNA序列(图1-D)。测序结果经序列比对后表明,RACE拼接得到的是CkF5H基因的ORF。以柠条锦鸡儿gDNA为模板,利用特异性引物F5H1-1-ov和F5H1-2-ov进行PCR扩增获得的基因gDNA序列,gDNA全长3 495 bp(图1-E)。

图1 CkF5H基因克隆电泳结果 Fig.1 Agarose gel electrophoresis of the PCR products of the CkF5H gene cloned
2.2 CkF5H序列分析
通过NCBI的CDD分析显示,属于细胞色素P450家族,CypX超家族成员。这些都说明克隆到的基因是柠条锦鸡儿CkF5H基因,该基因具有2个外显子,1个内含子,编码520个氨基酸,其中,加粗部分为起始密码子ATG和终止密码子TAG,大写字母为编码框,小写字母为非编码区域,保守序列为方框中所示。将该基因提交GenBank数据库,登录号HQ829862(图2)。
2.3 CkF5H基因编码蛋白的生物信息学分析
2.3.1 理化性质预测 对CkF5H基因推导的氨基酸序列预测分析,CkF5H蛋白等电点为6.45,分子量为58.09 ku。不稳定系数45.72,是不稳定蛋白;总平均亲水性-0.143,属亲水性蛋白。
2.3.2 蛋白理化性质及三级结构预测 通过GOR4软件对该蛋白的二级结构分析显示,其二级结构中α-螺旋(竖线最长表示)所占比例为39.81%,β-折叠(竖线次长表示)占总数的15.96%、无规则卷曲(竖线最短表示)所占比例为44.23%(图3)。利用SWISS-MODEL对其三级结构进行预测,结果如图4所示。
2.4 系统进化分析
用Mega 5软件将桉树 (Eucalyptusglobulus)、苜蓿 (Medicagosativa)、油菜 (Brassicanapus)、拟南芥 (Arabidopsisthaliana)、银合欢 (Leucaenaleucocephala)、枸树 (Broussonetiapapyrifera)、杨树 (Populustrichocarpa)、喜树 (Camptothecaacuminata)、大豆 (Glycinemax) 的F5H序列进行系统进化分析,结果见图5,括号中是GenBank登录号。由图5可知,同为豆科的苜蓿、大豆、银合欢与柠条锦鸡儿CkF5H亲缘关系最近,在一个分支上;其他物种F5H处于另一分支。
2.5 CkF5H启动子克隆及序列分析
2.5.1CkF5H基因启动子克隆 根据获得的CkF5H基因gDNA序列,设计步移引物F5H-SP1、F5H-SP2、F5H-SP3,利用宝生物染色体步移试剂盒自带引物AP1、AP2、AP3和AP4分别进行3轮PCR,只有AP3引物扩增时在第3轮获得了单一的明亮产物(图6-A)。经过测序后得到ATG上游约800 bp的启动子序列。在此序列基础上再设计步移引物F5H-SP1-2、F5H-SP2-2和F5H-SP3-2,进行第2次的步移。第2次步移,利用引物AP2经过3轮PCR后得到了约750 bp的单一明亮条带(图6-B)。将条带回收、克隆测序得到751 bp的序列。

图2 CkF5H基因全长及推导的氨基酸序列 Fig.2 Full-length nucleotide and deduced amino acid sequences of CkF5H gene
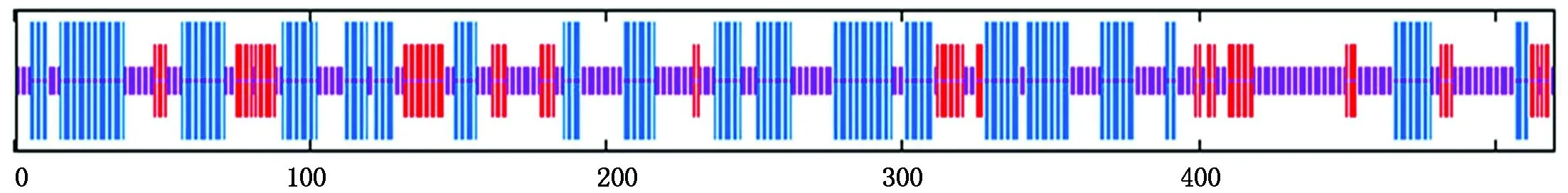
图3 CkF5H二级结构预测Fig.3 The secondary structure prediction of the deduced CkF5H by GOR4
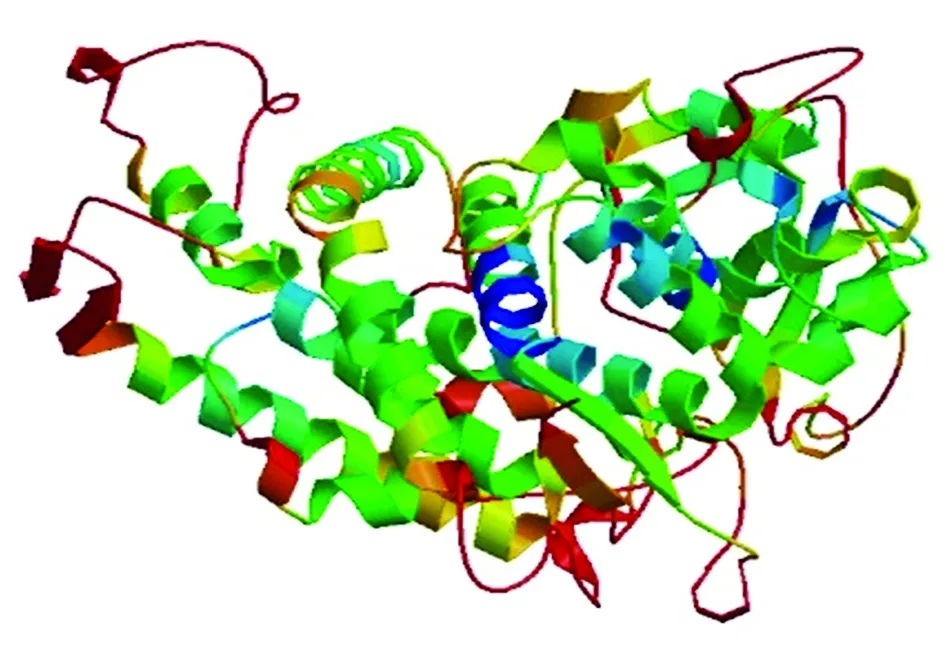
图4 CkF5H三级结构预测Fig.4 Tertiary structure prediction of the CkF5H

图5 CkF5H与其他物种F5Hs的系统进化分析Fig.5 Phylogenetic tree generated by the amino acid sequences of CkF5H and other known F5Hs by Mega 5
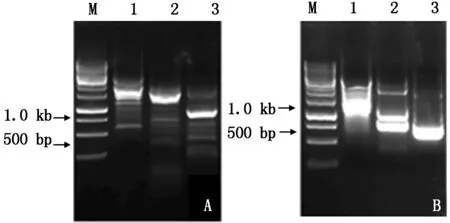
A.第1次步移结果电泳图;B. 第2次步移结果电泳图;M. 1 kb Marker;1.第1轮PCR;2.第2轮PCR;3.第3轮PCR.
A.The first step results electrophoretogram;B.The second step results electrophoretogram;M.1 kb Marker;1.The first PCR;2.The second PCR;3.The third PCR.
图6CkF5H基因启动子克隆
Fig.6GelelectrophoresisofthepromoterofCkF5Hcloned
2.5.2CkF5H基因启动子序列分析 将2次步移获得的序列进行拼接,得到了1 550 bp序列,该序列与CkF5H基因的起始密码子ATG后有41 bp的重叠区域,证明获得了该基因的启动子序列。经过2次步移,得到了长为1 509 bp 的上游启动子ATG序列。由PlantCARE和PLACE在线分析启动子序列,将起始密码子ATG的A定义为+1位。该序列中存在大量的光响应元件,如G-box、C-box、AE-box、SP1-box和TCT-motif等和昼夜节律响应元件circadian、防御与胁迫响应元件TC-rich repeats、赤霉素顺式作用元件TATC-box、热响应元件HSE(图7)。
3 结论与讨论
木质素是维管植物细胞壁的重要组成成分,它可以影响畜牧业、造纸业的生产,其主要沉积在细胞次生壁中,在陆生维管植物的进化演变过程中扮演着重要的角色[25]。在苯丙酸途径中F5H催化不可逆的羟基化步骤,对合成紫丁香基木质素即S-木质素的组成成分具有很大的改造意义[26]。
本研究以柠条锦鸡儿为材料,成功克隆了1个木质素合成相关的CkF5H基因,该基因cDNA全长1 679 bp,gDNA全长3 495 bp,具有2个外显子,1个内含子,编码520个氨基酸,GenBank登录号HQ829862,与其他植物的该基因序列具有同源性。使用NCBI网站上的BlastP工具分析发现,柠条锦鸡儿的CkF5H基因在其进化过程中十分保守,与家族成员的F5H保持了很高的相似度。对CkF5H基因推导的氨基酸序列预测分析,CkF5H蛋白等电点为6.45,分子量为58.09 ku,不稳定系数45.72,是不稳定蛋白,总平均亲水性-0.143,属亲水性蛋白。
通过GOR4软件预测柠条锦鸡儿CkF5H蛋白质二级结构,结果表明CkF5H含有丰富的二级结构,CkF5H中α-螺旋占39.81%,β-折叠占15.96%、无规则卷曲占44.23%,并采用Expasy中的SWISS-MODEL工具在线预测了柠条锦鸡儿CkF5H蛋白质的三维结构。通过染色体步移的技术克隆了1 550 bp的启动子序列,对启动子序列上的响应元件进行了分析,结果显示,具有昼夜节律响应元件、防御与胁迫响应元件、赤霉素顺式作用元件和热响应元件等。已有的研究表明,逆境胁迫会改变木质素的组成,赤霉素可以调节木质素的组成[27],而光合昼夜节律也会影响木质素的含量和组成。

图7 CkF5H基因启动子序列 Fig.7 The promoter sequence of CkF5H
而利用已报道物种中的同源基因进行同源克隆,是一种方便、有效和经济的手段。本研究利用简并引物克隆了1个木质素合成CkF5H基因,通过比对已知物种的同源基因后利用简并引物先得到基因的一段序列,然后通过RACE技术获得基因全长。在用简并引物克隆基因时,除了根据该类基因的保守区域降低简并度外,利用巢式PCR技术进行扩增是极为有效的手段。所以,从柠条锦鸡儿中克隆关于木质素合成酶CkF5H基因,这对从分子机制上进一步研究柠条锦鸡儿木质素生物合成途径有一定的帮助。
此外,通过生物信息学分析显示,CkF5H基因和其他植物的木质素合成酶基因同源,但是由于木质素合成过程相当复杂,很多基因都是以家族形式存在,不同成员具体的生物学功能也有不同,因此,该基因是与柠条锦鸡儿木质素合成有关还是与其他抗逆、抗病机制有关,需要今后利用转基因技术进行详细的研究。
参考文献:
[1] Boerjan W,Ralph J,Baucher M. Lignin biosynthesis [J].Annu Rev Plant Biol,2003,54:519-546.
[2] Weng J K,Chapple C. The origin and evolution of lignin biosynthesis[J]. The New Phytologist,2010,187(2):273-285.
[3] Vanholme R,Morreel K,Ralph J,et al. Lignin engineering[J]. Current Opinion in Plant Biology,2008,11(3):278-285.
[4] Tran-Nguyen Nguyen, SeungHyun Son, Mark C, et al. Lignin biosynthesis in wheat (TriticumaestivumL.): its response to waterlogging and association with hormonal levels[J].BMC Plant Biology, 2016, 16 (1):28.
[5] 王轶男,陈 雪,盖 颖,等.毛白杨木质素合成酶基因F5H克隆与生物信息学分析[J].广东农业科学,2014,20(2):131-140.
[6] Anderson Nickolas A, Tobimatsu Yuki, Ciesielski Peter N, et al. Manipulation of guaiacyl and syringyl monomer biosynthesis in anArabidopsiscinnamyl alcohol dehydrogenase mutant results in atypical lignin biosynthesis and modified cell wall structure[J]. The Plant Cell, 2015, 8(11): 2195-2209.
[7] Robert W Sykes, Erica L Gjersing, Kirk Foutz, et al. Down-regulation of p-coumaroyl quinate/shikimate 3′-hydroxylase (C3′H) and cinnamate 4-hydroxylase (C4H) genes in the lignin biosynthetic pathway ofEucalyptusurophylla×E.grandisleads to improved sugar release[J].Biotechnology for Biofuels, 2015, 8 (1):128.
[9] Rencoret Jorge,Kim Hoon, Evaristo Anderson B,et al. Variability in lignin composition and structure in cell walls of different parts of Macaúba (Acrocomiaaculeata) Palm Fruit[J]. Journal of Agricultural and Food Chemistry, 2018, 66(1): 138-153.
[10] Weng J K,Akiyama T,Bonawitz N D,et al. Convergent evolution of syringyl lignin biosynthesis via distinct pathways in the lycophyteSelaginellaand flowering plants[J]. The Plant Cell,2010,22(4):1033-1045.
[11] Liu J, Kim J I , Cusumano J C,et al. The impact of alterations in lignin deposition on cellulose organization of the plant cell wall[J]. Plant Journal, 2016, 9(1): 126.
[13] 曹 山. 毛果杨木质素形成相关基因克隆及功能研究[M].北京:北京林业大学, 2016.
[14] 高玉寒,姚云峰,郭月峰,等. 柠条锦鸡儿细根表面积密度对土壤水分空间分布的响应[J]. 中国农业科学, 2017,33(5): 136-142.
[15] 王 赞,李 源,陆景伟,等. 中国柠条锦鸡儿资源表型多样性研究[J]. 华北农学报,2008,23(S):59-61.
[16] 高 宇,张晓霞,李 彬,等. 国内外旱作农业研究进展[J]. 北方农业学报,2016,44(1):102-108.
[17] Arnold K,Bordoli L,Kopp J,et al. The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J]. Bioinformatics,2006,22(2):195-201.
[18] 郑 晟,毛玉珊,张腾国,等.柠条锦鸡儿F3H基因克隆及功能分析[J]. 广西植物,2017, 37(6): 723-733.
[19] Reddy M S,Chen F,Shadle G,et al. Targeted down-regulation of cytochrome P450 enzymes for forage quality improvement in alfalfa (MedicagosativaL.)[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(46):16573-16578.
[20] Kim J H,Yang D H,Kim J S,et al. Cloning,characterization,and expression of two c DNA clones for arice ferulate-5-hydroxylase gene a cytochrome P450-receptors[J]. Genest Cells,2000,5(1):57-69.
[21] Bewg W P, Poovaiah C, Wu L,et al. RNAi downregulation of three key lignin genes in sugarcane improves glucose release without reduction in sugar production[J]. Biotechnology for Biofuels, 2016, 9(1): 270.
[22] Tamura K,Peterson D,Peterson N,et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[23] Moura J C,Bonine C A,De Oliveira Fernandes Viana J,et al. Abiotic and biotic stresses and changes in the lignin content and composition in plants[J]. Journal of Integrative Plant Biology,2010,52(4):360-376.
[25] Farhana Shafrin, Sudhanshu Sekhar Das, Neeti Sanan-Mishra, et al. Artificial miRNA-mediated down-regulation of two monolignoid biosynthetic genes (C3HandF5H) cause reduction in lignin content in jute[J]. Plant Molecular Biology, 2015, 89(4-5): 511-527.
[26] José Renán García, Nickolas Anderson, Regis Le-Feuvre, et al. Rescue of syringyl lignin and sinapate ester biosynthesis inArabidopsisthalianaby a coniferaldehyde 5-hydroxylase fromEucalyptusglobulus[J]. Plant Cell, 2014, 33(8): 1263-1274.
[27] 郭晓艺,胡尚连,曹 颖,等. 调控S木质素合成基因F5H1研究进展及对竹遗传改良的展望[J]. 福建林业科技,2007,34(3):234-237,243.
