结肠后入路腹腔镜胰十二指肠切除术的初步探讨
2018-05-08徐建威张国友
徐建威,张国友,李 峰,刘 晗,王 磊
(1.山东大学齐鲁医院,山东 济南,250012;2.潍坊医学院附属医院)
胰头前方的层次由结肠系膜、胃窦部系膜与胰腺被膜融合而成,是腹腔最为复杂的解剖层次之一。传统开放手术多选择胃结肠韧带入路,利用各系膜或被膜间的解剖间隙,按层次显露胰头部[1]。腹腔镜胰头手术也延续了这一传统入路[2]。由于腹腔镜技术缺乏立体感、组织牵拉不足,显露这些解剖间隙相对困难,尤其胰头部肿瘤,局部无菌性炎症往往导致组织层次及间隙辨认不清,从而误伤结肠血管,导致血运受损;或肿瘤侵犯,无法解剖分离而过早的中转开腹或放弃根治性手术。我们在临床实践中发现,结肠系膜上存在一个明显的半透明解剖学标志,透过此处,可观察到十二指肠降部到水平部的转折部分,我们将此半透明区定义为“十二指肠窗”。将此处打开并稍做游离,即可暴露十二指肠、胰头部。由于此间隙位于结肠系膜后方,腹腔镜手术较开放手术操作更加方便,而且学习曲线较短,可能成为腹腔镜胰头部手术的常规入路。本研究回顾分析了15例经结肠后入路的腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD),并对此入路的解剖特点及应用效果进行报道。
1 资料与方法
1.1 临床资料 15例行LPD的患者中男11例,女4例;36~71岁,平均(57.7±9.3)岁;BMI 20.8~29.4 kg/m2,平均(24±2.2) kg/m2。病理诊断:胰腺导管腺癌8例(ⅠB期3例,ⅡB期4例,Ⅳ期1例),胰头神经内分泌肿瘤1例(G2),十二指肠癌4例,十二指肠降段间质瘤1例(低风险),十二指肠乳头神经内分泌肿瘤伴印戒细胞癌成分1例。
1.2 手术方法 (1)定位横结肠系膜后间隙入口:腹腔镜监视下,提起横结肠,于略微隆起的肠系膜根部右侧,可观察到结肠系膜的一个半透明区域(图1)。打开此区域,可直接显露十二指肠下角。该区域下方即为回结肠血管蒂,注意保护。(2)切开系膜,进入横结肠系膜后间隙,游离十二指肠降部、水平部,于横结肠系膜后方、十二指肠外侧行Kocher切口,充分游离十二指肠、胰头,直至腹主动脉前方。打开后腹膜,显露下腔静脉、左肾静脉后,以左肾静脉为标志,直接显露肠系膜上动脉(superior mesenteric artery,SMA)根部,初步完成“动脉先行”的操作,并顺势完成16组淋巴结清扫。对于胰头部肿瘤,由于肿瘤侵犯或炎症粘连,胰腺颈部显露肠系膜上静脉有一定困难;可进一步在此入路下,在不解剖胰腺颈部的前提下,通过游离十二指肠,于侧方显露肠系膜上静脉。(3)在胰头与十二指肠前方扩展横结肠系膜后间隙,暴露胰头及十二指肠。助手挑起横结肠系膜,以胰十二指肠前筋膜为基础平面,游离此间隙,充分暴露胰头及十二指肠;上方打开肝结肠韧带,显露十二指肠球降部的前方;下方打开屈氏韧带的右侧,游离至十二指肠升部,十二指肠全程得到游离,在腹腔内清晰可见,我们称之为“十二指肠腹腔化”。至此,结肠后的操作已基本完成。(4)打开胃结肠韧带。于胃结肠韧带薄弱区切开,分离覆盖在胰头与十二指肠前方的结肠系膜、胃窦部系膜,即可与后入路已完成的解剖结构“会师”,这样可于结肠上区显露整个胰头、十二指肠并自由翻起,完成胰头及十二指肠的显露、游离工作。通过这一系列操作,由横结肠系膜覆盖的、主要位于腹膜后的十二指肠及胰头显露在腹腔中建立了一个简明、清晰、完整的层次,为进一步的手术操作打下基础。
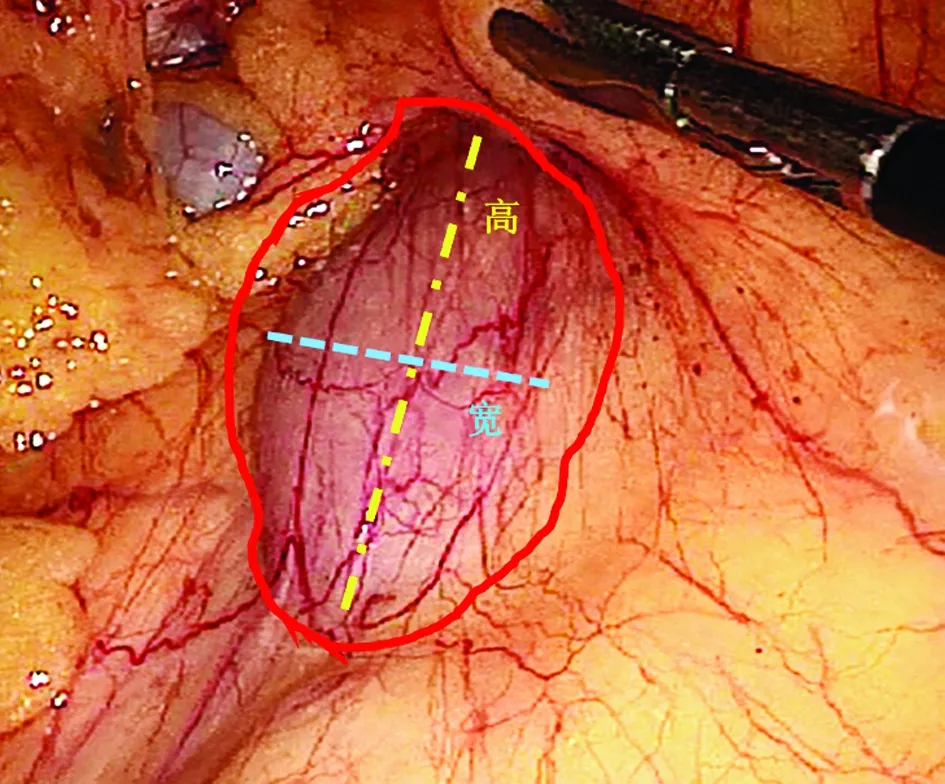
图1 十二指肠窗的解剖定位
2 结 果
4例中转开腹,均因肿瘤侵犯门静脉或肠系膜上静脉;2例患者在腹腔镜下切除,开腹行消化道重建。除1例十二指肠间质瘤患者外,余14例均于结肠后完成SMA先行(显露出SMA根部);2例钩突先行。
十二指肠窗宽2.0~4.5 cm,平均(2.8±0.7) cm;窗高3~6 cm,平均(4.3±1.0) cm,窗面积平均(12.6±6.1) cm2,通过相关性分析,窗宽(P=0.502)、窗高(P=0.957)、窗面积(P=0.644)与BMI无统计学相关性。十二指肠腹腔化(结肠后游离翻起十二指肠2/3段及胰头,包括完成SMA先行)的时间18~70 min,平均(28.7±13.2) min;完成胰头及十二指肠显露、游离的时间30~90 min,平均(49.3±14.5) min。标本切除时间115~250 min,平均(154.0±38.5) min。
3 讨 论
胰腺是被小网膜囊包裹的脏器,打开小网膜囊方能显露胰腺。小网膜囊前壁由上向下依次为小网膜、胃后壁、胃结肠韧带;后壁是覆盖于胰、左肾与左肾上腺前方的腹后壁腹膜,下方边界为横结肠及其系膜。我们可从四个方向打开小网膜囊,显露胰腺,因此常见的手术入路为胃结肠韧带入路(前)、腹膜后入路(后)、小网膜入路(上)、结肠系膜入路(下)。胃结肠韧带入路层次清晰,能大范围的显露胰腺,一直是胰腺手术的主要入路[2]。经腹膜后入路、结肠系膜入路主要用于坏死性胰腺炎的清创;小网膜入路则多用于腹腔干周围组织的显露,一般作为胃结肠韧带入路的辅助。
胰头前方的层次是上腹部最复杂的层次之一,横结肠系膜、胃窦部系膜于胰头前方形成融合筋膜,构成复杂的解剖关系[5-6],导致胰头显露、解剖有一定困难。胃结肠韧带入路需充分游离胃窦部并松弛横结肠,形成良好的张力,才能发现这一层次,顺利显露胰头部、十二指肠。而腹腔镜下,寻找这一层次存在更大的困难,尤其肥胖患者、横结肠较冗长时更加繁琐;而患者较消瘦时,系膜脂肪成分较少,间隙往往不明显,腔镜下由于缺乏立体感,则容易造成结肠系膜血管的损伤,影响横结肠血运。因此不能简单的将开腹手术入路复制到腹腔镜手术中,而应结合腹腔镜技术的特点,探索更为简单、高效的手术入路。与开放手术相比,腹腔镜手术有其独特的操作特点。一般而言,由于视野、操作角度更加灵活,腹腔镜手术擅长完成开放手术难以完成的侧后方、深部的精细操作,表现为“角度(侧后方的操作)、深度(深部组织,尤其位于骨性结构后方的组织,如肋弓、骨盆)、力度(器械的被动精细操作)”的优势[7]。如何充分发挥腹腔镜技术的优势是微创时代需要重点关注的问题之一。具体而言,对于胰头、十二指肠的病变,采用侧后方入路能更直接的显露胰头、钩突部[7],简化手术流程,提高手术效率,充分体现出腹腔镜技术的独特优势。
十二指肠通过胚胎期的脏器旋转,固定于后腹壁,前方被横结肠系膜覆盖[8]。横结肠系膜为双层结构,两层间存在脂肪、血管[6,8];但在十二指肠降部到水平部转折处的横结肠系膜上,正对十二指肠下角的位置存在一个无血管、无脂肪组织的透明区,我们称之为“十二指肠窗”,这可作为显露十二指肠、胰头与钩突的天然标志,切开后即进入横结肠系膜后间隙。下方为回结肠血管,也可作为右半结肠手术显露回结肠血管的解剖标志。据笔者观察,患者均存在这一半透明区域,且与患者的BMI无统计学相关性。镜下我们先将横结肠系膜张紧,显露这一解剖标志;打开“十二指肠窗”后,即可进入横结肠系膜后间隙。
横结肠系膜后间隙是存在于横结肠系膜后方的解剖间隙,与右结肠后间隙、胃结肠系膜间隙相联通。以胰头、十二指肠为界,可分为存在前方的横结肠系膜后间隙、胰前间隙及后方的胰十二指肠后间隙[5]。传统解剖入路需打开胃结肠韧带,由左向右分离进入胃结肠系膜间隙后再进一步游离横结肠系膜,进入横结肠系膜后间隙,以便游离十二指肠、胰头。由于横结肠系膜上“十二指肠窗”这一天然解剖标志的存在,加之腔镜技术善于后方操作的特点,我们可直接进入横结肠系膜后间隙,省略胃结肠系膜间隙的游离,直接进入正确的解剖层次,提高游离胰头、十二指肠的效率。
为创造解剖空间,我们一般先行游离胰头十二指肠外侧,直接在横结肠系膜后这一间隙内行Kocher切口,进入胰头十二指肠后间隙,充分分离十二指肠、胰头后方,直至腹主动脉前方。如为恶性病变,我们可在胰头十二指肠后方间隙内暴露下腔静脉、左肾静脉,完成对16组淋巴结的清扫[9],同时解剖SMA根部,明确肿瘤与SMA的关系,为SMA的进一步解剖做准备。助手挑起横结肠系膜,以胰十二指肠前筋膜为平面,游离横结肠系膜后间隙,暴露胰头部。进一步的游离,如果切断副右结肠静脉及汇入Helen干的右结肠静脉[10],内侧可到达肠系膜上静脉、胰腺颈部,进入小网膜囊的游离空间;下方可顺十二指肠水平部,切断部分屈氏韧带后一直游离至近端空肠,至肠系膜下静脉终止;上方在后方切断肝结肠韧带后直接进入游离腹腔。此时转向前方视野,可发现球部、降部完全显露,与后腹壁脱离,获得一定的游离度;在腹腔内清晰可见,我们称之为“十二指肠腹腔化”,为进一步的手术操作创造了简明、清晰、完整的层次。十二指肠腹腔化的时间为18~70 min,平均(28.7±13.2) min。这一操作时间基本不受患者局部解剖因素的影响,如患者体重指数、系膜厚度、横结肠的迂曲程度等;但与肠系膜的侵犯程度有一定关系,当肿瘤侵犯肠系膜上静脉时,会延长操作时间。但由于解剖层次位于侧后方,肠系膜上静脉的解剖放在最后,可望完成常规入路难以完成的LPD。
该入路为腹腔镜技术独有的手术入路,对于良性肿瘤,可直接显露胰头、钩突及十二指肠降部,避免了胃结肠韧带的打开、胃结肠系膜间隙的游离,可明显提高手术效率。完成局部切除后,由于游离范围集中,利于术后引流管的放置,引流更加通畅。为LPD提供了一个更轻松、简明的解剖路径,与患者肥胖程度、横结肠冗长程度、肿瘤侵犯程度无明显关联,为腹腔镜下的操作提供了更多便利,为钩突切除、消化道重建创造了合适的操作平面与空间,真正体现出腹腔镜技术在胰十二指肠切除中的优势。
参考文献:
[1] Wolf AM,Lavu H.Pancreaticoduodenectomy and its variants[J].Cancer J,2012,18(6):555-561.
[2] 中华医学会外科学分会胰腺外科学组,中国医疗保健国际交流促进会胰腺病分会胰腺微创治疗学组,中国研究型医院学会胰腺疾病专业委员会胰腺微创学组,等.腹腔镜胰十二指肠切除手术专家共识(附:手术流程与主要步骤)[S].中华外科杂志,2017,55(5):335-339.
[3] Tu Y,Jiao H,Tan X,et al.Laparotomy versus retroperitoneal laparoscopy in debridement and drainage of retroperitoneal infected necrosis in severe acute pancreatitis[J].Surg Endosc,2013,27(11):4217-4223.
[4] Coffin A,Boulay-Coletta I,Sebbag-Sfez D,et al.Radioanatomy of the retroperitoneal space[J].Diagn Interv Imaging,2015,96(2):171-186.
[5] 李国新,赵丽瑛.腹腔镜结直肠癌根治术解剖概要[J].中国实用外科杂志,2011,31(9):844-848.
[6] Soffers JH,Hikspoors JP,Mekonen HK,et al.The growth pattern of the human intestine and its mesentery[J].BMC Dev Biol,2015,15:31.
[7] 王磊,徐建威,李峰,等.腹腔镜胰腺外科:精打细算的腹腔镜外科[J/CD].中华腔镜外科杂志(电子版),2017,10(6):347-350.
[8] Zhou X,Ding Z.Gross anatomy of pancreatic surgery related fascia and fascial spaces[J].Hepatogastroenterology,2014,61(136):2402-2406.
[9] Sergeant G,Melloul E,Lesurtel M,et al.Extended lymphadenectomy in patients with pancreatic cancer is debatable[J].World J Surg,2013,37(8):1782-1788.
[10] Negoi I,Beuran M,Hostiuc S,et al.Surgical Anatomy of the Superior Mesenteric Vessels Related to Colon and Pancreatic Surgery:A Systematic Review and Meta-Analysis[J].Sci Rep,2018,8(1):4184.
