反复喘息婴幼儿外周血Tc9细胞检测及其临床意义
2018-05-08于建秀徐东晖刘光亮
于建秀, 钱 雷, 徐东晖, 刘光亮
(1.滨海县人民医院检验科,江苏 盐城 224500;2. 滨海县人民医院儿科,江苏 盐城 224500)
反复喘息是婴幼儿最常见的呼吸道疾病,发病率呈逐年上升趋势,超过1/3 的婴幼儿在3岁前发作过喘息[1]。反复喘息以气道狭窄和高反应性为特征,可导致呼吸困难[2],严重影响婴幼儿的生活质量,且比其他年龄哮喘患者有更高的死亡率[3],生命早期的喘息还会增加生命后期哮喘的发病率[4-5]。但婴幼儿反复喘息的发病机制尚不明确。近年来有研究表明,Tc9细胞可通过分泌白细胞介素(interleukin,IL)-9发挥免疫调节功能,在启动过敏反应和促进哮喘患者气道炎症反应中发挥重要作用[6],但其在反复喘息发病机制中的作用尚不清楚。本研究通过检测反复喘息婴幼儿外周血Tc9细胞比例,并分析其与血清细胞因子的相关性,阐明其在反复喘息疾病过程中的作用。
1 材料和方法
1.1 研究对象
选取2015年11月—2016年5月在滨海县人民医院住院的反复喘息婴幼儿(喘息组)34例,同时选取年龄、性别与之相匹配的健康婴幼儿34名作为对照组。喘息组纳入标准:喘息发作3次以上的住院婴幼儿,年龄6个月~3岁,呼吸道症状首先是喘息和咳嗽,其次是呼吸急促、有啰音和呼吸困难,喘息治疗停止超过1个月。喘息组排除标准:患婴幼儿肺炎、使用免疫抑制药物和患免疫系统疾病的患儿。对照组过敏原检测均为阴性,无哮喘或鼻炎症状。本研究经滨海县人民医院伦理委员会(EC/2015/06)批准,获得所有研究对象父母或监护人的知情同意。研究对象的临床资料见表1。

表1 研究对象的临床特征
1.2 仪器及试剂
异硫氰酸荧光素(f l uorescein isothiocyanate,FITC)鼠抗人-CD3单克隆抗体、藻红蛋白(phycoerythrin,PE)鼠抗人- CD8单克隆抗体、叶绿素蛋白偶联物(peridinin chlorophyll protein cyanin 5.5,PerCP-cy5.5)鼠抗人-IL-9单克隆抗体及同型对照、红细胞裂解液、Fix/Perm 破膜固定剂均购自美国BD公司。血清转化生长因子(transforming growth factor,TGF)-β、IL-9、IL-17A、IL-33及IL-4试剂购自美国Bio-rad公司。血清总IgE采用cobas 8000化学发光仪及配套试剂(瑞士罗氏公司)检测,淋巴细胞及嗜酸性粒细胞计数采用XS-1000i血液分析仪及配套试剂(日本Sysmex公司)检测。FACS Calibur流式细胞仪购自美国BD公司。过敏原采用Allergy Screen过敏原诊断试剂盒(德国MEDIWISS Analytic GmbH公司)检测。佛波醇12-肉豆酸酯13-酯活性(phorbol 12-myristate-13-acetate,PMA)、离子霉素及布雷菲德菌素购自美国Sigma公司。Ficoll-Hypaque密度梯度试剂购自上海恒信公司。
1.3 方法
1.3.1 外周血Tc9细胞比例的检测 取肝素抗凝静脉血100 μL,加入50 ng/mL PMA、1 μg/mL离子霉素及1 μg/mL布雷菲德菌素,于37 ℃ 5%CO2培养5 h。采用红细胞裂解液破坏红细胞,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤后分别加入10 μL FITC鼠抗人-CD3单克隆抗体及10 μL PE鼠抗人-CD8单克隆抗体,室温避光孵育30 min。用PBS洗涤后,加入250 μL Fix/Perm buffer 避光孵育40 min,加入300 μL Perm/wash buffer洗涤,离心弃上清。100 μL Perm/wash buffer 重悬细胞,加10 μL PerCP-cy5.5鼠抗人-IL-9单克隆抗体及同型对照,室温避光孵育30 min,用PBS洗涤。用400 μL PBS重悬细胞,立即上机检测。通过前向散射光和侧向散射光分选淋巴细胞,以淋巴细胞设门,分选出CD3+CD8+细胞群(图1),进而检测CD8+IL-9+细胞(Tc9细胞,图2),通过IL-9同型对照调节电压及补偿,测定外周血Tc9细胞占CD3+CD8+T细胞百分率(Tc9细胞比例)。

图1 CD8+T淋巴细胞(R2)流式散点图

图2 Tc9细胞流式散点图
1.3.2 RNA提取和逆转录聚合酶链反应(polymerase chain reaction,PCR)分析 通过Ficoll-Hypaque法制备外周血单个核细胞(peripheral blood mononuclear cell,PBMC),利用Trizol试剂提取总RNA。采用cDNA逆转录试剂盒(美国Applied Biosystems公司)进行cDNA合成,利用QuantiTect SYBR Green PCR试剂盒(美国Invitrogen公司)进行扩增。引物序列为:IL-9 sense,5'-GTGCCACTGCAGTGCTAATGT-3',antisense,5'-CTCTCACTAAGCATGGTCTGG-3'。IRF4 sense:5'-GAAGCCTTGGCGTTCTCAGAC-3';anti-sense:5'-CGTATGTCCATGGGAGATCCG-3'。β-actin sense:5'-TGGCACCCAGCACAATGAA-3';anti-sense:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。在ABI 7500 PCR扩增仪(美国Applied Biosystems公司)上进行逆转录PCR。采用2-△△Ct方法计算IL-9 mRNA和干扰素调节因子4(interferon regulatory factor 4,IRF4)mRNA水平。
1.3.3 血清细胞因子检测 采集所有研究对象外周血2 mL,500×g离心5 min,分离血浆,立即置于-80 ℃冰箱。采用LUMINEX 200液相芯片分析系统(美国Luminex公司)检测IL-9、IL-17A、IL-33、IL-4和TGF-β水平,每份样本检测2次,取均值。
1.4 统计学方法
运用Stata 7.0软件进行统计分析。偏态计量资料用中位数(四分位数)[M(P25,P75)]表示,2组间比较采用Mann-Whitney U检验;正态分布计量数据用x±s表示,2组间比较采用Students' t检验。采用Spearman相关分析计算线性相关系数。以P<0.05为异有统计学意义。
2 结果
2.1 外周血Tc9细胞比例和IL-9 mRNA、IRF4 mRNA的检测
与对照组比较,喘息组外周血Tc9细胞比例和PBMCIL-9 mRNA、IRF4 mRNA水平明显升高(P<0.05)。见表2。

表2 喘息组和对照组外周血Tc9细胞比例及PBMC IL-9 mRNA、IRF4 mRNA水平的比较 [M(P25,P75)]
2.2 喘息组外周血Tc9细胞比例与PBMC IL-9 mRNA、IRF4 mRNA的相关性
喘息组外周血Tc9细胞比例与PBMCIL-9 mRNA、IRF4 mRNA水平呈正相关(r值分别为0.501、0.504,P=0.002)。见图3。
2.3 喘息组与对照组与外周血Tc9细胞相关的细胞因子水平的比较
与对照组比较,喘息组外周血IL-9、TGF-β1、IL-4和IL-33水平明显升高(P<0.05),但2个组间IL-17A水平差异无统计学意义(P>0.05)。见表3。

图3 喘息组外周血Tc9细胞比例与IL-9 mRNA、IRF4 mRNA的相关性

表3 喘息组与对照组血清细胞因子水平的比较 [M(P25,P75)]
2.4 喘息组外周血Tc9细胞比例和血清细胞因子、总IgE的相关性
喘息组外周血Tc 9细胞比例与总I g E和IL-9呈正相关(r=0.354,P=0.039;r=0.459,P=0.006),与IL-33、IL-4和TGF-β1无相关性(r=0.241,P=0.169;r=0.252,P=0.153;r=0.236,P=0.178)。见图4。
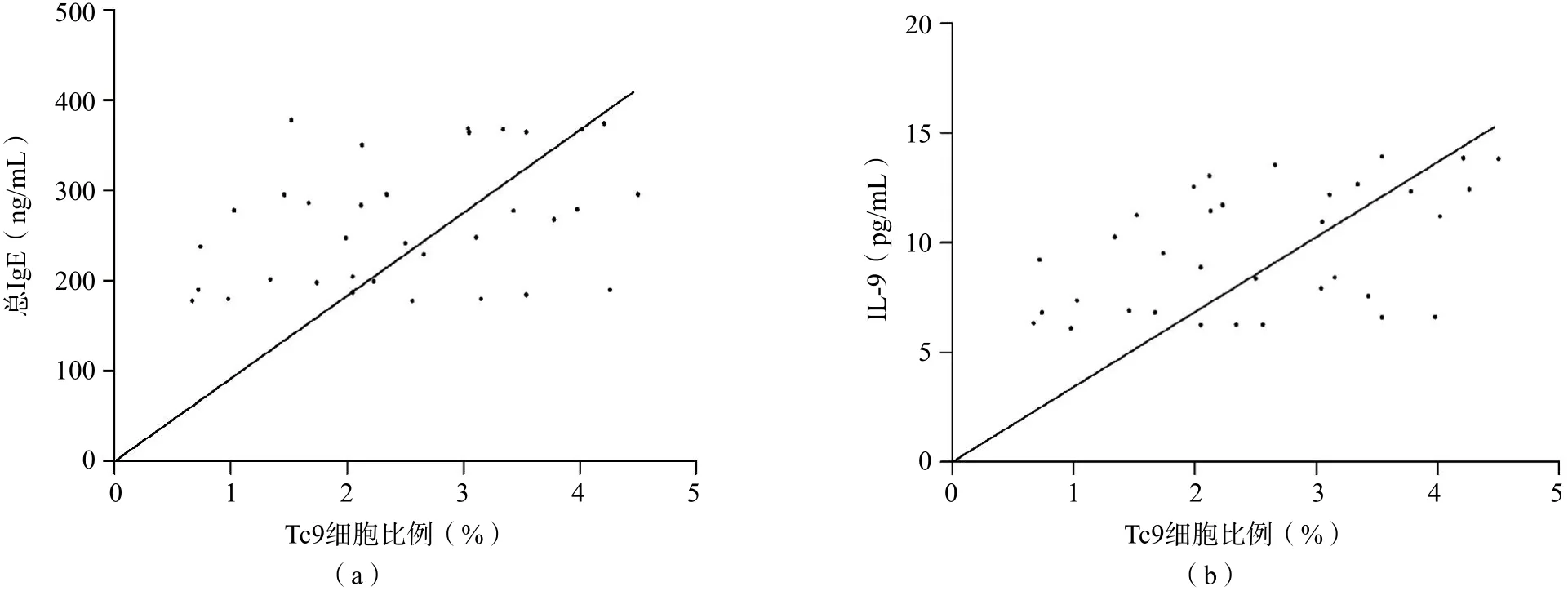
图4 喘息组外周血Tc9细胞比例与总IgE、IL-9的相关性
2.5 过敏原阳性喘息组外周血Tc9细胞比例
在喘息组中,过敏原阳性患儿Tc9细胞比例[3.11(1.96,4.57)%,11例]明显高于过敏原阴性患儿[1.67(0.67,3.26)%,23例](P<0.05)。
3 讨论
通过哮喘鼠模型研究发现,Tc9细胞对Th2介导的呼吸道炎症反应具有促进作用,同时对与哮喘有相似发病机制的特应性皮炎患儿进行研究,特应性皮炎患儿外周血Tc9细胞增多,并与疾病的严重程度相关,其机制是Tc9细胞通过分泌IL-9而发挥作用[6]。Tc9细胞可由IL-4联合TGF-β诱导CD8+初始T细胞产生,信号传导转录激活因子6和IRF4是调控Tc9细胞发育的重要转录因子。本研究发现,喘息组患儿外周血Tc9细胞比例显著升高,且与PBMCIRF4 mRNA和IL-9 mRNA具有相关性。
IL-9是一种多效性细胞因子,既是T细胞生长因子,又可直接作用于B细胞,促进IL-4介导的B细胞分化及IgE的表达,在免疫球蛋白合成的调控中发挥重要的作用[7]。IL-9可促使肥大细胞增殖,增加肥大细胞表面 Fc受体I a的表达和炎症介质的产生,促使肥大细胞对变应原作出反应。在过敏性哮喘中,IL-9可通过抑制嗜酸性粒细胞的凋亡和促进IL-5介导的嗜酸性粒细胞前体的成熟来增加组织中嗜酸性粒细胞的数量,诱导中性粒细胞产生和释放IL-8,从而招募更多的中性粒细胞,参与中性粒细胞引起的炎症反应[8]。IL-9可刺激上皮细胞,导致嗜酸性粒细胞和T细胞的浸润,诱导上皮细胞产生黏蛋白,从而在炎症的发生、发展中起重要作用[9]。IL-9的来源除了Tc9细胞外,Th9细胞、先天性淋巴细胞、嗜酸性粒细胞、肥大细胞等多种细胞均可产生IL-9[10]。本研究表明外周血Tc9细胞比例与IL-9水平具有相关性,表明Tc9细胞是IL-9的重要来源之一。
与CD4+T细胞的分类相似,CD8+T细胞分为Tc1、Tc2、Tc17、Tc9、CD8+Treg等细胞亚群,并参与哮喘的发生、发展[11]。CD8+初始T细胞向不同亚群分化的方向决定于抗原的性质和强度、协同刺激分子和细胞因子。TGF-β诱导CD8+初始T细胞向CD8+Treg细胞分化,在IL-4作用下向Tc2细胞分化,但在TGF-β和IL-6存在的条件下分化为Tc17细胞。Tc9细胞的发育、分化由细胞因子TGF-β和IL-4诱导。此外,通过核因子-κB(nuclear factor kappa B,NF-κB)的活化,IL-1β和IL-33的刺激也可诱导Tc9细胞分化[12]。
本研究表明,喘息组血清TGF-β1水平显著高于对照组(P<0.05)。有较多的研究表明,TGF-β1与哮喘的发生存在密切的联系[13-14]。首先,TGF-β1基因多态性与哮喘的发病率增加有关。CHIANG等[15]发现血清TGF-β1的升高、哮喘的易发性及病情严重程度与TGF-β1基因启动子C-509T异常有密切的关系。另外,哮喘患儿外周血和支气管肺泡灌洗液TGF-β水平显著升高,且与支气管中性粒细胞、嗜酸性粒细胞增加有关,提示TGF-β参与了哮喘的发生和病情加重过程[16]。本研究还证实,喘息组血清IL-4水平明显升高。因此,血清中TGF-β和IL-4升高可能是反复喘息婴幼儿外周血Tc9细胞比例升高的重要因素。
上皮细胞因子IL-33是新发现的IL-1家族成员,是一种多功能蛋白,其受体为细胞表面肿瘤发生抑制蛋白2,表达于Th2细胞和肥大细胞等细胞膜表面。IL-33结合受体ST2后能促进T细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和先天性淋巴细胞反应,诱导效应因子IL-5、IL-13生成,促进B细胞活化,诱导IgE合成,增多的IgE可介导肥大细胞脱颗粒,诱导哮喘的发生。另外,IL-33也参与了Th9细胞的分化和加剧儿童哮喘的病程[17]。本研究也证实喘息组血清IL-33水平升高。与本研究结果一致的是,IL-33也是一种糖皮质激素抵抗介质,可加重儿童哮喘的症状[18]。
本研究还发现,喘息组外周血Tc9细胞比例与IgE水平呈正相关,且在喘息组中血清过敏原阳性患儿外周血Tc9细胞比例高于过敏原阴性患儿(P<0.05)。气道微生物、环境因素和先天免疫应答三者之间的相互作用是喘息的重要发病机制[19]。有流行病学研究结果表明,反复喘息的病因包括过敏、呼吸道感染和早期喘息[20]。另外,WANG等[21]研究发现哮喘患者Tc9细胞比例升高,在接受糖皮质激素治疗后Tc9细胞比例降低。
综上所述,反复喘息婴幼儿外周血Tc9细胞比例、IL-9 mRNA水平升高,与Tc9细胞分化相关的细胞因子IL-9、TGF-β1、IL-4和IL-33水平也升高,且Tc9细胞比例与总IgE水平呈正相关,过敏原阳性患儿外周血Tc9细胞比例明显升高。以上结果表明Tc9细胞在反复喘息的发病机制中发挥重要的作用。因此,通过调控Tc9细胞比例及其功能可能是治疗反复喘息的重要途径。
[1]VOCK C,HAUBER H P,WEGMANN M. The other T helper cells in asthma pathogenesisl [J]. J Allergy(Cairo),2010,2010:519298.
[2]TEIJEIRO A,BADELLINO H,RAIDEN M G,et al. Risk factors for recurrent wheezing in the first year of life in the city of Córdoba,Argentina[J]. Allergol Immunopathol(Madr),2017,45(3):234-239.
[3]COOK J,SAGLANI S. Pathogenesis and prevention strategies of severe asthma exacerbations in children[J]. Curr Opin Pulm Med,2016,22(1):25-31.
[4]PATELAROU E,TZANAKIS N,KELLY F J.Exposure to indoor pollutants and wheeze and asthma development during early childhood[J]. Int J Environ Res Public Health,2015,12(4):3993-4017.
[5]LYNCH S V,WOOD R A,BOUSHEY H,et al.Effects of early-life exposure to allergens and bacteria on recurrent wheeze and atopy in urban children[J]. J Allergy Clin Immunol,2014,134(3):593-601.e12.
[6]VISEKRUNA A,RITTER J,SCHOLZ T,et al.Tc9 cells,a new subset of CD8(+) T cells,support Th2-mediated airway inflammation[J]. Eur J Immunol,2013,43(3):606-618.
[7]FARAHANI R,SHERKAT R,HAKEMI M G,et a1.Cytokines(interleukin-9,IL-17,IL-22,IL-25 and IL-33) and asthma[J]. Adv Biomed Res,2014,3:127.
[8]ABDELILAH S,LATIFA K,ESRA N,et a1.Functional expression of IL-9 receptor by human neutrophils from asthmatic donors:role in IL-8 release[J]. J Immunol,2001,166(4):2768-2774.
[9]MA C S,TANGYE S G,DEENICK E K. Human Th9 cells:inflammatory cytokines modulate IL-9 production through the induction of IL-21[J]. Immunol Cell Biol,2010,88(6):621-623.
[10]MOHAPATRA A,VAN DYKEN S J,SCHNEIDER C. Group 2 innate lymphoid cells utilize the IRF4-IL-9 module to coordinate epithelial cell maintenance of lung homeostasis[J]. Mucosal Immunol,2016,9(1):275-286.
[11]ITO C,OKUYAMA-DOBASHI K,MIYASAKA T,et al. CD8+ T cells mediate female-dominant IL-4 production and airway inflammation in allergic asthma[J]. PLoS One,2015,10(10):e0140808.
[12]HUBER M,LOHOFF M. Change of paradigm:CD8+ T cells as important helper for CD4+ T cells during asthma and autoimmune encephalomyelitis[J].Allergo J Int,2015,24(1):8-15.
[13]TSAI T C,LU J H,CHEN S J,et al. Soluble interleukin-10 and transforming growth factor-beta in children with acute exacerbation of allergic asthma[J].J Asthma,2009,46(1):21-24.
[14]AL-DAGHRI N M,ALOKAIL M S,DRAZ H M,et al. Th1/Th2 cytokine pattern in Arab children with severe asthma[J]. Int J Clin Exp Med,2014,7(8):2286-2291.
[15]CHIANG C H,CHUANG C H,LIU S L,et al.Genetic polymorphism of transforming growth factor β1 and tumor necrosis factor α is associated with asthma and modulates the severity of asthma[J]. J Respir Care,2013,58(8):1343-1350.
[16]JIANG K,CHEN H B,WANG Y,et al. Changes in interleukin-17 and transforming growth factor beta 1 levels in serum and bronchoalveolar lavage fluid and their clinical significance among children with asthma[J]. Transl Pediatr,2013,2(4):154-159.
[17]BAHRAMI MAHNEH S,MOVAHEDI M,ARYAN Z,et al. Serum IL-33 is elevated in children with asthma and is associated with disease severity[J]. Int Arch Allergy Immunol,2015,168(3):193-196.
[18]SAGLANI S,LUI S,ULLMANN N,et al. IL-33 promotes airway remodeling in pediatric patients with severe steroid-resistant asthma[J]. J Allergy Clin Immunol,2013,132(3):676-685. e13.
[19]LANDGRAF-RAUF K,ANSELM B,SCHAUB B.The puzzle of immune phenotypes of childhood [J].Mol Cell Pediatr,2016,3(1):27.
[20]FOGACA H R,MARSON F A,TORO A A,et al.Epidemiological aspects of and risk factors for wheezing in the fi rst year of life[J]. J Bras Pneumol,2014,40(6):617-625.
[21]WANG W,CHENG Z S,CHEN Y F,et al.Increased circulating IL-9-producing CD8+ T cells are associated with eosinophilia and high FeNO in allergic asthmatics[J]. Exp Ther Med,2016,12(6):4055-4060.
