基于上臂袖带振荡波估测动脉僵硬度的理论方法及临床实验
2018-05-08张絮洁章亚平殷兆芳覃开蓉梁夫友
张絮洁,章亚平,殷兆芳,覃开蓉,梁夫友
1.上海交通大学 船舶海洋与建筑工程学院,上海 200240;2.上海交通大学医学院附属上海第六人民医院 心内科,上海200233;3.上海交通大学医学院附属上海第九人民医院 心内科,上海 200011;4.大连理工大学 光电工程与仪器科学学院,辽宁 大连 116024
引言
近年来,心血管疾病在我国居民的总死亡原因中占比达四成以上[1],构成严重的社会与经济问题。虽然现代医学的进步有效改善了心血管疾病的治疗效果,但患者长期预后仍不乐观,心血管疾病的致死率和致残率居高不下[2-3]。因此,如何对心血管疾病进行提前预警和干预仍是临床医学界的主要课题之一。近十余年来,多个课题组基于大样本人群调查对心血管疾病的预测/风险因子进行了深入研究。研究表明,除年龄、血压等常规风险因子外,中心动脉僵硬度不仅是原发性高血压患者的全因和心血管死亡率的独立预测因子[4],也可作为冠心病和脑卒中患者健康状态的独立预测因子[5]。在此背景下,动脉僵硬度无创检测方法的开发和临床验证已成为近年来心血管医疗器械领域的研究热点之一。
目前,评估动脉僵硬度的经典方法为脉搏波传导速度(Pulse Wave Velocity,PWV)测量[6],该方法以血管长度与脉搏波相位差的比值计算PWV,得到反映脉搏波传导通路上动脉平均僵硬度的指标。PWV可根据测量位置进行分类,其中,肱—踝脉搏波传导速度(Brachial-Ankle Artery PWV,baPWV)在我国、日本和韩国等东亚地区得到了广泛应用。相关研究表明,baPWV对包括冠状动脉粥样硬化[7]、急性冠脉综合征[8]、动脉粥样硬化血管损伤[9]、冠心病[10]、脑卒中[11-12]等在内的多种心血管不良事件都具有指示价值。然而,由于该测量方法的设备成本较高、需要专业的操作,并且测量时间长、准确性易受血压、身高、心率等因素的影响[13],不适用于对大样本人群进行筛查与风险评估。因此,亟待开发一种能够快速、便捷、无创地检测动脉僵硬度的新设备。
近年来,一种新型便携式动脉脉波检测仪(PASESA AVE-1500;Shisei Datum,Co., Ltd.,Japan)得到越来越广泛的应用,实物外形及测量结果显示画面见图1,该设备除可无创测量肱动脉血压外,可同时输出反映中心动脉和肱动脉僵硬度的指标,即动脉波速指数(Arterial Velocity-Pulse Index,AVI)和动脉压力容积指数(Arterial Pressure-Volume Index,API)。该设备的主要优点是测量过程全自动、测量所需时间短、且允许受测者坐姿测量。测量指标的临床有用性在多项临床研究中得到了证实。例如,AVI对冠脉的早期粥样硬化病变有预测价值[14],在糖尿病患者群体中AVI与脑卒中、冠心病等心血管事件正相关[15],在心脏病患者中AVI与运动机能负相关[16]。另一方面,鉴于患者的个体差异性以及临床可测数据的局限性,测量结果对心血管参数的敏感性尚不明确,一定程度上阻碍了对临床研究结果的解释和分析。

图1 PASESA AVE-1500的外形图及测量结果显示画面
因此,本文将构建循环系统与上臂袖带的耦合计算模型,模拟该动脉脉波检测仪的测量过程,基于模拟的袖带振荡波特征与年龄或主动脉PWV的关系,理论上检验利用袖带振荡波估测中心动脉僵硬度的可行性,并通过调整模型参数量化评价心脏收缩功能、外周血管总阻抗和肱动脉僵硬度等心血管参数对估测结果的影响,从而为解读临床实测结果提供理论参考。进一步地开展临床实验,将AVI与经典动脉僵硬度指标baPWV进行对比,并在健康人群中考察AVI与年龄的相关性。
1 循环系统-袖带耦合模型构建及AVI测量原理检验
根据动脉脉波检测仪PASESA AVE-1500的工作原理和操作流程,袖带置于左上臂处,在高袖带压(高于肱动脉收缩压)条件下采集袖带振荡波计算AVI[14,16]。而API基于袖带减压过程中连续采集的振荡波信号,通过透壁压—血管容积曲线进行评估[17]。
1.1 模型结构及计算条件
本文采用课题组近期开发的循环系统—袖带耦合模型[18]对AVI的测量过程进行计算机仿真。该耦合模型包含可以模拟动脉脉搏波传导/反射以及系统血流动力学的心血管模型[19],袖带力学模型,袖带压在上臂组织内的分布模型,以及肱动脉壁非线性粘弹性模型[20],模型结构示意图[18,21-22],见图2。
本文仅针对AVI的测量原理和敏感性开展研究,因此,模型的计算条件设置以AVI测量为参考,即在仿真计算中将袖带气囊迅速充气,在袖带压达到高于肱动脉收缩压30 mmHg后维持袖带压不变,待计算收敛后停止计算,采用高通滤波处理计算得到的数字化袖带压数据,输出袖带振荡波数据[18,23]。
1.2 模型验证

图2 循环系统—袖带耦合模型
采用模型在高袖带压条件下模拟计算袖带振荡波,模拟对象分别为健康年轻人和中年人。心血管参数随年龄的变化基于实测数据或通过参数拟合进行设定[24]。同时,使用PASESA AVE-1500分别对两组年龄段25岁和56岁的健康人(每组样本中男性样本两例,女性样本两例)进行袖带振荡波采集。每组样本袖带振荡波的实测数据及合成曲线,见图3a~b,相应的模型计算结果,见图3c~d。
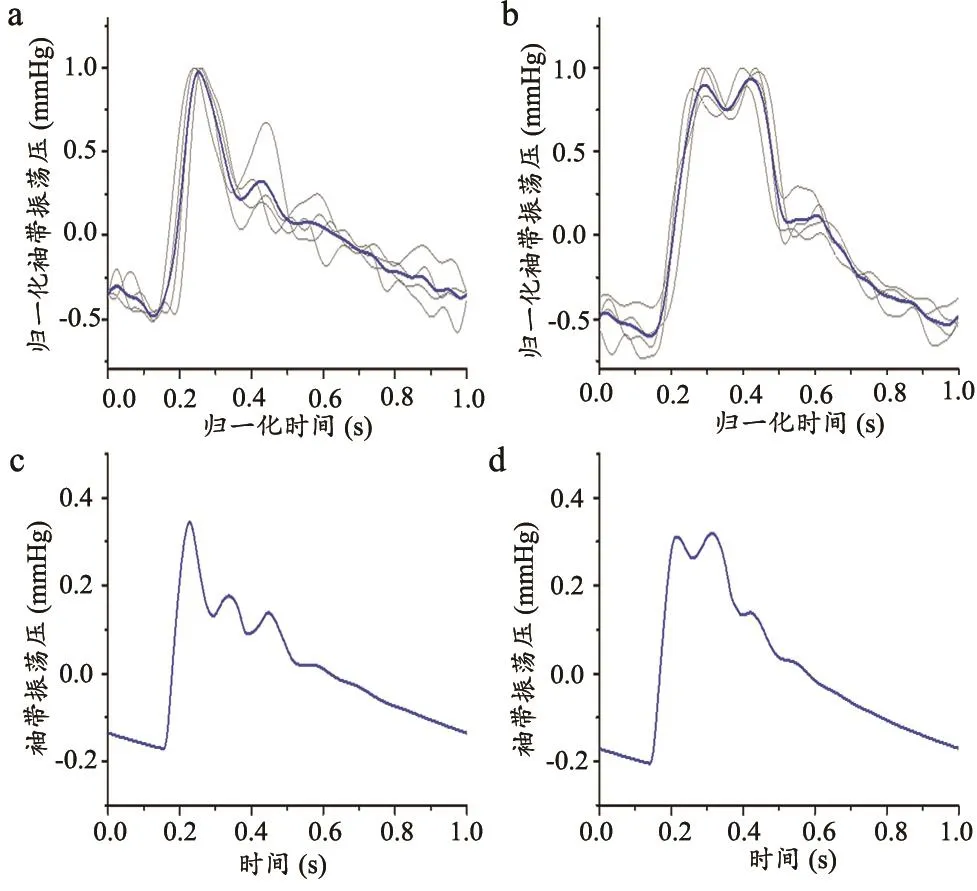
图3 不同年龄段的袖带振荡波
由图可见,实测与模拟数据所呈现的波形特征一致,表明本计算模型可以合理再现PASESA AVE-1500的测量过程。波形在收缩期出现双峰,且第二峰随年龄增长而显著升高。上述波形特征的变化与动脉系统内脉搏波传导、反射与叠加模式随年龄增长所发生的变化有关。根据既往研究,中心动脉僵硬度随年龄增长而升高是人体心血管系统自然老化的一般特征[25],相对年轻人,中老年人的脉搏波传导速度更快,造成源自外周血管的反射波抵达近心端主动脉的时间提前,该反射波与入射波在收缩中后期叠加,造成图3所示第二峰在中年时升高这一现象。因此,理论上,袖带振荡波蕴含着反映动脉系统内脉搏波传导、反射状态的信息,对其进行特征提取和量化分析有望实现对动脉僵硬度的间接估测。
1.3 AVI测量原理的理论分析
根据课题组的前期研究,图3中第二峰值随年龄增长发生的增高程度除主要受中心动脉僵硬度影响外,还受外周血管阻抗、上臂动脉僵硬度等其他心血管因素的影响[18,26],因此,振荡波上的第二峰值无法直接用于评估中心动脉僵硬度。进一步分析振荡波的波形特征发现,第二峰后压力快速下降,下降陡度在年轻人和中年人间存在显著差异,该现象与反射波到达肱动脉的时间有关,即到达时间越早,陡度越大。为了量化评估该现象,我们计算袖带振荡波的一阶时间微分见图4,微分波形上呈现两个峰值(P1,P2)和两个谷值(V1,V2)。P1反映了收缩早期(振荡波第一峰前)的增压陡度,与心脏收缩功能有关,V1、P2分别为振荡波第二峰前的降压和增压陡度,受主动脉—肱动脉间的脉波反射强度和源自主动脉的反射波到达时间的双重影响,V2为第二峰后的降压梯度,主要受反射波到达时间影响。进一步计算V1、V2与P1的绝对值之比得到无量纲指标,考察其与年龄的关系。模拟计算得到的结果显示,|V1|/|P1|随年龄下降,而|V2|/|P1|随年龄升高(图5a)。考虑中心动脉僵硬度随年龄单调增高[25],|V1|/|P1|和|V2|/|P1|均可能与中心动脉僵硬度有关。
本文进一步利用模拟计算考察上述指标是否受肱动脉僵硬度的影响(对应年龄:85岁),结果见图5b。|V1|/|P1|随肱动脉僵硬度的增大而显著减小,而|V2|/|P1|对肱动脉僵硬度变化不敏感。也就是说,|V1|/|P1|与主动脉、肱动脉僵硬度均相关,而|V2|/|P1|则主要反映主动脉的僵硬度。在动脉脉波检测仪(PASESA AVE-1500)中,AVI被定义为AVI=A×|V2|/|P1|,其中A为常数,与|V2|/|P1|的计算方法类似,因而AVI是理论上可以反映中心动脉僵硬度的无量纲指标。

图4 袖带振荡波及其微分波形特征
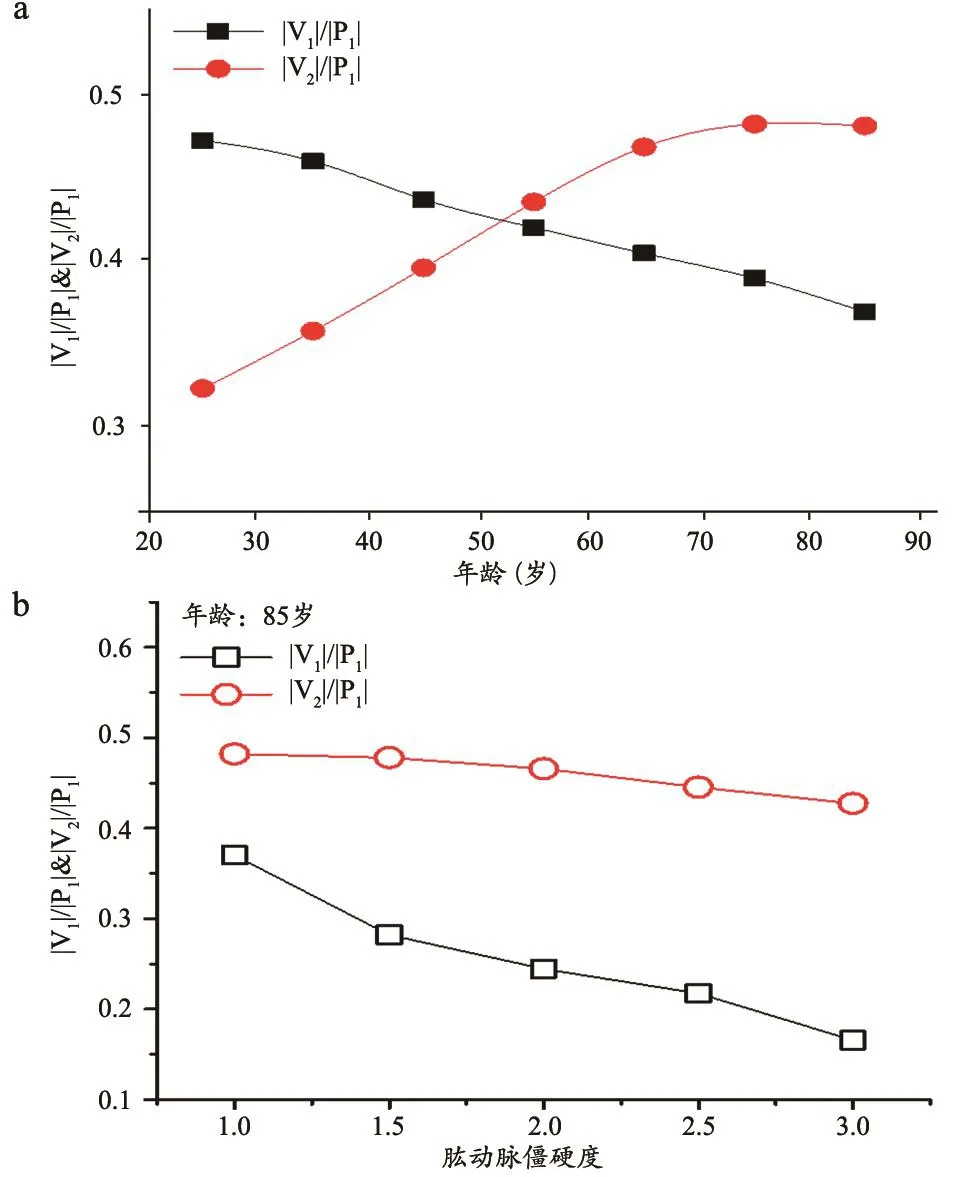
图5 |V2|/|P1|&|V2|/|P1|与年龄/肱动脉僵硬度的关系
2 心血管参数对|V2|/|P1|的影响
考虑个体差异性以及心血管参数的生理变动性,有必要研究|V2|/|P1|作为中心动脉僵硬度的估测指标是否以及如何受其他心血管因素的影响。根据文献报道,除中心动脉僵硬度外,左心室收缩力(Elva)、外周血管总阻抗(Rs)是动脉脉搏波和血压的主要决定因素[24,27-28],可能会对|V2|/|P1|造成影响。另外,由于袖带振荡波信号来源于袖带下方肱动脉的体积变动,肱动脉僵硬度(Ebr)是另一个值得关注的因素。因此,本文针对左心室收缩力、外周血管总阻抗和肱动脉僵硬度分别设计数值实验,即,将与其对应的模型参数在一定范围内变动(表1),量化评价其对|V2|/|P1|的影响。作为检验|V2|/|P1|估测精度的金标准,Aortic PWV在上行主动脉处计算得到,并通过改变主动脉壁杨氏模量使其在6~11 m/s范围内变动。数值实验结果,见图6,左心室收缩力对|V2|/|P1|产生较大影响,收缩力增强显著降低|V2|/|P1|,收缩力减弱则增大|V2|/|P1|;外周血管总阻抗升高增大|V2|/|P1|,而肱动脉僵硬度升高则减小|V2|/|P1|,但两者的影响程度相对较低。另外,主动脉PWV的变化不显著改变|V2|/|P1|对左心室收缩力和外周血管总阻抗的敏感度,而主动脉PWV升高则显著降低|V2|/|P1|对肱动脉僵硬度的敏感度。所有计算结果的散点分布以及|V2|/|P1|与Aortic PWV的线性相关系数,见图7。

表1 心血管参数的变化范围
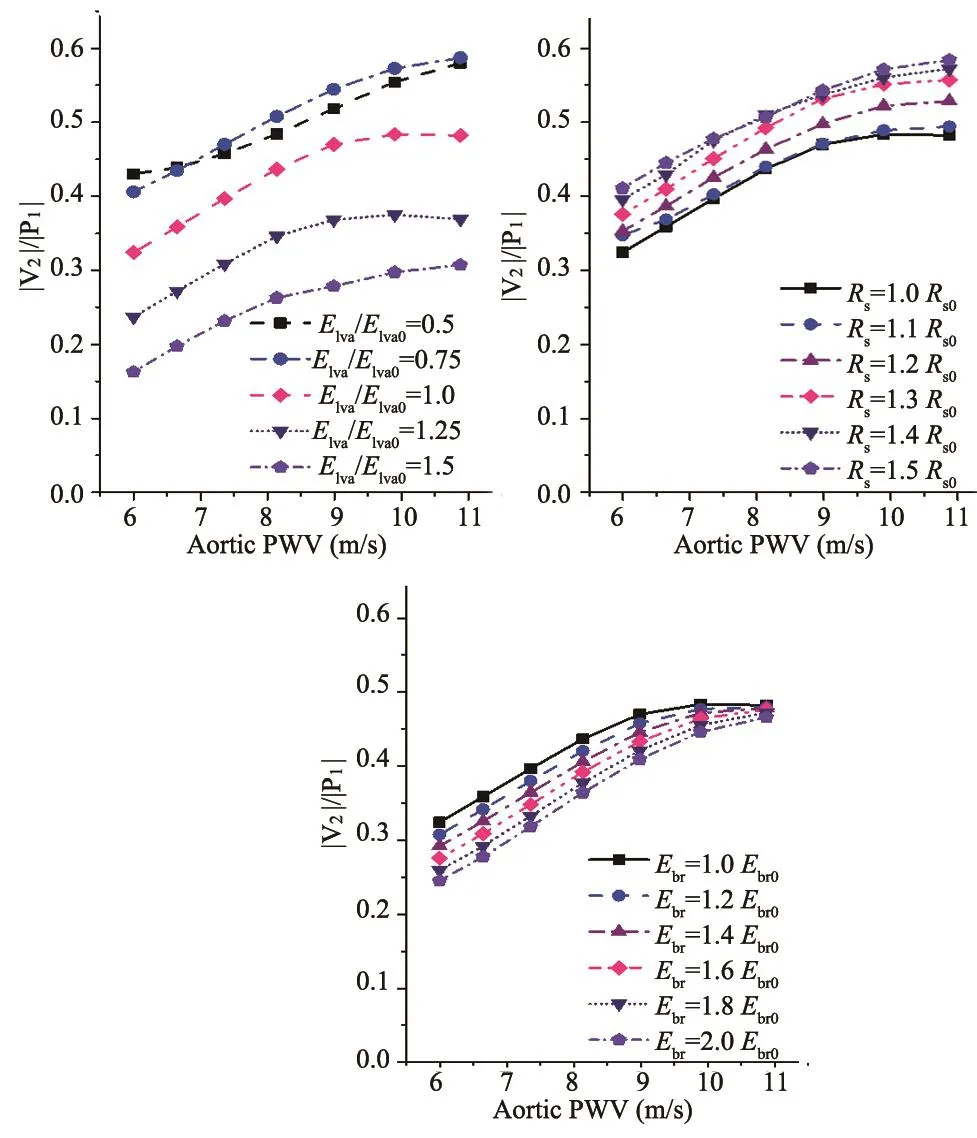
图6 心血管参数对|V2|/|P1|的影响

图7 |V2|/|P1|与Aortic PWV的相关性
由图可知,虽然|V2|/|P1|受其他心血管因素,特别是心室收缩力变化的影响在其参考值附近变动,|V2|/|P1|仍与Aortic PWV保持显著的相关性(r=0.590,P<0.0001)。需要说明的是,在一般人群中,上述心血管参数的变动范围可能小于本数值实验的设定范围,在不考虑实际测量误差的情况下,|V2|/|P1|的受影响程度可能小于本数值实验结果。
3 临床实验
3.1 临床实验一般资料
3.1.1 实验对象范围与入选标准
本临床实验共募集志愿者238人,其中健康受试者170人,心血管疾病患者68人。心血管疾病患者人数占受试者总人数的28.6%,与《中国心血管病报告2015》[1]中报道的高血压、脑卒中和冠心病等心血管疾病在成人中的发病率(25.2%~44.6%)相当,因此本实验的样本集对中国普通人群具有一定的代表性,实验结果有助于了解测试仪器在一般人群中的使用性能。
实验对象入选需满足:年龄在20~90岁;经检查确诊患高血压、冠心病等心血管疾病或糖尿病的受试者归入心血管疾病患者组,无明显上述疾病者归入健康受试者组;排除上肢有感染、对实验耐受性差或经研究者认定不适合本临床实验的受试者。
3.1.2 仪器与方法
本实验采用研究用动脉脉波检测仪PASESA AVE-1500(Shisei Datum Co., Ltd., Japan)和动脉硬化检测装置BP-203RPEIII(欧姆龙有限公司,大连,中国)两种设备分别对每位受试者进行测量,前者输出AVI,后者输出baPWV。首先使用PASESA AVE-1500测量AVI,5 min后再次测量,取两次测量结果的平均值纳入数据统计。在受试者充分休息后(一般为10 min),继续使用BP-203RPEIII测量baPWV,取左右baPWV的平均值纳入数据统计。待所有数据采集完毕,采用统计学方法比较两组受试者的测量结果,分析AVI与baPWV的相关性,并对健康受试者进一步分析AVI与年龄的相关性。
3.2 临床实验结果
3.2.1 基础资料汇总
基础临床资料以平均数±标准差(或百分率)表示,并利用t检验(或χ2检验)进行组间比较。两组患者临床资料在性别比例、舒张压、心率方面无统计学差异(P>0.05),而在年龄、身体质量指数(BMI)、收缩压、平均压方面心血管疾病患者组显著偏高(P<0.05),该统计结果与心血管疾病的一般风险因子一致(表2)。

表2 基础临床资料汇总表
3.2.2 动脉僵硬度指标的组间比较
心血管疾病患者组与健康受试者组比较,AVI与baPWV均显著偏高,具有统计学意义(表3)。既往横断面及随访研究均表明,心血疾病患者的动脉僵硬度指标显著高于健康人[5,29],与本文的研究结果一致。

表3 动脉僵硬度指标比较表
3.2.3 相关性分析
AVI与baPWV、年龄的相关性采用Pearson法进行分析。AVI与baPWV呈显著正相关关系(r=0.656,P<0.0001,n=238),AVI随baPWV变化的散点分布与线性拟合图,见图8a。在健康受试者组,AVI与年龄呈显著正相关关系(r=0.525,P<0.0001,n=170),AVI随年龄变化的散点分布与线性拟合图,见图8b。AVI与年龄在健康人群的相关系数与文献报道的主动脉PWV与年龄的相关系数接近 [r=0.63,P<0.0001,n=96(男性);r=0.61,P<0.0001,n=50(女性)][30],表明AVI在监测随年龄增长而发生的生理性动脉硬化现象方面与PWV有相似的性能。
4 结语
PASESA AVE-1500通过对高袖带压条件下采集的振荡波进行波形解析,输出可以反映中心动脉僵硬度的无量纲指标AVI。在过去数年中,有关PASESA AVE-1500的研究多围绕其测量指标的临床意义开展,证明AVI对冠心病、脑卒中、运动机能下降和冠脉早期动脉粥样硬化等均有一定的预测价值[14-16,31]。然而,尚无研究对其测量原理及影响因素进行全面分析,造成对临床数据的解释缺乏充分的理论依据。本文通过构建循环系统—上臂袖带的耦合模型,再现了PASESA AVE-1500的测量过程,明确了AVI作为中心动脉僵硬度指示性指标的生物力学基础,同时,利用数值实验量化评价了心血管参数对AVI测量精度的影响。

图8 AVI与baPWV/与年龄的相关性
在多种心血管条件下计算得到的|V2|/|P1|与主动脉PWV的相关系数与实测AVI与实测baPWV及年龄的相关系数接近,证明理论计算较好地再现了临床观测现象,计算模型设计及所揭示的生物力学机理具有合理性。数值研究发现,左心室收缩功能减弱引起|V2|/|P1|显著升高,而近期临床研究显示,AVI与心衰标志物BNP显著正相关[14],两者趋势一致。该现象提示,对处于同等动脉硬化水平的患者,心收缩功能不良者的AVI测量值有偏高的倾向。另外,外周血管总阻抗和肱动脉僵硬度也对AVI测量造成一定的影响,虽然相对心收缩功能其影响程度较低,仍提示生活习惯改变或药物治疗引起的上述参数变化可能改变AVI的测量结果。特别对主动脉僵硬度较低的健康年轻人,上臂肱动脉僵硬度的个体差异可能对AVI的测量结果造成一定的影响。需要强调的是,理论计算未对多个心血管因素的综合影响进行量化评估,亦未考虑实际测量时信号采集、处理及分析产生的系统误差,因此,本研究结果限于为测量原理检验及测量结果敏感度分析提供理论参考。在实际使用中,由于患者的个体差异性以及生理、病理条件变化的复杂性,测量结果的变化受多种因素的影响,对测量结果的解释需要充分考虑患者的具体情况,并在必要时结合其他检测手段进行综合评价。
本文利用生物力学模型对现有医疗设备(PASESA AVE-1500)的测量原理及其性能进行了量化评估,并开展临床实验,实现了理论与实际的相互验证。该研究将为医疗设备的原理验证、方法创新及精度分析提供有益的思路。
[参考文献]
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2015》概要[J].中国循环杂志,2016,31(6):521-528.
[2] Nichols M,Townsend N,Scarborough P,et al.Cardiovascular disease in Europe 2014: epidemiological update[J].Eur Heart J,2014,35(42):2950-2959.
[3] Sidney S,Quesenberry CP,Jaffe MG,et al.Recent trends in cardiovascular mortality in the United States and public health goals[J].JAMA Cardiolo,2016,1(5):594-599.
[4] Laurent S,Boutouyrie P,Asmar R,et al.Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients[J].Hypertension,2001,37(5):1236.
[5] Mattace-Raso FUS,van der Cammen TJM,Hofman A,et al.Arterial stiffness and risk of coronary heart disease and stroke: the rotterdam study[J].Circulation,2006,113(5):657-663.
[6] Laurent S,Cockcroft J,Bortel LV,et al.Expert consensus document on arterial stiffness: methodological issues and clinical applications[J].Eur Heart J,2006,27(21):2588.
[7] Xu Y,Wu Y,Li J,et al.The predictive value of brachial-ankle pulse wave velocity in coronary atherosclerosis and peripheral artery diseases in urban Chinese patients[J].Hypertens Res,2008,31(6):1079-1085.
[8] Tomiyama H,Koji Y,Yambe M,et al.Brachial-ankle pulse wave velocity is a simple and independent predictor of prognosis in patients with acute coronary syndrome[J].Cir J,2005,69(7):815.
[9] Yamashina A,Tomiyama H,Arai T,et al.Brachial-ankle pulse wave velocity as a marker of atherosclerotic vascular damage and cardiovascular risk[J].Hypertens Res,2003,26(8):615-622.
[10] Zhang CF,Liu XP,Liang MH.Associations of coronary heart disease with serum homocysteine, brachial-ankle pulse wave velocity, and ankle brachial index[J].Chin Gen Pract,2011,14:2019-2021.
[11] Seo WK,Lee JM,Park MH,et al.Cerebral microbleeds are independently associated with arterial stiffness in stroke patients[J].Cerebrovasc Dis,2008,26(6):618-623.
[12] Kim JH,Kim MY,Lee JU,et al.Waveform analysis of the brachial-ankle pulse wave velocity in hemiplegic stroke patients and healthy volunteers: a pilot study[J].J Phys Ther Sci,2014,26(4):501-504.
[13] 张维忠.动脉弹性功能检测的理论与实践(上)[J].心脑血管病防治,2003,(4):1-2.
[14] Zhang Y,Yin P,Xu Z,et al.Non-invasive assessment of early atherosclerosis based on new arterial stiffness indices measured with an upper-arm oscillometric device[J].Tohoku J Exp Med,2017,241(4):263-270.
[15] Akiyama Y,Hisano Y,Hayakawa N,et al.Comparison among indices obtained from oscillometric blood pressure apparatus,flow mediated dilatation, intra-media thickness (in Japanese)[J].Prog Med,2010,30:2003-2007.
[16] Tazawa Y,Mori N,Ogawa Y,et al.Arterial stiffness measured with the cuff oscillometric method is predictive of exercise capacity in patients with cardiac diseases[J].Tohoku J Exp Med,2016,239(2):127-134.
[17] Komine H,Asai Y,Yokoi T,et al.Non-invasive assessment of arterial stiffness using oscillometric blood pressure measurement[J].Biomed Eng Online,2012,11(1):6.
[18] Liang F,Takagi S,Himeno R,et al.A computational model of the cardiovascular system coupled with an upperarm oscillometric cuff and its application to studying the suprasystolic cuff oscillation wave, concerning its value in assessing arterial stiffness[J].Comput Methods Biomech Biomed Engin,2013,16(2):141-157.
[19] Liang F,Takagi S,Himeno R,et al.Multi-scale modeling of the human cardiovascular system with applications to Aortic valvular and arterial stenoses[J].Med Biol Eng Comput,2009,47(7):743-755.
[20] Drzewiecki G,Hood R,Apple H.Theory of the oscillometric maximum and the systolic and diastolic detection ratios[J].Ann Biomed Eng,1994,22(1):88-96.
[21] Deng Z,Liang F.Numerical analysis of stress distribution in the upper arm tissues under an inflatable cuff: Implications for noninvasive blood pressure measurement[J].Acta Mech Sinica,2016,32(5):959-969.
[22] Liang F,Liu H,Takagi S.The effects of brachial arterial stiffening on the accuracy of oscillometric blood pressure measurement: A computational model study[J].J Biomech Sci Engin,2012,7:15-30.
[23] Sueta D,Yamamoto E,Tanaka T,et al.The accuracy of central blood pressure waveform by novel mathematical transformation of non-invasive measurement[J].Int J Cardiol,2015,189:244-246.
[24] Liang F,Takagi S,Himeno R,et al.Biomechanical characterization of ventricular-arterial coupling during aging: a multiscale model study[J].J Biomech,2009,42(6),692-704.
[25] Mitchell GF,Parise H,Benjamin EJ,et al.Changes in arterial stiffness and wave reflection with advancing age in healthy men and women: the framingham heart study[J].Hypertension,2004,43(6):1239-1245.
[26] Liang F,Takagi S,Liu H.The influences of cardiovascular properties on suprasystolic brachial cuff wave studied by a simple arterial-tree model[J].J Mech Med Biol,2012,12(3):1250040.
[27] Reymond P,Merenda F,Perren F,et al.Validation of a onedimensional model of the systemic arterial tree[J].Am J Physiol Heart Circ Physiol,2011,301(3):1173-1182.
[28] Liang F,Senzaki H,Kurishima C,et al.Hemodynamic performance of the Fontan circulation compared with a normal biventricular circulation: a computational model study[J].Am J Physiol-Heart C,2014,307(7):1056-1072.
[29] Hansen TW,Staessen JA,Torp-Pedersen C,et al.Prognostic value of Aortic pulse wave velocity as index of arterial stiffness in the general population[J].Circulation,2006,113(5):664-670.
[30] Vaitkevicius PV,Fleg JL,Engel JH,et al.Effects of age and aerobic capacity on arterial stiffness in healthy adults[J].Circulation,1993,88(4):1456-1462.
[31] Nakashima S,Kino R,Chen T,et al.Successful prediction of cardiovascular risk by new non-invasive vascular indexes using suprasystolic cuff oscillometric waveform analysis[J].J Cardiol,2017,69(1):30-37.
