一种捕获尿液中膀胱癌细胞的新型微流控芯片的设计
2018-05-08耿春阳李驰宇李雅楠任海军翟晓峰刘波
耿春阳,李驰宇,李雅楠,任海军,翟晓峰,刘波
1.大连理工大学 生物医学工程系,辽宁 大连 116024;2.大连市友谊医院 普外科,辽宁 大连 116024;3.锐意微流控医疗科技(常州)有限公司,江苏 常州 213111
引言
膀胱癌是指发生在膀胱粘膜上的恶性肿瘤,是我国泌尿外科临床上最常见的肿瘤之一。膀胱癌患者可表现出多种症状,如血尿、尿急、尿频、盆腔疼痛等,而90%以上的膀胱癌患者最初的临床表现症状是血尿,然而出血量与血尿持续时间的长短,与肿瘤的恶性程度和大小没有明显关系,这是膀胱癌高致死率的重要原因[1]。如果早期发现,膀胱癌5年生存率大概为94%,可见膀胱肿瘤的早期诊断可以极大地降低膀胱癌的致死率[2]。目前临床上对于有尿路症状患者的出诊筛查和对膀胱癌术后患者的复查主要手段有尿脱落细胞学检查、膀胱镜检查、尿路造影术和荧光原位杂交(Fluorescent in Situhybridization,FISH)等技术。其中尿脱落细胞学检查属于无创检测,但是其敏感性较低[3];膀胱镜检查属于有创检测[4];尿路造影术不支持活检[5];FISH技术费用过高[6]。因此,亟需一种新的无创检测方法,既拥有较高的敏感性和特异性,同时费用低廉,足以让大部分患者可以承受。
应用于肿瘤细胞检测的微流控芯片技术在近十年逐渐出现[7]。为了实现肿瘤细胞的检测,首先必须完成在微流控芯片内对肿瘤细胞的高效抓捕。细胞捕获的手段有很多,目前微流控芯片用到的细胞捕获技术主要基于光学、电学、流体力学以及抗原抗体结合等原理,通过微流控芯片内部的特殊结构和其他的技术相结合也是常用的方法。高菊逸等[8]设计出一种简易的用于循环肿瘤细胞(Circulating Tumor Cell,CTC)捕获的一种玻璃—聚二甲硅氧烷(Polydimethylsiloxane,PDMS)型芯片。首先,玻片表面经过氧等离子、硅烷化处理,使玻片表面能够固定特异性抗体;然后通过抗原抗体特异性结合捕获靶细胞,捕获率可高达92%。巧妙的结构设计同样可以用于细胞的捕获。Stott等[9]在芯片中设计出了一种人字形结构用于CTC的捕获,这种结构让血液样品在微流控芯片中充分混合以增加CTC的捕获效率,最后成功地在患有前列腺癌患者的血液样品中捕获观察到了CTC。但截止目前,尚未见通过尿液抓捕检测膀胱癌细胞的相关报道。
本文基于微流控芯片技术,通过设计芯片内部特殊的抓捕结构,结合抗原抗体吸附反应特异性,探究抗体固定在芯片内表面的最佳条件,实现从尿液样品中特异抓捕和鉴定膀胱癌细胞。
1 材料与方法
1.1 芯片设计与制备
结合目前已经成熟的捕获肿瘤细胞的方法,设计中将抗原抗体免疫吸附反应原理结合到微流控芯片上,使其能够准确检测尿液样品中可能出现的膀胱癌细胞,以此作为标准来判断患者是否患有膀胱癌。芯片的流体通道结构,见图1。通道结构主要由尿液样本入口、尿液样品检测单元和尿液样本出口组成。
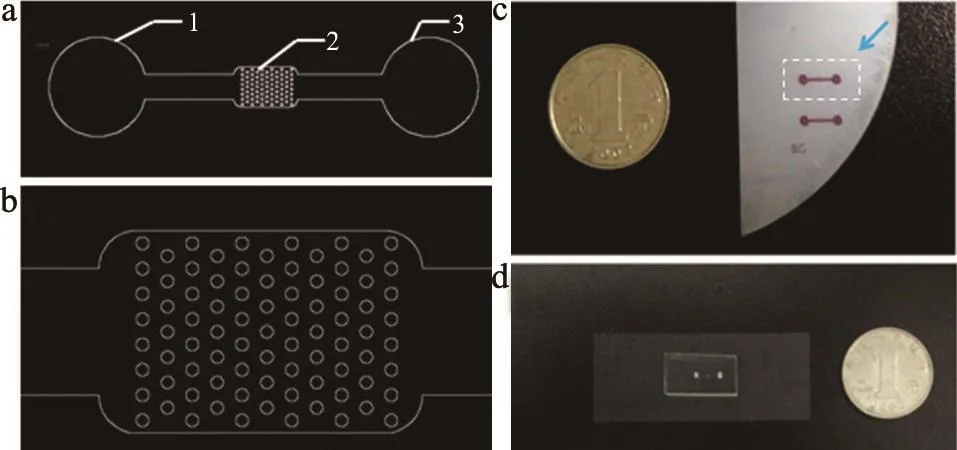
图1 微流控芯片流体通道结构平面图
在检测单元中,设置有半径为25 μm的圆柱体阵列。其中每一行相邻圆柱之间圆心间隔100 μm;相邻两行圆柱之间圆心所在直线平行;圆柱体阵列交错分布,间隔100 μm。圆柱体阵列之间的间隔恰好足够肿瘤细胞通过并且可以起到延长实验时间、减缓流速以及增加膀胱癌细胞的捕获效率等一系列的作用。
该微流控芯片是透明的玻璃—PDMS芯片,所有通道和腔室采用PDMS(沈阳力天利源商贸有限公司)作为材料,并与0.17 mm厚度的玻璃片键合密封,构成玻璃—PDMS芯片。
1.2 抗体固定条件探究
本文采用基于抗原抗体免疫吸附反应的方式抓捕并鉴定膀胱癌细胞,首先探究最适宜的抗体固定条件。采用氨丙基三乙氧基硅烷(Aminopropyltriethoxysilane,APTES)硅烷化修饰玻片表面,使其具有固定蛋白质抗体的能力。为了探究最佳的修饰玻片条件,本文使用异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)标记的荧光抗体进行实验,在显微镜下观察拍照后使用图像处理软件计算荧光强度,以荧光强度代表被固定在玻片表面的抗体量。将硅烷化玻片的时间分别设定为1、5和20 min,在其他实验条件完全相同的状况下进行实验,观察荧光强度并分析。随后在硅烷化时间相同的情况下,将抗体孵育的时间分别设定为1.5、2和2.5 h,再次观察荧光强度并分析。
1.3 膀胱癌样品鉴定
取膀胱癌患者18例的病理组织作切片(大连市友谊医院)作为验证,病理切片采用经典的苏木精—伊红染色法(Hematoxylin-Eosin Staining,HE)进行染色,通过常规组织形态学判断是否是膀胱癌组织。同时取50 mL膀胱癌患者的尿液样品,置于台式高速低温离心机中以800 G离心力离心10 min,小心去除上清废液。将离心后得到的细胞置于玻璃底培养皿中,采用免疫荧光进行膀胱癌细胞的鉴定。在玻璃底培养皿里加入胶原促使细胞粘附在玻璃底上,在显微镜下观察确认细胞的存在后向培养皿内加入1:200 磷酸盐缓冲液(Phosphate Buffered Solution,PBS)稀释的膀胱癌细胞特异性抗体Rabbit Anti-CD15 antibody,将玻璃底培养皿置于湿盒中4℃过夜;随后取出培养皿,使用PBS清洗3遍洗去多余的一抗,随后向培养皿中加入1:100 PBS稀释的FITC标记的荧光二抗Anti-Rabbit IgG,在37℃培养箱中孵育1~2 h之后置于荧光显微镜下观察是否有带荧光的细胞。
1.4 膀胱癌细胞的抓捕鉴定
将1:100 PBS稀释的CD15抗体通入芯片里面孵育2 h,确保抗体固定在芯片的检测单元区域。随后将离心得到的膀胱癌细胞悬浮液通入到芯片里面并在37℃培养箱中孵育2 h。由于膀胱移行上皮癌在所有膀胱癌中的比例超过90%[10],所以本研究中使用膀胱移行上皮癌对应的特异性荧光一抗来鉴定膀胱癌细胞,即向芯片内灌注1:100 PBS稀释的膀胱移行上皮癌细胞特异性荧光一抗。在37℃培养箱中孵育2 h后用PBS洗去多余的荧光一抗,置于荧光显微镜下观察是否有带荧光的细胞。
1.5 图像分析与数据处理
使用ImageJ软件(National Institutes of Health)处理得到的荧光图像,可以得到荧光强度的具体数值。首先将所得荧光图片导入软件,计算各点的荧光强度,排除荧光强度为0的点之后将所得荧光强度相加除以参与计算的荧光点的个数,得到该幅图像的平均荧光强度;然后重复该步骤得到5幅图像的平均荧光强度作为一组实验数据与其他条件下的实验数据相比较。所得数据采用Execl(Microsoft,USA)统计平均值与标准差,组间数据通过t-Test进行比较,P<0.05视为存在差异显著。
2 实验结果
2.1 硅烷化时间与抗体孵育时间对抗体固定效果的影响
通过实验对比发现在硅烷化时间过长的情况下,APTES容易发生氧化反应而丧失结合蛋白的能力;而如果硅烷化时间过短,则硅烷化并不彻底,也并不利于抗体在玻片上的固定(图2)。在进行了多组数据对比后,发现硅烷化时间为5 min时,抗体的固定效率最高,与其余组相比,差异均有统计学意义(P<0.05)。

图2 硅烷化时间与荧光强度的关系
通过实验对比发现如果孵育时间太短,抗体并不能完全与硅烷化后的玻片充分结合导致固定抗体的量不足;然而孵育时间太长,抗体在玻片上富集可能导致抗体结构改变而造成其功能丧失(图3)。在进行了多组数据对比后,可以看出实验结果与预期相符合,在孵育时间为2 h时,荧光强度最大,抗体的固定效率最高。与其余各组比较,差异均有统计性意义(P<0.05)。

图3 荧光强度与抗体孵育时间的关系
2.2 膀胱癌样品鉴定
不同放大倍率物镜下的膀胱癌患者的病理切片典型形态,见图4。癌细胞的细胞核显著增大,进而出现核胞质失调的现象,同时其细胞核出现畸形。此外,由于癌细胞DNA大量增加,染色质明显增多,染色呈蓝紫色似墨滴状。证明所取样本为典型的膀胱癌样本。

图4 膀胱癌患者病理切片
然后对离心后的18例尿液样品进行免疫荧光鉴定,由于尿液样品中的肿瘤细胞形态并不标准,而且有些病理组织碎片也能非特异性地结合抗体并发出绿色荧光,因此需要对比其白光下的照片进一步确认其是否为膀胱癌细胞,并在不同倍数的显微镜下反复观察确认。结果显示,18例样品中,有11例检出了带有绿色荧光的细胞。离心后的样本细胞,经过免疫荧光鉴定后,在白光下的图片和激发光下的图片,见图5。说明从医院得到的尿液样品中含有膀胱癌细胞,而且所选抗体可以特异性识别膀胱癌细胞,可用于后续的芯片内鉴定实验。

图5 膀胱癌细胞鉴定结果
2.3 膀胱癌细胞的抓捕鉴定
在芯片捕获单元内部进行膀胱癌细胞的特异性抓捕实验,结果见图6。在加入荧光抗体并置于荧光显微镜下观察之后,11例带有肿瘤细胞的病人样品中,都有被捕获的细胞、各种组织以及细胞碎片发出绿色荧光,说明固定于玻片上的抗体特异性地捕获了肿瘤细胞以及与其相关的组织碎片等。

图6 芯片内膀胱癌细胞的抓捕鉴定
3 讨论
近年来,微流控芯片技术的发展为癌细胞检测的研究提供了很多新的思路,但是现在主要的实验研究仍然不能很好地还原癌细胞生存的复杂环境。很多实验选用实验室培养的癌细胞进行芯片的抓捕鉴定实验,其检测特异性可以比临床高出数倍[11-12]。但是癌细胞存在的真实环境往往比较复杂,比如本研究中膀胱癌患者的症状之一是血尿,大量的血细胞将大大增加癌细胞抓捕鉴定的难度,也在一定程度上降低了实验的特异性。微流控芯片作为一个新型的无创检测平台,具有高度的可行性和可重复性,本研究设计的这种微流控芯片制作简单、成本低廉、适用于一次性使用并且能够有效提升临床检测的效率。
在利用微流控芯片实现对膀胱癌细胞抓捕鉴定的过程中,特异性抗体结合到特定的检测单元区域是芯片功能实现的重要内容。抗体作为一种蛋白质,并不能长时间保存,而且变性之后的抗体也不能再用于特异性抗原的鉴定[13],因此需要探究出最适宜的抗体固定条件。由于微流控芯片需要和洁净的0.17 mm厚的盖玻片键合,流体通道的底部是玻璃而四周和顶部是PDMS,所以只需将抗体固定在玻璃片上,检测单元便具备了特异性抓捕和鉴定特定肿瘤细胞的能力。常用的修饰玻片表面方法有多聚赖氨酸修饰[14]、纳米修饰[15-16]、以及戊二醛修饰[17-18]等。其中APTES修饰效果比较明显,且易于工艺化操作,所以采用APTES修饰玻片表面使其具有固定蛋白质抗体的能力。
在使用微流控芯片对膀胱癌患者尿样中的膀胱癌细胞进行抓捕鉴定之前,先在培养皿里利用传统免疫荧光方法对膀胱癌细胞进行提取鉴定。该方法虽然也能够无创检测鉴定膀胱癌细胞,但本文采用的微流控芯片方法与这种传统免疫荧光方法相比,具有以下优势:① 通过微流控芯片进行膀胱癌细胞抓捕与鉴定,消耗的试剂量仅需微升级别,成本低;② 在微流控通道中,荧光强度容易进行定量检测与计算,而在培养皿难以实现;③ 微流控芯片更易实现大规模批量生产和自动化检测。
在实际的实验过程中也发现,由于微流控芯片内部尺寸微小,通常芯片内流通的样本量只有几十微升,而膀胱癌细胞在尿液样品中的数量又较为稀少,在实际检测中并不能实现每次实验都能够特异性地抓捕到膀胱癌细胞。经过数十次反复实验发现,调整灌注的速度和灌注的时间可以使实验结果得到明显改善。灌注速度太快,会导致抗体与样品中膀胱癌细胞接触的时间不足从而难以抓捕到膀胱癌细胞;灌注时间太短会导致进入芯片的样品量太少,也就导致进入芯片的膀胱癌细胞的数量十分稀少。在优化了灌注速度与灌注时间之后,虽然不能确保样品中的所有膀胱癌细胞都被特异性捕获,但是每次实验都能特异性地捕获到样品中膀胱癌细胞。另外,在实验中也发现了一些其他的不足之处,例如有时用于拦截细胞的PDMS阵列偶尔会非特异性地吸附一些细胞或者组织碎片,导致芯片捕获到的细胞并非全都是膀胱癌细胞,不过这种非特异性的干扰可以通过本文采用的抓捕和鉴定两种不同特异抗体交叉重复来排除,即固定在芯片内部表面的一种特异性抗体抓捕样本中的膀胱癌细胞,而通过针对另一种标志性蛋白的带荧光的特异性抗体再与之结合。非特异吸附的细胞或者组织碎片不能与带荧光的特异性抗体结合。因此通过对比荧光与白光照片,即可排除非特异性干扰,并不影响到芯片实际功能的实现。
本文设计制备的微流控芯片具备了高特异性、低成本、无创检测和能够显微镜下观察等一系列优点。整个微流控芯片制作的方法简单、透光性良好、特异性抓捕效果良好。该微流控芯片的成功设计和制备,丰富了临床上针对膀胱癌检测和复查的手段,弥补了一些传统方法的缺陷,为临床诊断提供了现有的模型和更广阔的思路。
[参考文献]
[1] Thompson DB,Siref LE,Feloney MP,et al.Immunological basis in the pathogenesis and treatment of bladder cancer[J].Expert Rev Clin Imm,2015,11(2):265-279.
[2] Chen LM,Chang M,Dai Y,et al.External validation of a multiplex urinary protein panel for the detection of bladder cancer in a multicenter cohort[J].Cancer Epidem Biomar,2014,191(4):1804-1812.
[3] Sullivan PS,Chan JB,Levin MR,et al.Urine cytology and adjunct markers for detection and surveillance of bladder cancer[J].Am J Transl Res,2010,2(4):412.
[4] Lee CS,Yoon CY,Witjes JA.The past, present and future of cystoscopy: the fusion of cystoscopy and novel imaging technology[J].BJU Int,2010,102(9):1228-1233.
[5] Cha KH,Hadjiiski L,Samala RK,et al.Urinary bladder segmentation in CT urography using deep-learning convolutional neural network and level sets[J].Med Phy,2016,43(4):1882.
[6] Nayyar R,Singh P,Gupta NP,et al.Upgrading of gleason score on radical prostatectomy specimen compared to the pre-operative needle core biopsy: an Indian experience[J].IJU,2010,26(1):56-59.
[7] 林炳承.微纳流控芯片实验室[M].北京:科学出版社,2013.
[8] 高菊逸,杜晶辉,张望,等.简易型微流控芯片捕获循环肿瘤细胞的研究[J].化学学报,2014,72(1):69-74.
[9] Stott SL,Hsu CH,Tsukrov DI,et al.Isolation of circulating tumor cells using a microvortex-generating herringbone-chip[J].P Natil Acad Sci USA,2010,107(43):18392-18397.
[10] Park JC,Citrin DE,Agarwal PK,et al.Multimodal management of muscle-invasive bladder cancer[J].Curr Prob Cancer,2014,38(3):80-108.
[11] Hoshino K,Huang YY,Lane N,et al.Microchip-based immunomagnetic detection of circulating tumor cells[J].Lab Chip,2011,11(20):3449-3457.
[12] Xiao Y,Zhou H,Xuan N,et al.Effective and selective cell retention and recovery from whole blood by electroactive thin films[J].Acs Appl Mater Inter,2014,6(23):20804-20811.
[13] Wlad K,Hoheisel JD.Solid supports for microarray immunoassays[J].J Mol Recognit,2010,16(4):165.
[14] Gao D,Wei H,Guo GS,et al.Microfluidic cell culture and metabolism detection with electrospray ionization quadrupole time-of-flight mass spectrometer[J].Anal Chem,2010,82(13):5679.
[15] Goto M,Tsukahara T,Sato K,et al.Micro- and nanometerscale patterned surface in a microchannel for cell culture in micro fluidic devices[J].Anal Bioanal Chem,2008,390(3):817-823.
[16] Guo J,Pui TS,Ban YL,et al.Electrokinetic analysis of cell translocation in low-cost microfluidic cytometry for tumor cell detection and enumeration[J].IEEE Trans Biomed Eng,2013,60(12):3269-3275.
[17] Kusnezow W,Jacob A,Walijew A,et al.Antibody microarrays:an evaluation of production parameters[J].Proteomics,2003,3(3):254-264.
[18] Tao SC,Zhu H.Protein chip fabrication by capture of nascent polypeptides[J].Nat Biotechnol,2006,24(10):1253-1254.
