猴面包树果多糖超声辅助提取及其抗氧化活性研究
2018-05-07孙连立刘露裴运林聂艳峰万水停吴阳清
孙连立,刘露,裴运林,聂艳峰,万水停,吴阳清
(广东丸美生物技术股份有限公司,广东广州510530)
猴面包树果是锦葵目木槿科植物猴面包树(Adansonia digitata L.)的成熟果实,产于非洲大陆、马达加斯加、地中海及澳洲北部等地。猴面包树果因其外观像面包,并且果肉酸甜多汁,可作为食物而得名[1]。
猴面包树果含有丰富的营养成分,有学者对猴面包树果组分进行了研究,结果显示其含有糖类46%~88%,粗蛋白2.5%~17%,油脂0.2%~15.5%,纤维素11%左右,能量8 489 KJ/kg,此外,其含有丰富的维生素C,含量介于150 mg/100 g~500 mg/100 g[2]。猴面包树果具有显著的生理功效,除了可以直接食用外,还可入药,具有消炎、退热并预防痢疾的功效,此外,其还具有养胃利胆、清热消肿、止血止泻和镇静安神的作用[3]。
多糖是由不少于10个糖醛酸或酮糖通过糖苷键的链接形成的一种聚合物,同蛋白质和核酸一样均属生物信息大分子,并参与各种生命活动[4-6]。多糖具有广泛的药理作用,在抗氧化、调节免疫功能、抗病毒、抗肿瘤、抗衰老、降血脂等方面具有多种生物活性[7-12]。猴面包树果实含有丰富的多糖,但目前对其提取及体外生理功效的研究还很少。
随着人们生活水平的提高,猴面包树果及其健康食品逐渐进入中国市场,其丰富的营养物质和良好的生理功效正越来越受到人们的欢迎。本文探索利用超声波辅助提取技术制备猴面包树果多糖,通过单因素试验和响应面优化试验确定最佳提取工艺,经过脱蛋白后得到猴面包树果粗多糖,并对其抗氧化活性进行研究。本试验结果可以为猴面包树果多糖的功效研究提供数据支撑,同时为其在更广泛领域的开发应用提供可行性参考。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
猴面包树果实,已烘干,购于弘亚食品公司,原产地加纳。
1.1.2 主要试剂
葡萄糖、浓硫酸、苯酚、无水乙醇、氯仿、正丁醇、甲醇、冰乙酸、无水乙酸钠、盐酸、氯化铁、硫酸亚铁、铁氰化钾(均为分析纯):广州化学试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):广州左克生物科技有限公司。
1.1.3 主要仪器
P300H超声波清洗器:德国ELMA公司;UV2600紫外-可见分光光度计:日本岛津公司;RV10旋转蒸发仪:德国IKA集团;SHZ-DⅢ循环水式真空泵:河南巩义予华仪器设备有限公司;大容量高速离心机(3-16KL):德国 Sigma公司;冷冻干燥机(FDU-2110):日本东京理化公司;多功能酶标仪(Spark 10M):瑞士Tecan公司。
1.2 方法
1.2.1 原料预处理
将已干燥的猴面包树果粉碎,剥除种子后过60目筛,95%酒精回流脱脂除杂,晾干,得到猴面包树果干粉,密封、干燥条件下保藏备用。
1.2.2 猴面包树果多糖提取工艺
称取3.00 g猴面包树果干粉,按照一定的料液比(g/mL)加蒸馏水混合,密封,放置于超声波清洗器中,按照单因素试验设定的参数进行提取;提取结束后,于4℃、4 500 r/min条件下离心20 min,得上清液;将上清液于55℃条件下减压浓缩至原体积的1/4~1/5;缓慢加入5倍体积的95%乙醇,4℃醇沉12 h;将沉淀冷冻干燥后用蒸馏水复溶,利用sevage法(氯仿∶正丁醇=4∶1(体积比))脱蛋白,重复 2 次;再次醇沉,将沉淀冷冻干燥,即为猴面包树果粗多糖。
1.2.3 提取单因素试验
参照方法1.2.2多糖提取工艺,以多糖提取率为考查指标,分别选择提取温度、提取时间、超声功率、料液比、提取次数5个因素进行猴面包树果多糖提取单因素试验。
提取温度的选择:分别称取3.00 g猴面包树果干粉,固定提取时间1.5 h、超声功率304 W、料液比1∶30(g/mL)、提取次数 1 次,提取温度分别选择 40、50、60、70、80、90℃,比较不同提取温度下多糖提取率。
提取时间的选择:分别称取3.00 g猴面包树果干粉,固定提取温度70℃、超声功率304 W、料液比1∶30(g/mL)、提取次数1次,提取时间分别选择0.25、0.5、1、1.5、2、2.5 h,比较不同提取时间下多糖提取率。
超声功率的选择:分别称取3.00 g猴面包树果干粉,固定提取温度70℃、提取时间2 h、料液比 1∶30(g/mL)、提取次数 1 次,超声功率分别选择 190、228、266、304、342、380 W,比较不同超声功率下多糖提取率。
料液比的选择:分别称取3.00 g猴面包树果干粉,固定提取温度70℃、提取时间2 h、超声功率304 W、提取次数 1 次,料液比分别选择 1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),比较不同料液比下多糖提取率。
提取次数的选择:分别称取3.00 g猴面包树果干粉,固定提取温度70℃、提取时间2 h、超声功率304 W、料液比 1∶30(g/mL),提取次数分别选择 1 次、2次、3次、4次、5次,比较不同提取次数下多糖提取率。
1.2.4 响应面优化试验设计
通过分析单因素试验结果,确定提取温度、提取时间、料液比3个因素的零水平,以多糖的提取率为响应值,通过Design Expert 8.0.5软件,采用Box-Behnken设计,运用三因素三水平响应面分析法,对猴面包树果多糖提取率进行优化设计,试验因素水平及编码见表1。
1.2.5 多糖提取率的测定
采用苯酚-硫酸法测定猴面包树果多糖,操作方法参照农业行业标准NY/T 1676-2008《食用菌中粗多糖含量测定测定》中多糖的测定方法进行,以葡萄糖质量浓度为横坐标,以吸光值为纵坐标绘制回归曲线,所得回归方程为:y=0.010 4x-0.010 6,R2=0.999。

表1 试验因素水平及编码Table 1 Experimental factors level and coding

式中:n为稀释倍数;C为多糖的质量浓度,mg/mL;V为多糖溶液体积,mL;m为猴面包树果干粉的质量,g。
1.2.6 猴面包树果多糖抗氧化活性研究
1.2.6.1 猴面包树果多糖对DPPH·清除能力测定
参照文献[13]的方法,配制浓度为0.2 mmol/L的DPPH甲醇溶液,用蒸馏水将样品配制为不同浓度的溶液。准确量取2 mL样品溶液,加入2 mL DPPH甲醇溶液,混匀,避光反应30 min,用分光光度计在517 nm处测定吸光度,以甲醇溶液调零,以维生素C溶液做阳性对照。

式中:A0为以蒸馏水替代样品测定的吸光度;A1为样品组测定的吸光度;A2为以甲醇替代DPPH甲醇溶液测定的吸光度。
1.2.6.2 猴面包树果多糖对ABTS+·清除能力测定
参照Re等[14]的方法,并稍作修改。准确称取0.192 g ABTS,用2.45 mmol/L的过硫酸钾定容50 mL,室温避光保存12 h~16 h后使用,作为ABTS储备液。将ABTS储备液用磷酸盐缓冲液(10 mmol/L,pH=7.4)稀释,使其在734 nm处的吸光度达到0.70±0.02,即为ABTS工作液。量取5 mL ABTS工作液,加入0.1 mL样品溶液,振荡10 s,30℃条件静置6 min,测定734 nm处的吸光度。以不同浓度的Trolox溶液作为阳性对照,每组试验平行进行3次,按照下式计算ABTS+·清除率。
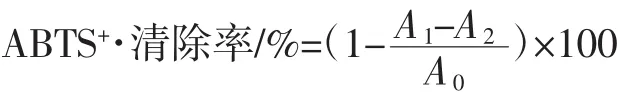
式中:A0为以磷酸盐缓冲液代替样品测定的吸光度;A1为样品组测定的吸光度;A2为以磷酸盐缓冲液代替ABTS工作液测定的吸光度。
1.2.6.3 猴面包树果多糖还原能力测定
参照文献[15]的方法,并稍作修改。取2 mL样品溶液,加入5 mL的磷酸盐缓冲液(0.2 mol/L,pH=6.6),再加入5 mL的1%铁氰化钾溶液,50℃条件下保温20 min。急速冷却,加入5 mL的质量浓度为10%的三氯乙酸溶液,混匀,3 000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL的质量浓度为0.1%的FeCl3溶液,室温反应10 min,测定700 nm波长条件下吸光度。以吸光度的大小衡量还原能力的强弱,吸光度越大,还原能力越强。以蒸馏水代替样品溶液为空白对照,以不同浓度的VC溶液作为阳性对照,每组试验平行进行3次。
1.3 数据分析
利用SPSS18.0和Design-Expert 8.0.5数据处理软件进行数据处理和统计分析。
2 结果与分析
2.1 提取单因素试验
2.1.1 提取温度对猴面包树果多糖提取率的影响
固定其它参数的条件不变,考察不同提取温度对猴面包树果多糖提取率的影响,试验结果见图1。

图1 提取温度对猴面包树果多糖提取率的影响Fig.1 Effect of temperature on polysaccharide extraction rate
由图1可知,随着温度的升高,猴面包树果多糖提取率逐渐升高,当温度达到70℃时,猴面包树果多糖提取率达到最大,为41.76%,之后继续升高提取温度,提取率趋于稳定并略有下降。随着提取温度的升高,多糖分子运动加快,同时可以增加溶剂的渗透能力,提取率随之升高,但是过高的温度可能会对多糖分子结构和生物活性产生破坏作用,因此选择70℃为适宜的提取温度。
2.1.2 提取时间对猴面包树果多糖提取率的影响
固定其它参数的条件不变,考察不同提取时间对猴面包树果多糖提取率的影响,试验结果见图2。
由图2可知,随着提取时间的延长,猴面包树果多糖提取率逐渐升高,当提取时间为1.5 h时,多糖提取率达到最高,为41.53%,之后提取时间继续延长,猴面包树果多糖的提取率几乎不变。延长提取时间,可以使更多的多糖分子渗出到提取溶剂中,但是过长的提取时间存在增加能耗的问题,对多糖的提取率也无提升效果,因此选取1.5 h为合适的提取时间。

图2 提取时间对猴面包树果多糖提取率的影响Fig.2 Effect of time on polysaccharide extraction rate
2.1.3 超声功率对猴面包树果多糖提取率的影响
固定其它参数的条件不变,考察不同超声功率对猴面包树果多糖提取率的影响,试验结果见图3。

图3 超声功率对猴面包树果多糖提取率的影响Fig.3 Effect of ultrasonic power on polysaccharide extraction rate
由图3结果可以看出,随着超声功率的增大,猴面包树果多糖提取率呈现先升高后降低的趋势,当超声功率为342 W时,多糖提取率达到最大,为42.01%,之后将超声功率调至最大功率380 W,多糖提取率反而有小幅降低。超声波的空化作用可以对细胞壁产生破碎作用,加速细胞内物质的溶出,但是较长时间的大功率处理,可能会对多糖的分子结构产生破坏,同时较高的功率意味着较大的能耗,因此选择342 W的超声功率进行后续优化试验。
2.1.4 料液比对猴面包树果多糖提取率的影响
固定其它参数的条件不变,考察不同料液比对猴面包树果多糖提取率的影响,试验结果见图4。

图4 料液比对猴面包树果多糖提取率的影响Fig.4 Effect of solid-liquid ratio on polysaccharide extraction rate
由图4结果可知,随着料液比的减小,猴面包树果多糖的提取率呈现先升高后缓慢降低的趋势。当料液比为1∶30(g/mL)时,多糖提取率达到最大,为40.09%,之后随着料液比继续减小,提取率也随之降低。料液比较大时,混合物的黏度较大,对超声波有一定的阻断作用,不利于细胞内有效物质的渗出,但是过低的料液比会加大后续浓缩过程的难度,耗时耗能,同样会造成多糖的损失。因此,选择料液比1∶30(g/mL)进行后续优化试验。
2.1.5 提取次数对猴面包树果多糖提取率的影响
固定其它参数的条件不变,考察不同提取次数对猴面包树果多糖提取率的影响,试验结果见图5。

图5 提取次数猴面包树果多糖提取率的影响Fig.5 Effect of extraction times on polysaccharide extraction rate
由图5可以看出,随着提取次数的增加,猴面包树果多糖提取率呈现出先快速升高后趋于平衡的趋势。当提取次数达到2次时,提取率有显著升高,达到42.18%,之后增加提取次数,猴面包树果多糖提取率基本趋于稳定。增加提取次数,可以利用新的提取溶剂的浓度差,促进多糖的溶出,当提取次数过多时,原料中的多糖基本提取完毕,提取率达到平衡,同时过多的提取次数耗时耗能,因此选择对猴面包树果提取2次。
2.2 提取响应面优化试验
2.2.1 试验结果及方差分析
运用Box-Behnken法,设计三因素三水平的响应面优化试验,试验设计及结果如表2所示。

表2 Box-Behnken响应面试验设计及结果Table 2 Box-Behnken experiment design and corresponding experimental values

续表2 Box-Behnken响应面试验设计及结果Continue table 2 Box-Behnken experiment design and corresponding experimental values
运用Design Expert 8.0.5数据处理软件对试验数据进行回归拟合分析,得到多糖提取率与各因素变量的二次回归方程模型:

对该回归模型进行方差分析,结果见表3。

表3 回归模型方差分析表Table 3 Table of variance analysis of regression model
由表3可知,此模型具有极显著性(p<0.01),失拟项不显著(p>0.05):另外模型的 R2=0.9705,R2Adj=0.9325,信噪比S/N=13.792,模型响应值的变异系数为2.3,小于5,可知回归方程拟合度和可信度均很高,试验误差较小,可以用此模型对猴面包树果多糖的提取工艺进行分析和预测。
通过表3方差分析结果可知,各因素对猴面包树果多糖提取率的影响大小为:料液比>提取时间>提取温度,其中料液比对多糖提取率影响极显著,提取时间对多糖提取率影响显著。
2.2.2 交互作用分析及验证试验
响应面图坡度的陡峭程度可以反应各因素对响应值的影响程度,坡度越陡峭说明各因素交互作用对响应值的影响越大[16]。对每两个因素间的交互作用进行分析,其响应面图结果见图6~图8。

图6 料液比和提取温度交互作用对多糖提取率影响的响应面图Fig.6 Response surface methodology for the effect of solid-liquid ratio and extraction temperature on the extraction rate of polysaccharide

图7 料液比和提取时间交互作用对多糖提取率影响的响应面图Fig.7 Response surface methodology for the effect of solid-liquid ratio and extraction time on the extraction rate of polysaccharide

图8 提取时间和提取温度交互作用对多糖提取率影响的响应面图Fig.8 Response surface methodology for the effect of extraction time and extraction temperature on the extraction rate of polysaccharide
由图6~图8可以看出,每两个因素间的响应面图均呈现为较明显的凸球形曲面,坡度较陡峭,同时,其在平面投影的等高线图呈现为椭圆形,说明每两因素间交互作用显著,而图8对应的等高线表现为更明显的椭圆形,说明提取时间与提取温度的交互作用对多糖提取率的影响更加显著,这与表2中对每两因素间交互作用的方差分析结果一致。
通过二次回归方程模型分析得到猴面包树果多糖提取的最佳工艺参数为:A=0.32,B=-0.16,C=-0.03,即料液比为 1∶33.2(g/mL),提取温度 68.4 ℃,提取时间1.485 h,此时猴面包树果多糖的理论提取率达到45.71%。结合实际条件对工艺条件修改为料液比1∶33(g/mL),提取温度 68 ℃,提取时间 1.5 h,超声功率342 W,提取2次,在此条件下进行验证试验,得到猴面包树果多糖的提取率为(45.03±0.76)%,与理论值相符较好。由此证明,此回归方程拟合良好,试验结果可靠。
2.3 猴面包树果多糖抗氧化性能研究
2.3.1 猴面包树果多糖对DPPH·的清除能力
按照方法1.2.6.1考察0.1 mg/mL~7.5 mg/mL质量浓度的猴面包树果多糖和0.05 mg/mL~0.4 mg/mL的VC对DPPH·的清除能力,所得试验结果如图9所示。
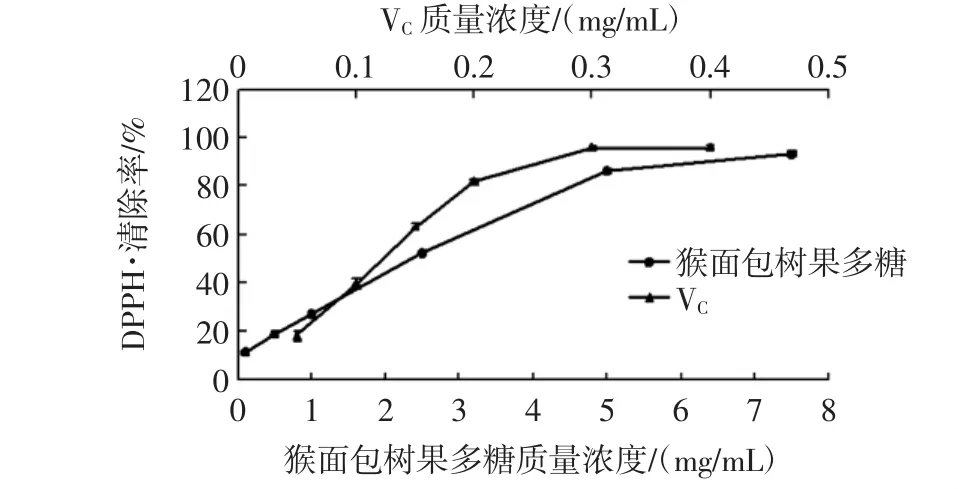
图9 不同浓度猴面包树果多糖和VC对DPPH·的清除能力Fig.9 Scavenging ability of VCand polysaccharide from baobab fruit to DPPH·
由图9可以看出,随着质量浓度的增大,猴面包树果多糖对DPPH·的清除率随之升高,在浓度大于5 mg/mL后,其对DPPH·清除率的增速减慢;VC对DPPH·的清除率与浓度整体呈正相关性,当浓度高于0.2 mg/mL时,VC对DPPH·的清除率增速减缓并趋向平衡。
考察质量浓度为0.1 mg/mL~5 mg/mL的猴面包树多糖与DPPH·清除率之间的线性关系,得到回归方程y=15.244x+11.372,其R2=0.996,线性关系良好。根据回归方程得到猴面包树果多糖对DPPH·清除的半最大效应浓度(concentration for 50%of maximal effect,EC50)值为2.53 mg/mL,用同样的方式得到 VC对DPPH·清除率的回归方程为y=429.58x-2.94,其R2=0.998,VC对 DPPH·清除的 EC50值为 0.12 mg/mL。试验结果表明猴面包树果多糖对DPPH·具有良好的清除能力,但远低于同浓度的VC对DPPH·的清除能力。
2.3.2 猴面包树果多糖对ABTS+·的清除能力
按照方法1.2.6.2考察0.5mg/mL~15mg/mL质量浓度的猴面包树果多糖和0.025 mg/mL~0.5 mg/mL的Trolox对ABTS+·的清除能力,所得试验结果如图10所示。

图10 不同浓度猴面包树果多糖和Trolox对ABTS+·的清除能力Fig.10 Scavenging ability of Trolox and polysaccharide from baobab fruit to ABTS+·
由图10可以看出,在较低浓度范围内,猴面包树果多糖对ABTS+·的清除能力随着浓度的增大而增强,当浓度高于12 mg/mL时,其对ABTS+·的清除率趋于平衡。Trolox对ABTS+·的清除能力随着浓度的增大而增强,当浓度高于0.4 mg/mL时,其对ABTS+·的清除率亦趋于平衡。
对0.5 mg/mL~7.5 mg/mL范围内的猴面包树果多糖和0.025 mg/mL~0.25 mg/mL范围内的Trolox与ABTS+·的清除率做线性回归,得到回归方程分别为y=8.871 1x+1.519 3和y=303.24x+2.398 5,其R2分别为0.997和0.998,由此得到猴面包树果多糖和Trolox对ABTS+·的EC50分别为5.5 mg/mL和0.16 mg/mL。试验结果表明猴面包树果多糖对ABTS+·具有较好的清除能力,但远低于同浓度的Trolox对ABTS+·的清除能力。
2.3.3 猴面包树果多糖的还原能力
天然产物的还原能力是反应其抗氧化性活性的一个有效指标,并且其抗氧化活性与还原力呈正相关,还原能力越强,其抗氧化活性越强[17]。按照方法1.2.6.3考察0.5 mg/mL~10 mg/mL的猴面包树果多糖和0.05 mg/mL~0.75 mg/mL的VC的还原能力,试验结果如图11所示。
反应体系在700 nm处的吸光值越大,则对应样品的还原能力越强。由图11可以看出,在所设浓度范围内,猴面包树果多糖还原能力随浓度升高而增强。VC在浓度低于0.5 mg/mL范围内呈现同样的趋势,其后增大VC的浓度,在本方法的底物浓度范围内,其还原能力达到平衡。10 mg/mL的猴面包树果多糖的还原能力和0.1 mg/mL的VC的还原能力基本一致。试验结果表明猴面包树果多糖具有良好的还原能力,从而证明了其较好的抗氧化活性。

图11 不同浓度猴面包树果多糖和VC的还原能力Fig.11 Reducing ability of polysaccharide from baobab fruit and VCin different concentrations
3 结论
探索将超声波辅助提取技术应用于猴面包树果多糖的提取中,通过单因素试验和响应面优化试验获得了超声波辅助提取猴面包树果多糖的最佳工艺条件为:料液比 1∶33.2(g/mL),提取温度 68 ℃,提取时间1.5 h,超声功率342 W,提取2次,在此条件下,多糖提取率达到(45.03±0.76)%,因此,通过响应面优化模型获得的最佳提取工艺条件,其数据可靠。
考察了猴面包树果多糖的抗氧化性能,分别通过DPPH·清除试验、ABTS+·清除试验和还原能力试验进行测定。在所设浓度范围内,猴面包树果多糖对DPPH·的清除能力与质量浓度呈正相关性,其对DPPH·的EC50为2.53 mg/mL;猴面包树果多糖对ABTS+·的清除能力随质量浓度的升高而增强,其对ABTS+·的EC50为5.5 mg/mL;猴面包树果多糖的还原能力随质量浓度升高而增强,10 mg/mL的猴面包树果多糖和0.1 mg/mL的VC的还原能力基本一致。试验结果表明猴面包树果多糖具有良好的抗氧化活性。
综上所述,本试验通过超声波辅助提取法制备猴面包树果多糖,获得了最佳提取工艺,并对多糖的抗氧化活性进行研究,证明了其良好的抗氧化性能。鉴于目前对猴面包树果多糖的研究较少,本试验结果可以为猴面包树果多糖的进一步研究及更广泛地开发利用提供数据参考。
参考文献:
[1]魏静,段琼芬,张燕平.猴面包树引种栽培及其应用前景[J].热带农业科学,2011,31(7):16-21
[2]CHADARE F J,LINNEMANN A R,HOUNHOUIGAN J D,et al.Baobab Food Products:A Review on their Composition and Nutritional Value[J].Food Science and Nutrition,2009,49(3):254-274
[3]Sidibe M,Williams J T Baobab.Adansonia digitata[M].Southampton:International Centre for Underutilised Crops,2002
[4]王颖,王国红,曾霞,等.响应面法优化荸荠多糖的提取工艺[J].食品研究与开发,2016,37(6):112-116
[5]BERTOZZI C R,KIESSLING L L.Chemical glycobiology[J].Science,2001,291:2357-2364
[6]黄晓君,聂少平,王玉婷,等.铁皮石斛多糖提取工艺优化及其成分分析[J].食品科学,2013,34(22):21-26
[7]LI J W,LIU Y F,FAN L P,et al.Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus Jujuba cv.Jinsixiaozao[J].Carbohydrate Polymers,2011,84(1):390-394
[8]刘杭达,马千苏,王傑,等.紫山药粗多糖提取工艺的优化及其抗氧化性的研究[J].食品工业科技,2015,36(23):208-213
[9]MARIITA R M,ORODHO J A,OKEMO P O,et al.Methanolic extracts of Aloe secundiflora Eng l.inhibits in vitro growth of tuberculosis and diarrhea-causing bacteria[J].Pharmacognosy Research,2011,3(2):95-99
[10]刘杰麟,章灵华,钱玉昆.枸杞多糖对S180荷瘤小鼠的免疫抑瘤作用[J].中国免疫学杂志,1996,12(2):115-117
[11]岑颖洲,王凌云,马夏军,等.羊栖菜多糖体外抗病毒作用研究[J].中国病理生理杂志,2004,20(5):765-768
[12]史大华,刘玮炜,刘永江,等.低分子量海带岩藻多糖的制备及其抗肿瘤活性研究[J].时珍国医国药,2012,23(1):53-55
[13]LU Y R,FOO Y L.Antioxidant and radical scavenging activities of polyphenols from apple pomace[J].Food Chemistry,2000,68(1):81-85
[14]RE R,PELLEQRINI N,PANNALA A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology&Medicine,1999,26(9/10):1231-1237
[15]吴峰华,杨虎清,何志平.山核桃青果皮提取物抗氧化活性研究[J].中国食品学报,2011,11(1):40-44
[16]廖素凤,陈建雄,黄志伟,等.响应曲面分析法优化葡萄籽原花青素提取工艺的研究[J].热带作物学报,2011,32(3):554-559
[17]FAN L P,LI J W,DENG K Q,et al.Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J].Carbohydrate Polymers,2012,87(2):1849-1854
