常压室温等离子体(ARTP)诱变及高通量筛选维生素B12高产菌株
2018-05-04蔡莹瀛夏苗苗董会娜张同存张大伟
蔡莹瀛 ,夏苗苗,董会娜,张同存,张大伟
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院天津工业生物技术研究所,天津 300308)
维生素 B12(又称钴胺素,VB12),是一类含有钴离子的咕啉类化合物总称,也是唯一含有金属离子的维生素.维生素 B12作为一种重要营养因子,广泛应用于饲料、食品和医药卫生等领域[1],并作为人类以及哺乳类动物自身不能合成的物质,参与体内 DNA合成与调节、维持及产生神经细胞髓鞘、促进血红细胞的生成以及促进脂肪及糖类代谢等重要的生理过程[2-3].由于维生素B12的分子结构极为复杂、化学合成十分繁琐导致效益极低,致使工业上生产维生素B12主要利用一些具有维生素 B12合成能力的真细菌发酵生产[4-5].目前,通过微生物发酵生产维生素 B12有两种常用工艺,一种是以丙酸菌(Propionibacterium)为代表的厌氧发酵工艺;另一种是以脱氮假单胞菌(Pseudomonas denitrificans)为代表的好氧发酵工艺[6-7].脱氮假单胞菌因发酵工艺简便,并且在生长过程中不产生内毒素和外毒素[8],可以安全应用于医药和食品添加剂工业等领域而备受关注,全球 80%,以上的产量来自该工艺发酵.
从头合成维生素 B12的代谢途径十分复杂,需要涉及 30余个合成基因的共同作用,并存在多条分支途径[9].因此,反馈调节机制对菌体中维生素 B12的积累具有重要作用.但到目前为止,未有详尽的代谢工程研究来阐明合成途径的调节机制,致使通过优化代谢途径的方法对菌种的定向改造困难重重.至今,诱变育种的方法仍是提高微生物生产维生素 B12能力的高效便捷手段.相对于其他较为传统的诱变技术,新型常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变育种技术在具有操作简易且条件温和的基础上,可以达到一次诱变便能获得 2万个以上突变体的大库容高效诱变[10-11],其安全高效的特点使 ARTP技术已广泛应用于获得工业发酵高产菌株[12].
高通量筛选是获得高产突变株的另一关键步骤.目前筛选维生素 B12高产菌株的方法还只局限于抗性平板筛选法等传统方法,随后采用摇瓶发酵的方法对初步选出的菌株进行大批量逐个验证并测定菌株维生素 B12的产量,采用该方法筛选诱变后的菌株会因工作量极大、发酵周期长而导致筛选效率低,无法做到高通量筛选.已有研究[13-14]证明,维生素 B12运用紫外-可见分光光度计在 278、361、550,nm 处有最大吸收,且 361,nm处吸收峰形明显,干扰因素少,可作为维生素 B12产量的检测方法,但由于发酵培养基中成分较复杂,对此种方法造成干扰,导致无法采用分光光度计法直接检测发酵液中维生素 B12的含量,只能作为粗略判断和快速检测的手段.
核糖开关(riboswitch)一般位于mRNA的非编码区(UTR),由适体结构区域(aptamer domain,AD)和表达结构区域(expression domain,EPD)两部分组成[15-16].适体区可以直接结合小分子代谢物,并能够感知代谢产物的浓度变化,具有高度亲和性以及特异性,当适体区结合代谢物后自身会发生构象变化,这个信息会传递至表达区使其形成选择性茎环结构,进而调节下游基因的表达[17].随着核糖开关的不断研究,迄今已在不同细菌中发现了 200余种维生素 B12核糖开关[18],费式丙酸菌(Propionibacterium freudenrechii)维生素 B12合成蛋白 cbiB基因 mRNA的 5'-UTR存在高度保守序列,它能够直接结合维生素B12的辅酶 5'-脱氧腺苷钴胺素(5'-deoxyadenosylcobalamin,Ado-Cbl),并抑制下游基因的表达[19].本研究利用安全高效的 ARTP育种方法,对产维生素B12的脱氮假单胞菌进行诱变育种,随后配合微孔板培养发酵以及核糖开关这一感应元件做到高通量筛选,并采用与酶标仪相结合的快速检测方法,建立高通量筛选高产维生素 B12突变体的流程,获得了稳定高产维生素B12的突变株.
1 材料与方法
1.1 菌株与质粒
维生素 B12生产菌株脱氮假单胞菌(P.denitrificans)PA320、低产维生素 B12菌株脱氮假单胞菌 PA320-L、无维生素 B12生产能力菌株脱氮假单胞菌 PA320-Z、大肠杆菌(E.coli)DH5α、费式丙酸菌(P.freudenreichii)及所用大肠杆菌-脱氮假单胞菌穿梭质粒pBHR1(耐卡那霉素)、pBBR1MCS-A(耐氨苄青霉素)均为本实验室保存.
1.2 培养基
平板培养基(g/L):玉米浆 50,葡萄糖 20,(NH4)2,SO42.0,K2HPO48.0,琼脂 20;pH 7.0~7.2.
种子培养基(g/L):玉米浆 50,葡萄糖 20,CoCl2·6H2O 0.15,(NH4)2SO42.0,K2HPO48.0;pH 7.0~7.2.
发酵培养基(g/L):玉米浆 50,葡萄糖 20,CoCl2·6H2O 0.15 ,ZnSO4·7H2O 0.1 ,DMBI 0.1 ,(NH4)2SO42.0,K2HPO48.0;pH 7.0~7.2.
补料培养基(g/L):葡萄糖 120,CoCl2·6H2O 0.3,DMBI 0.3.
1.3 试剂与仪器
限制性内切酶,Thermo Fisher Scientific公司;DNA聚合酶PrimerSTAR Mix,Takara公司;2×Taq PCR MasterMix,北京天根生化科技有限公司;氰钴胺素,Sigma公司;基因 组DNA提取试剂盒(DP302-02)、质粒小提试剂盒(D6943-02)、胶回收试剂盒和柱式 PCR产物纯化试剂盒(D6492-02),OMEGA公司,由金唯智公司进行引物合成和测序;亚硝酸钠、乙腈、冰醋酸、异丙醇等化学试剂均为国产分析纯.
ARTP型常压室温等离子体诱变育种仪,北京思清源生物科技有限公司;Spectra Max M5型连续波长多功能酶标仪,美国 Molecular Devices公司;2WY-2112B型恒温培养振荡器,上海智城分析仪器有限公司;Agilent 1260型高效液相色谱分析仪,安捷伦科技有限公司;5810R型台式高速离心机,德国Eppendorf公司;SW-CJ-2FD型超净工作台,苏净集团苏州安泰空气技术有限公司;PTC-1148型 PCR仪,美国 Bio-Rad公司;V-1600型可见分光光度计,上海美谱达仪器有限公司.
1.4 实验方法
1.4.1 基因克隆与构建表达菌株
提取费式丙酸菌(P.freudenrechii)基因组总DNA为模板,使用Ribo-F(TGTACTAGGGTCAATG TGCTGG)和Ribo-R(CTCGGACAAGAACCTCAAA TCCACG)为引物 PCR扩增出基因组上 213,bp的Riboswitch片段,与已扩增出的 5'端包含 20~30,bp重叠末端的LacI片段(使用引物lacI-F:CGTGGATT TGAGGTTCTTGTCC GTGAAACCAGTAACGTTAT ACGAT,lacI-R:TGAATCCGTAATCATGGTCAT AGC扩增,划线处为同源片段)运用Overlap PCR技术扩增出两者相连接的 DNA多聚体,并与表达载体pBHR1运用 Gibson assembly技术连接[20],转化入E.coli DH5α感受态中,得到重组质粒 pBHR1-r(P)-lacI后送阳性克隆到公司测序,另一重组质粒也以上述方法构建.均构建完成后将两重组质粒按照三亲本转化法转入脱氮假单胞菌(P.denitrificans)中.
1.4.2 ARTP诱变条件的确立
样品制备:将脱氮假单胞菌(P.denitrificans)PA320于固体培养基上活化,置于30,℃ 恒温培养箱培养 48,h.待长出单菌落后,挑取单菌落接种于含5,mL种子培养基的试管中培养至对数中期(A600=2.0),取1,mL菌液,用无菌生理盐水冲洗2次,再用2,mL含 10%,甘油的无菌生理盐水重悬,取 10,µL处理好的样品准备进行ARTP诱变.
照射剂量的确定:取10,µL上述处理好的菌体均匀涂布在已经灭菌的载片上,将 ARTP诱变仪器的功率设置为100,W,使载片与射流出口的距离设置为4,mm,气体流量为 10,L/min.选择照射时间分别为0、15、30、60、90、120,s.将上述经过等离子诱变体照射过的带有菌体的载片迅速放入装有 1,mL 的生理盐水中,涡旋振荡 1,min.取已经振荡的菌液稀释涂平板,放入 30,℃恒温培养箱中培养 2,d.经上述条件培养后,计数各平板上单菌落个数,取 3次平均值,绘制出致死率曲线.
1.4.3 高通量筛选模型建立
为了高效并快速筛选到高产维生素 B12的突变菌株,建立核糖开关高通量筛选方法与 48孔板通量发酵相结合的筛选方法(图1).将ARTP诱变后的菌液混合培养,取200,µL菌液用无菌PBS冲洗3次后重悬稀释至 106,mL-1,所制得的样品采用流式细胞仪分选荧光值较高的前 1%,的细胞,为保证存活率将每3个单菌分选至48孔板的1个孔中发酵培养6,d,取发酵液进行处理后检测其361,nm下吸光度以判断维生素B12的产量,最后通过摇瓶发酵并采用HPLC检测初筛得到的突变菌株维生素B12产量.
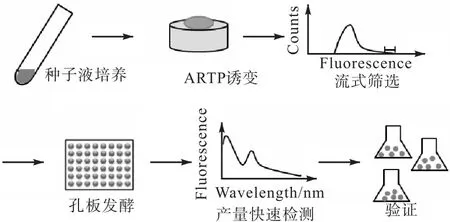
图1 脱氮假单胞菌ARTP诱变筛选流程Fig. 1 ARTP mutagenesis and screening process of Pseudomonas denitrifican
1.4.4 菌种培养及发酵条件
固体培养基配制:按照培养基配方中平板培养基的成分,配制固体培养基,每个平板所需培养基约为30,mL,待平板凝固以后置于4,℃冰箱备用.
菌种培养:将保藏好的甘油管菌种蘸取少量菌液涂布于固体培养基上,置于 30,℃恒温培养箱培养48,h.待长出单菌落之后,挑取单菌落接种于含30,mL种子培养基的 250,mL三角瓶中,30,℃振荡(220,r/min)培养 36,h.将种子培养基按 10%,比例接种至含30,mL发酵培养基的250,mL三角瓶中. 30,℃振荡(220,r/min)培养,分别于72、48、120,h加补料培养基 3,mL,继续培养 144,h后收集菌体并检测维生素B12产量.
1.4.5 突变株遗传稳定性分析
在固体培养基平板上活化筛选出高产维生素B12的菌株,将其转移到液体种子培养基中进行一级种子液培养,并连续转移数次,再进行摇瓶发酵,比较突变株产维生素B12能力的稳定性.
1.5 维生素B12含量的测定方法
1.5.1 标准品的制备
精确称取1,mg 标准品溶解于1,mL超纯水中制备成母液,逐渐稀释为 0.001、0.005、0.01、0.05、0.1、0.2,g/L的样品.
1.5.2 分光光度计法
分别将上述稀释不同倍数的标准品进行处理,并测定其波长 361,nm 下的吸光度,绘制维生素 B12质量浓度标准曲线,根据此曲线(y=0.016,5,x+0.166,6,R2=0.987,3)和稀释倍数即可计算出发酵液中维生素B12质量浓度.
1.5.3 HPLC测定法
发酵液预处理:吸取 发酵液 10,mL,加入 2.5,mL 8%,亚硝酸钠溶液和冰醋酸2.5,mL,混匀后置于 95~100,℃水浴反应 30,min,冷却至室温后用水定容至50,mL,10,000,r/min离心 1,min后取上清液,并用0.22,μm 微孔滤膜过滤.取滤液 1,mL,加入 2%,氰化钠溶液 20,µL,置 35~40,℃恒温反应 1,h,使被测样品中不同形式的钴胺素均转化为氰钴胺,最终取20,µL用于HPLC测定其含量.
HPLC检测条件:C18-250A色谱柱(4.6,mm×250,mm,5,µm),流动相Ⅰ为 KH2PO4溶液(50,mmol/L,pH 3.0),流动相Ⅱ为乙腈.洗脱条件:0~5,min,10%,乙腈恒速洗脱;5~15,min,10%,~20%,乙腈梯度洗脱;15~20,min,20%,乙腈恒速洗脱.吸收波长为 361,nm,柱温为 35,℃,流量0.8,mL/min,进样量 20,µL.
2 结果与分析
2.1 核糖开关实用性的验证
维生素 B12浓度依赖的核糖开关 cbiB是一种抑制型的核糖开关,当维生素 B12浓度逐渐升高时,与其相连的下游基因表达受到抑制作用,因此该核糖开关下游绿色荧光蛋白(green fluorescent protein,GFP)报告基因的表达强度会随维生素 B12浓度的升高而降低,这样不利于筛选方法的建立.为解决此问题,设计核糖开关PF-cbiB双质粒筛选元件的构建,如图2所示.将其与编码阻遏蛋白的 lacI基因相结合,即不存在代谢产物维生素 B12时,核糖开关形成抗终止子,表达下游阻遏蛋白的基因lacI、lacI与lacO结合后,GFP报告基因无法表达;存在代谢产物维生素B12时,核糖开关形成终止子,抑制阻遏蛋白 lacI的产生,GFP报告基因可表达(图2).
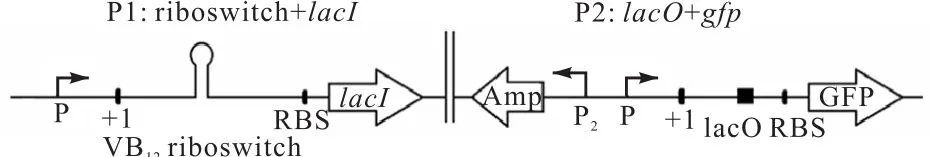
图2 核糖开关PF-cbiB双质粒筛选元件构建示意图Fig. 2 Filter components construction of the double plasmid of riboswitch PF-cbiB
将上述所构建的质粒共同转入不同产量的菌株中,在荧光显微镜下可直观观察荧光报告基因表达情况的差异性(图 3).由图 3可知:无维生素 B12生成的菌株 PA320-Z在荧光显微镜下极少数单菌落呈现极其微弱的荧光强度,其他菌落均无荧光强度检出;低产维生素 B12的菌株 PA320-L及高产维生素 B12的菌株 PA320在荧光显微镜下,荧光强度呈现随维生素 B12浓度的升高,荧光强度明显上升的趋势.结果表明优化后的维生素B12筛选元可满足维生素B12与荧光强度成正比的需求.
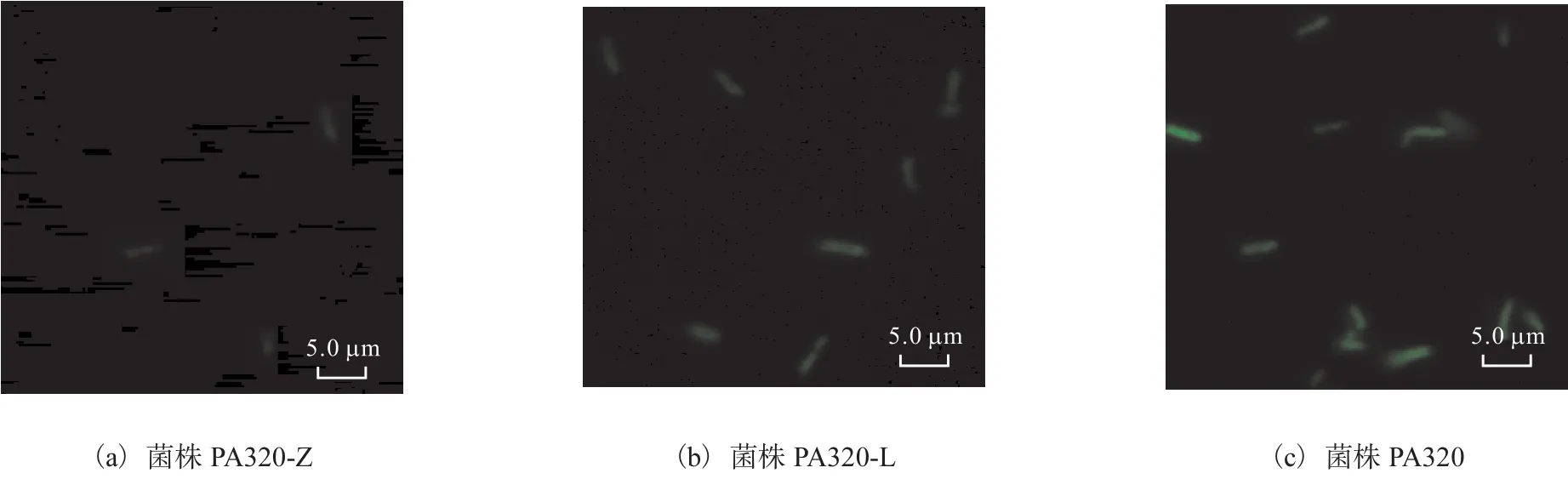
图3 不同产量菌株的荧光强度Fig. 3 Fluorescence intensity of strains of different yield
运用模拟筛选实验的条件进一步验证维生素B12筛选元件实用性.按同吸光度比例对 3菌株的发酵菌进行稀释,并采用流式细胞仪分选前 1%,的混菌,所分选的结果用 Summit 5.2软件分析,其中高产菌株PA320占混菌的81.6%,(图4),结果表明此筛选元件筛选阳性率较高,可作为诱变后高通量筛选的方法,将含有此元件的诱变出发菌株命名为 PA320-Mybi.
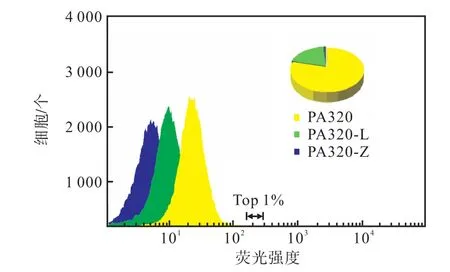
图4 流式细胞仪验证核糖开关PF-cbiB的可用性Fig. 4 Availability of riboswitch PF-cbiB verified by flow cytometry
2.2 ARTP诱变致死率曲线的测定
采用平板活菌计数的方法,按照 1.4.2节对脱氮假单胞菌的致死率进行测定,结果如图 5所示,ARTP处理 30,s脱氮假单胞菌致死率达到 80%,,处理60,s后致死率稳定在85%,左右,当处理时间120,s时,致死率接近100%,,故选取ARTP处理时间75,s,致死率90%,左右作为后续处理的条件.
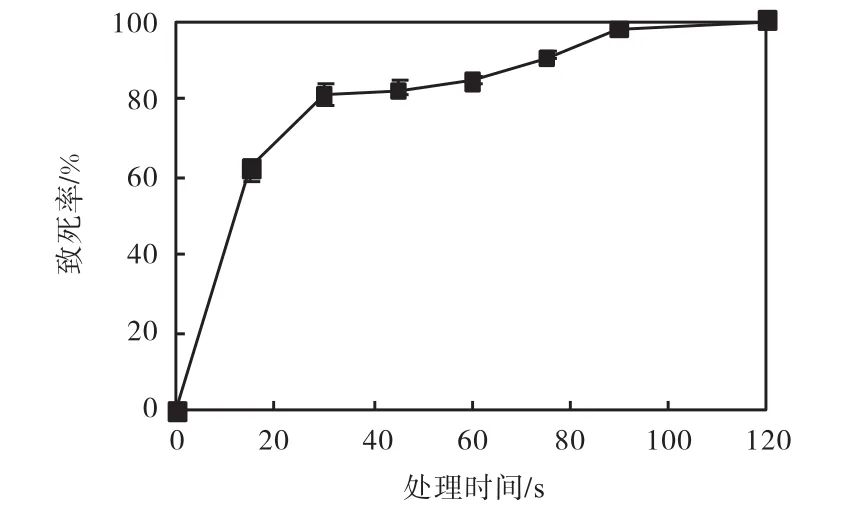
图5 脱氮假单胞菌的ARTP致死率曲线Fig. 5 ARTP lethal rate curve of P. denitrificans
2.3 装液量、培养基对突变株发酵的影响
本实验发现单独采用种子培养基或发酵培养基进行 48孔板发酵时,当装液量为 1.0,mL、培养温度30,℃、400,r/min的条件下,培养6,d后通过HPLC测量维生素B12产量为20~30,mg/L,发酵产量较低的情况下会造成孔板产量不能准确反映菌株生产性能的情况.分析造成此情况的原因可能是:首先,在发酵产维生素 B12过程中,脱氮假单胞菌对氧的需求量较大,48孔板容量体积较小,导致在转速固定的情况下,孔板装液量成为影响溶氧的较大因素;其次,在培养基的选择上也尤为关键,若单独采用种子培养基进行发酵,虽菌种生长速度快,但会导致后期营养成分不足而造成产量偏低的情况,而单独采用发酵培养基发酵,会导致菌种生长较为缓慢的情况.因此,对48孔板发酵装液量和培养基进行优化,以提高孔板发酵的筛选的可靠性,结果如图6所示.
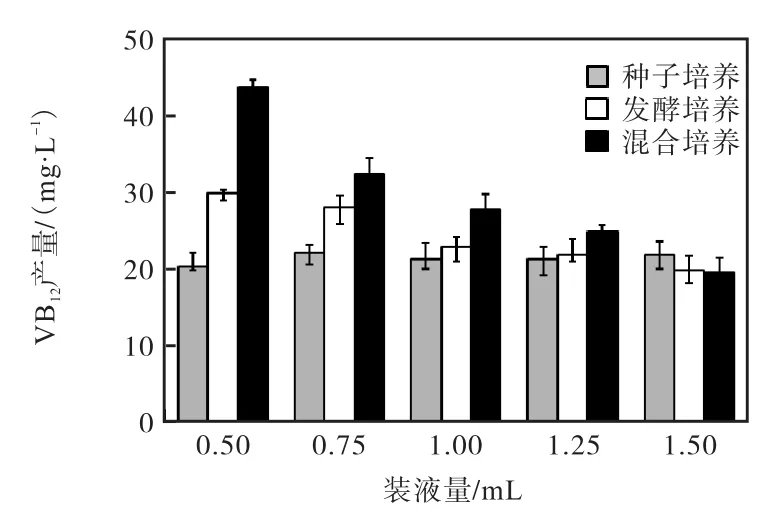
图6 培养基和装液量对菌株 48孔板维生素 B12产量的影响Fig. 6 Influence of medium and its volume on VB12yield in 48 deep-well microliters plate
由图 6可知:装液量和培养基种类对 48孔板中维生素B12的产量有极显著影响,装液量为0.50,mL,采用混合培养基培养对维生素 B12产量提高最显著,培养6,d产量可达(44.98±1.20)mg/L,分别是在同样装液量的情况下单独采用种子培养基(维生素 B12产量为 21.45,mg/L)的 2.09倍及同条件下单独采用发酵培养基(维生素 B12产量为 23.05,mg/L)的 1.95倍.经条件优化后的发酵条件为:混合培养基发酵培养,孔板装液量为 0.50,mL,培养温度为 30,℃,转速为400,r/min,培养时间为6,d.
为证明优化发酵条件后突变株在48孔板发酵与摇瓶发酵之间的相关性,挑选在 361,nm 下呈现不同吸光度的30个诱变后单菌落进行48孔板发酵,同时将这30个单菌落按照1.4.4方法进行摇瓶发酵,并分别测定维生素 B12的产量,对测得的数值进行回归方程分析(图 7),所得结果为本实验建立的高通量筛选方法的可靠性作验证.
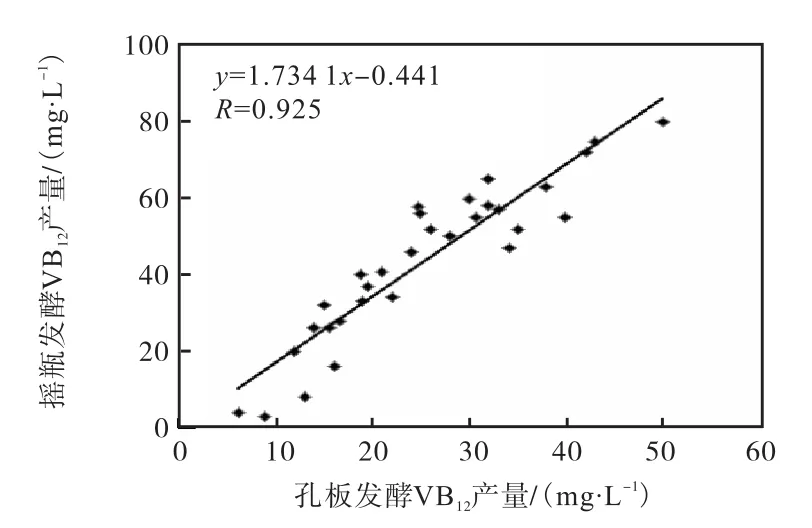
图7 48孔板发酵与250,mL摇瓶发酵的相关性Fig. 7 Correlation between fermentation in 48,microliters plate and fermentation in 250,mL flask
2.4 突变育种筛选结果
2.4.1 诱变突变株的初筛
取48孔板培养6,d的发酵液按照 1.4.3方法进行处理,检测其 361,nm 下吸光度来筛选高产维生素B12的突变菌株,并将快速检测后筛选得到的突变菌株发酵液按照HPLC方法检测其维生素B12产量.经1.4.3方法对初始菌株PA320进行4轮ARTP诱变筛选,结果如图8所示.初筛得到6株维生素B12相对产量提高 20%,以上的突变株,对这 6株突变株(4-1B1、4-1D1、4-1D3、4-2E5、4-2F3 和 4-2H2)进行后续验证实验.
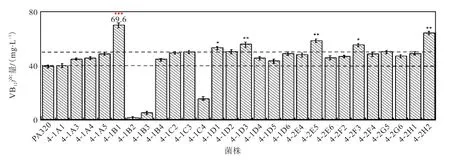
图8 ARTP诱变筛选菌株48孔板发酵维生素B12产量Fig. 8 VB12 concentration of 48 microliters plate fermentation mutants obtained through ARTP treatments
2.4.2 诱变突变株的复筛
取出发菌株及通过初筛得到的 6株突变菌株进行 250,mL摇瓶发酵验证,30,℃、220,r/min发酵培养,并采用 HPLC检测菌株发酵 144,h后维生素B12产量,如图9所示.在ARTP诱变及高通量筛选得到的 6株突变株中,3株(4-1D1、4-2E5和 4-1B1)相对产量提高了 20%,,且 PA320-M4-1B1突变株维生素B12产量高达(103.2±2.1)mg/L,较初始菌株 PA320的维生素B12产量(71.9±1.8)mg/L提高了43.8%.对维生素 B12产量提高 20%,以上的 3株突变株进行后续遗传性状测定实验.
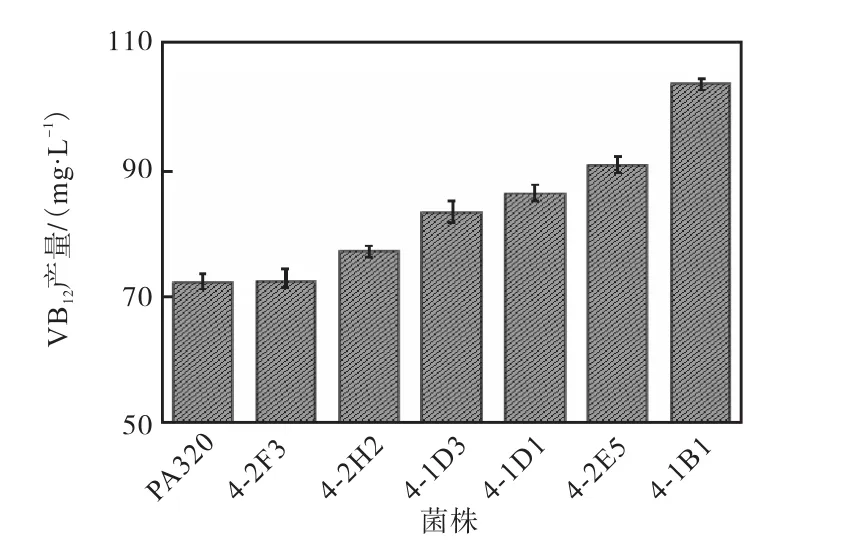
图9 初筛所得突变菌株摇瓶发酵验证Fig. 9 Shake flask fermentation validation of screening of mutant strains
2.4.3 遗传稳定性分析
对筛选所得高产突变株进行遗传稳定性检验,将突变株4-1D1、4-2E5和4-1B1进行8代连续传代培养,并检测 1、2、4、6、8代摇瓶发酵液的维生素 B12产量,测定结果见表 2.由表 2可知:随传代次数的增加,菌株生产维生素 B12的能力无明显变化,直至经8次传代后也较为稳定.结果表明本研究经ARTP诱变获得的高产突变株具有较好的遗传稳定性.
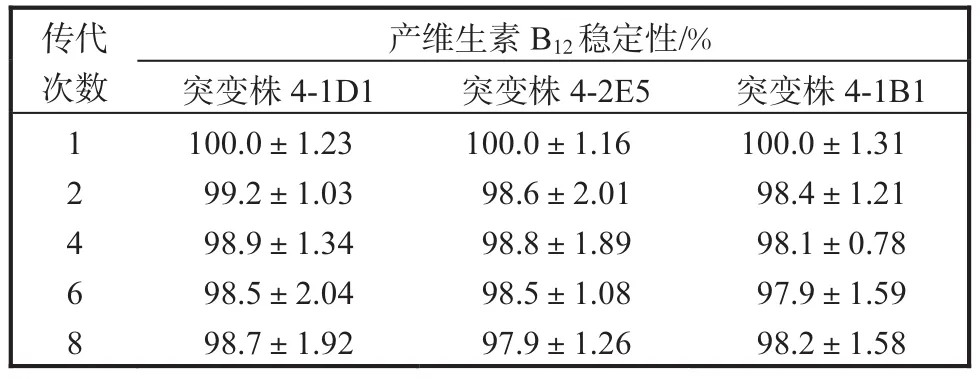
表2 突变株的遗传稳定性分析Tab. 2 Analysis of the genetic stability of the mutant strains
3 结 论
ARTP诱变系统能够快速高效的诱变维生素B12生产菌株脱氮假单胞菌(P.denitrificans),而且突变效果良好.利用核糖开关作为感应元件结合流式细胞仪高通量分选诱变后特征菌株,48孔板培养发酵后维生素B12分光光度计法在361,nm下吸光度为指标快速检测初筛菌株的维生素 B12产量,建立一套完整高效的高通量筛选方法.通过 4轮 ARTP诱变及筛选,获得了4-1D1、4-2E5和4-1B1这3株突变株,维生素B12产量均提高20%,以上且遗传性能稳定,其中PA320-M4-1B1在250,mL摇瓶发酵6,d的条件下维生素 B12产量达到(103.2±2.1)mg/L,较初始菌株PA320的维生素 B12产量(71.9±1.8)mg/L提高了43.8%,.此方法的建立也为今后研究维生素 B12以及其他维生素家族的高通量筛选提供了参考.
参考文献:
[1] Survase S A B I,Singhal R S. Biotechnological production of vitamins[J]. Food Technology & Biotechnology,2006,44(3):381-396.
[2] Escalante-Semerena J C. Conversion of cobinamide into adenosylcobamide in bacteria and archaea[J]. Journal of Bacteriology,2007,189(13):4555-4560.
[3] Gulati S,Lawrence C,Banerjee R. Posttranscriptional regulation of mammalian methionine synthase by B12[J].Biochemical and Biophysical Research Communications,1999,259(2):436-442.
[4] Marsh E N,Patterson D P,Li L. Adenosyl radical reagent and catalyst in enzyme reactions[J]. Chembiochem:A European Journal of Chemical Biology,2010,11(5):604-621.
[5] Toraya T. Cobalamin-dependent dehydratases and a deaminase:Radical catalysis and reactivating chaperones[J]. Archives of Biochemistry and Biophysics,2014,544(15):40-57.
[6] Wang P,Zhang Z,Jiao Y,et al. Improved propionic acid and 5,6-dimethylbenzimidazole control strategy for vitamin B12,fermentation by Propionibacterium freudenreichii[J]. Journal of Biotechnology,2015,193(10):123-129.
[7] Martens J H,Barg H,Warren M J,et al. Microbial production of vitamin B12[J]. Applied Microbiology & Biotechnology,2002,58(3):275-285.
[8] Marteau P,Salminen S. Demonstration of safety of probiotics[J]. Demonstration of Nutritional Functionality of Probiotic Foods Newsletter,1997,2:3-8.
[9] Raux E,Schubert H L,Warren M J. Biosynthesis of cobalamin(vitamin B12):Bacterial conundrum[J]. Cellular and Molecular Life Sciences,2000,57(13):1880-1893.
[10] Zong H,Zhan Y,Li X,et al. A new mutation breeding method for Streptomyces albulus by an atmospheric and room temperature plasma[J]. African Journal of Microbiology Research,2012,6(2):3154-3158.
[11] Zhang X,Zhang X,Li H,et al. Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J]. Applied Microbiology and Biotechnology,2014,98(12):5387-5396.
[12] Li X,Liu R,Li J,et al. Enhanced arachidonic acid production from Mortierella alpina combining atmospheric and room temperature plasma(ARTP)and diethyl sulfate treatments[J]. Bioresource Technology,2015,177:134-140.
[13] 靳月琴,郭丽敏,宋建荣. 紫外可见分光光度法测定维生素 B12含量[J]. 长治医学院学报,2007,21(4):251-253.
[14] Yuan C,Xu Q,Yuan S. A quantitative structurereactivity study of mono-basic organophosphorus acids in cobalt and nickel extraction[J]. Solvent Extraction and Ion Exchange,1988,6(3):393-416.
[15] Winkler W C,Breaker R R. Genetic control by metabolite-binding riboswitches[J]. Chembiochem:A European Journal of Chemical Biology,2003,4(10):1024-1032.
[16] Breaker R R. Riboswitches and the RNA world[J]. Cold Spring Harbor Perspectives in Biology,2012,4(2):a003566.
[17] Montange R K,Batey R T. Riboswitches:Emerging themes in RNA structure and function[J]. Annual Review of Biophysics,2008,37(10):117-133.
[18] Vitreschak A G,Rodionov D A,Mironov A A,et al.Regulation of the vitamin B12metabolism and transport in bacteria by a conserved RNA structural element[J].RNA,2003,9(9):1084-1097.
[19] Fowler C C,Brown E D,Li L. A FACS-based approach to engineering artificial riboswitches[J]. Chembiochem:A European Journal of Chemical Biology,2008,9(12):1906-1911.
[20] Gibson D G,Young L,Chuang R Y,et al. Enzymatic assembly of DNA molecules up to several hundred kilobases[J]. Nature Methods,2009,6(5):343-345.
