帕金森病伴认知障碍患者血尿酸的变化及相关因素分析
2018-05-04王庆广杜春艳韩伯军洪珊珊刘定华
王庆广, 杜春艳, 韩伯军, 洪珊珊, 刘定华
江阴市人民医院神经内科,江阴 214400
帕金森病是一种主要发生于中老年群体的神经系统疾病,发病年龄多大于60岁,临床以动作缓慢、手脚或身体其他部位静止性震颤、肌张力增高等运动功能障碍为主要表现,可伴有认知障碍,严重影响其生活质量[1]。目前对于帕金森病的病因尚不清楚,而对于帕金森病合并认知障碍的发生机制也尚在研究中。随着临床研究的不断深入,临床发现帕金森病患者的血尿酸水平明显低于正常人,因此有学者认为血尿酸可能参与帕金森病伴认知障碍的发生机制[2]。本研究以我院帕金森病伴认知障碍患者为研究对象,对其血尿酸水平变化及相关因素进行分析,为后续研究奠定基础。
1 资料与方法
1.1 一般资料 选择我院2014年1月至2016年12月收治的60例帕金森病患者作为帕金森病组。患者入院后均经相关检查,结合患者的临床资料、病史、体征等确诊为帕金森病。排除合并有痴呆,精神疾病史,严重的心、肝、肾功能障碍,恶性肿瘤及内分泌代谢性疾病者,排除经影像学检查证实脑血管病、外伤、进行性上行性麻痹、多系统萎缩以及皮质基底节病变等所致的帕金森综合征者。另选择同期来我院体检的健康人60例,作为健康组。帕金森病组中,男性35例,女性25例;年龄58~85岁,平均年龄(72.0±5.0)岁。健康组中,男性34例,女性26例,年龄56~84岁,平均(71.5±5.5)岁。两组性别、年龄、病程、教育水平、情绪、夜间认知水平等差异无统计学意义,具有可比性。本研究经医院伦理委员会审核批准,患者及家属知情同意并签署知情同意书。
1.2 评估方法 收集帕金森病组患者的一般临床资料,包括年龄、性别、病史、受教育程度等,并进行Hoehn&Yahr帕金森病严重度分级(H-Y)评估、蒙特利尔认知评估量表(MoCA)评估、简易精神状态检查(MMSE)以及韦氏记忆、智力量表评估。抽取帕金森病患者和健康人的清晨空腹静脉血5 mL,使用迈瑞BS-800全自动生化分析仪,通过酶比色测定两组的血尿酸水平;另留取两组的清晨空腹尿,采用免疫比浊法检测两组的微量白蛋白水平。
1.3 评价指标 根据患者的运动功能障碍程度进行H-Y评估[3]:1级为仅有单侧肢体症状;1.5级为单侧肢体合并有躯干症状;2级为双侧肢体症状,未发生平衡障碍;2.5级为轻度的双侧肢体症状,可通过后拉测试恢复;3级为双侧肢体有轻度症状,姿势不稳,功能受限,无法从后拉测试恢复,可自理;4级为重度残疾,在无帮助情况下可站立和行走;5级为严重症状,无法自理,需卧床或坐轮椅。其中,H-Y不超过3级为帕金森病早期(不包括3级),3~5级为帕金森病中晚期。
在韦氏记忆、智力量表评估中,至少1项认知功能低于年龄和文化匹配对照的1.5个标准差以上,为帕金森病认知障碍诊断的客观证据。MoCA从视结构技能、抽象思维、计算、定向力、执行功能、记忆、语言、集中与注意方面进行评价,测验成绩与文化水平密切相关,分值为0~30分,其中高中以下文化水平者测试结果≥26分为正常、15~25为认知障碍[4]。本次评估结果由我院2名5年以上临床工作经验的神经内科医师共同完成。

2 结 果
2.1 帕金森病组与健康组血尿酸和微量白蛋白含量比较 帕金森病组血尿酸水平低于健康组[(258.0±55.6)μmol/Lvs(328.6±50.8) μmol/L],差异有统计学意义(P<0.05);帕金森病组与健康组尿微量白蛋白水平差异无统计学意义[(16.6±6.0) μmol/Lvs(15.6±7.8) μmol/L]。
2.2 帕金森病组中不同分期血尿酸和微量白蛋白含量比较 帕金森病早期与帕金森病中晚期的微量白蛋白水平[(265.5±53.0)μmol/Lvs(255.3±56.5) μmol/L]和血尿酸[(16.5±6.0) μmol/Lvs(16.4±5.8) μmol/L]差异无统计学意义。
2.3 帕金森病组认知障碍者血尿酸及微量白蛋白含量比较 结果(表1)表明:帕金森病合并与未合并认知障碍者的血尿酸水平均低于健康组,帕金森病合并认知障碍者的血尿酸水平低于未合并认知障碍者,差异均有统计学意义(P<0.05)。3组患者微量白蛋白水平差异无统计学意义。
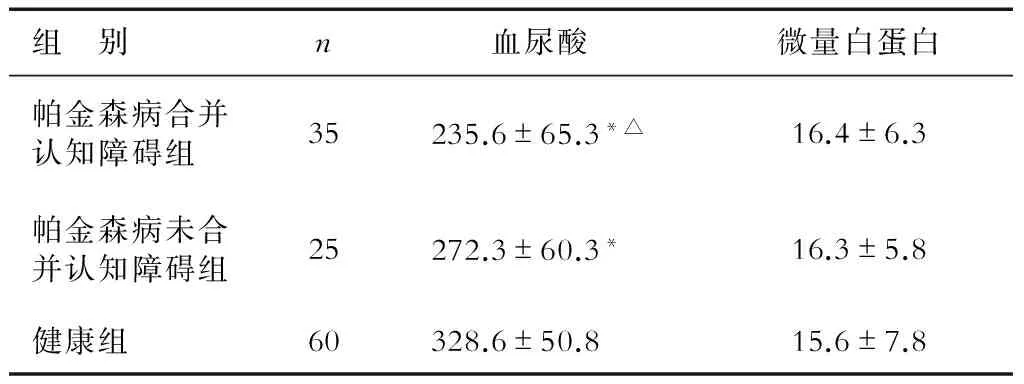
表1 帕金森病有无认知障碍者血尿酸和微量白蛋白含量比较 zB/(μmol·L-1)
*P<0.05与健康组相比;△P<0.05与帕金森病未合并认知障碍组相比
2.4 帕金森病患者认识功能障碍影响因素分析 以MoCA评分为因变量,以年龄、性别、受教育年限、病程、H-Y分级和血尿酸水平等因素为自变量,进行回归分析。结果(表2)显示:患者受教育年限、病程、H-Y分级、血尿酸水平与患者的MoCA评分明显相关(P<0.05);年龄、性别与MoCA评分无明显相关性。
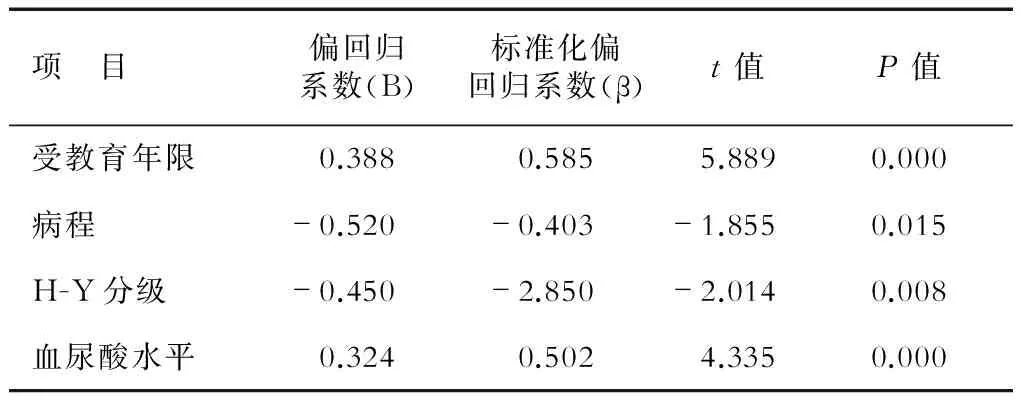
表2 帕金森病患者认识功能障碍影响因素的逐步多重线性回归分析
3 讨 论
帕金森病的具体发病因素目前尚不清楚,以往临床研究多认为与年龄、遗传易感因素、氧化应激及环境因素等有关[5]。研究[6]已证实,帕金森病的病理改变为中脑黑质多巴胺能神经元变性与坏死,纹状体DNA含量大量减少,残存的黑质神经元细胞出现嗜酸性包涵体(路易小体);除多巴胺能系统外,帕金森病患者胆碱能神经元、去甲肾上腺素能神经元、5-羟色胺能神经元等非多巴胺神经元均发生改变。该病的发病较隐匿,病情进展较缓慢,以活动笨拙以及单侧肢体震颤为首发症状,进而累及对侧肢体,逐渐出现运动迟缓、静止性震颤、肌肉强直等运动症状。近年来,随着帕金森病发病率逐渐增高,临床医师发现抑郁、睡眠障碍、便秘、认知障碍成为帕金森病患者的主诉症状之一,对患者生活质量的影响甚至超过运动症状,其中,认知障碍是帕金森病患者最常见的伴发症状[7]。
对于帕金森病伴发认知障碍的发病机制目前尚不清楚,各种学说争论不一,其中认可度最高的为氧化应激学说[8]。该学说认为机体内正常细胞在生长与凋亡过程中会不断产生自由基,导致脂肪过氧化,造成蛋白质和DNA过氧化损伤。机体在正常情况下可通过过氧化防御系统清除大量的自由基,避免脑组织发生过氧化损伤;而当机体氧化与过氧化系统失衡时,无法有效地清除自由基,逐渐造成多巴胺及非多巴胺神经元变性与死亡,从而导致帕金森病伴认知障碍。
尿酸是人体内嘌呤类化合物和核糖核苷酸氧化分解的最终产物,经肾脏、肠道和胆道排出体外。尿酸能够通过与铁离子螯合,清除体内的自由基,抑制体内的氧化应激水平,从起到保护神经元的作用[9]。研究[10-11]证实,帕金森病伴认知障碍患者的尿酸水平明显低于健康人,说明帕金森病患者体内抗氧化系统受损,导致尿酸因消耗增加而减少。本研究中,帕金森病组尿酸水平明显低于健康组,与上述研究一致。本研究中,帕金森病早期与中晚期患者的尿酸水平差异无统计学意义,而伴认知障碍者尿酸水平明显低于不伴有认知障碍者,且均低于健康组,提示血尿酸与帕金森病情的严重程度无关,而与患者的认知障碍有关。这可能与尿酸水平低,抗自由基作用减弱,加重了神经元的损伤程度有关[12]。经逐步多重线性回归分析发现,帕金森病患者的受教育年限、病程、H-Y分级、血尿酸水平是导致患者认知障碍的危险因素,其中受教育年限、血尿酸水平与患者的MoCA评分正相关,病程、H-Y分级与患者的MoCA评分负相关,进一步提示尿酸水平降低是导致帕金森病患者发生认知障碍的重要因素。
本研究中,帕金森病患者尿液中的微量白蛋白水平与健康组差异无统计学意义,且帕金森病不同分期患者间的微量白蛋白水平差异也无统计学意义,说明微量白蛋白与帕金森病的发生无明显相关性。研究[13-15]显示,帕金森病患者中,血尿酸水平偏高时可伴有微量白蛋白升高。而微量白蛋白是经人体肾脏排泄的少量白蛋白,肾功能受损情况下排泄可增加,可作为尿酸水平改变早期影响肾功能的指标。因此,监测微量白蛋白有助于对帕金森病伴轻度认知障碍患者血尿酸水平的调整,从而延缓患者的病情,改善预后。
综上所述,血尿酸可能参与帕金森病的发生,且与帕金森病患者发生认知障碍有一定关系,通过对低血尿酸水平的帕金森病患者及时采取干预措施,可延缓患者的认知障碍,改善患者的生活质量。
[ 1 ] DAVIS A A, RACETTE B. Parkinson disease and cognitive impairment: Five new things[J]. Neurol Clin Pract, 2016,6(5):452-458.
[ 2 ] AARSLAND D, CREESE B, POLITIS M, et al. Cognitive decline in Parkinson disease[J]. Nat Rev Neurol, 2017,13(4):217-231.
[ 3 ] 刘婷婷, 宋立友, 李宏岩, 等. 帕金森病伴认知功能障碍与血尿酸、同型半胱氨酸相关性的研究进展[J]. 国际老年医学杂志, 2014,35(6):276-279.
[ 4 ] 陶陈娟, 李 圆, 王小川, 等. 帕金森病患者血尿酸、谷胱甘肽水平与认知功能的相关性研究[J]. 全科医学临床与教育, 2017,15(1):14-16,20.
[ 5 ] DELGADO-ALVARADO M, GAGO B, NAVALPOTRO-GOMEZ I, et al. Biomarkers for dementia and mild cognitive impairment in Parkinson’s disease[J]. Mov Disord, 2016,31(6):861-881.
[ 6 ] DOMINGOS J M, GODINHO C, DEAN J, et al. Cognitive impairment in fall-related studies in Parkinson’s disease[J]. J Parkinsons Dis, 2015,5(3):453-469.
[ 7 ] PRAKASH K G, BANNUR B M, CHAVAN M D, et al. Neuroanatomical changes in Parkinson’s disease in relation to cognition: an update[J]. J Adv Pharm Technol Res, 2016,7(4):123-126.
[ 8 ] DAS N R, SHARMA S S. Cognitive impairment associated with Parkinson’s disease: role of mitochondria[J]. Curr Neuropharmacol, 2016,14(6):584-592.
[ 9 ] SAMPAT R, YOUNG S, ROSEN A, et al. Potential mechanisms for low uric acid in Parkinson disease[J]. J Neural Transm (Vienna), 2016,123(4):365-370.
[10] PELLECCHIA M T, SAVASTANO R, MOCCIA M, et al. Lower serum uric acid is associated with mild cognitive impairment in early Parkinson’s disease: a 4-year follow-up study[J]. J Neural Transm (Vienna), 2016,123(12):1399-1402.
[11] PESSOA ROCHA N, REIS H J, VANDEN BERGHE P, et al. Depression and cognitive impairment in Parkinson’s disease: a role for inflammation and immunomodulation?[J]. Neuroimmunomodulation, 2014,21(2-3):88-94.
[12] MOCCIA M, PICILLO M, ERRO R, et al. Presence and progression of non-motor symptoms in relation to uric acid indenovoParkinson’s disease[J]. Eur J Neurol, 2015,22(1):93-98.
[13] 张玉虎, 甘 蓉, 聂 坤, 等. 帕金森病认知障碍与血尿酸水平的相关性分析[J]. 国际神经病学神经外科学杂志, 2013,40(3):216-219.
[14] 吴 曦,胡小吾.脑深部电刺激术治疗帕金森病的进展与展望[J].中国临床医学,2017,24(6): 833-838.
[15] 吴 曦,胡小吾.帕金森病功能神经外科发展历程及现状[J].中国临床医学,2017,24(6): 839-844.
