深在性囊性胃炎内镜下的特征性表现及治疗策略:基于单中心的回顾性研究
2018-05-04朱博群秦文政罗荣奎蔡明琰陈巍峰马丽黎徐美东周平红
朱博群, 诸 炎, 秦文政, 罗荣奎, 蔡明琰, 陈巍峰, 马丽黎, 徐美东, 周平红*
1. 复旦大学附属中山医院内镜中心,上海 200032 2. 复旦大学附属中山医院病理科,上海 200032
深在性囊性胃炎(gastritis cystica profunda, GCP)1972年由Litter等[1]首次提出,是一种罕见的良性疾病,好发于中老年男性,其特征性改变为胃小凹上皮增生、胃黏膜腺体向黏膜肌层方向生长并呈囊性扩张[1-2]。其发病原因可能为先天性腺体异位或后天性炎症刺激,如胃部手术史[1-4]、消化性溃疡、异物刺激、消化液反流[5]等,导致腺体异位、增生向黏膜下层移行。GCP可进一步发展为胃癌,因此部分学者认为GCP属于癌前病变[6-9]。该病发病率较低、病例数较少且术前诊断常不明确,目前临床尚缺乏完善的治疗指南或规范供参考。
近年来,随着内镜技术的发展,内镜下手术切除胃息肉、早期胃癌(early gastric cancer, EGC)及黏膜下肿瘤(submucosal tumor, SMT)等胃部肿块取得了显著成效,使得GCP的早期诊断和微创治疗成为了可能。因此,本研究回顾性分析了复旦大学附属中山医院内镜中心采用内镜下手术治疗的病理确诊为GCP患者的资料,初步探讨GCP内镜下的特征性表现及内镜下手术切除的有效性和安全性。
1 资料与方法
1.1 一般资料 回顾性分析2011年10月至2016年10月复旦大学附属中山医院所有胃镜治疗后病理确诊为GCP患者的病例资料,并对手术标本再次阅片。回顾患者内镜下表现、超声胃镜表现、治疗方式及术后随访,将病变类型分为:黏膜病变型、息肉样隆起型、黏膜下隆起型及黏膜肥厚、皱襞粗大型。病理诊断标准:黏膜肌层及黏膜下层见囊性扩张腺管结构则诊断为深在性囊性胃炎;在此基础上出现胃黏膜腺体癌变,病变组织局限于黏膜及黏膜下层者,则诊断为深在性囊性胃炎合并早期胃癌。
1.2 内镜检查及手术治疗 完善相关术前准备后先行胃镜检查,根据内镜下表现进行后续手术治疗方式的选择:如表现为黏膜病变型或黏膜肥厚、皱襞粗大型,则采用内镜黏膜下剥离术(endoscopic submucosal dissection, ESD),在标记病灶边缘后行黏膜下注射并环形切开病灶边缘,沿黏膜下层剥离,完整、大块切除病灶;如表现为息肉样隆起型,则采用内镜黏膜切除术(endoscopic mucosal resection, EMR),黏膜下注射后圈套器完整切除病灶,或采用内镜电切术直接利用圈套器完整切除病灶,若息肉广基且头端较大,则行ESD治疗;如表现为黏膜下隆起型,则根据病灶深度进行ESD或内镜黏膜下剜除术(endoscopic submucosal excavation, ESE),若病灶位于贲门且胃镜直视下可见,亦可采用内镜经黏膜下隧道肿瘤切除术(submucosal tunnelling endoscopic resection,STER)切除肿块。
1.3 术后随访及处理 术后定期随访,随访以复旦大学附属中山医院内镜随访报告为准,如患者术后未在我院复查,则电话随访并安排我院胃镜复查。随访截止时间:2017年10月30日。
2 结 果
2.1 GCP患者人口学特征及基线资料 40例GCP确诊患者纳入本研究,其中男性25例,女性15例,年龄21~81岁,中位年龄63岁。40例患者中2例既往因胃窦异位胰腺行内镜治疗,3例既往因胃癌行远端胃大部切除术。
2.2 GCP患者内镜下典型表现及分型 结果(图1、表1)表明:40例GCP患者中黏膜病变型13例(32.5%),息肉样隆起型8例(20%),黏膜下隆起型18例(45%),黏膜肥厚、皱襞粗大型1例(2.5%)。其中黏膜病变型又分为:黏膜扁平隆起(Ⅱa),黏膜扁平隆起伴轻度凹陷(Ⅱa+Ⅱc),黏膜轻度凹陷(Ⅱc)。病灶平均直径大小为1.5 cm(0.6~3.5 cm)。病变部位包括:贲门(25%)、胃底(17.5%)、胃体(30%)、胃角(2.5%)和胃窦(25%)。
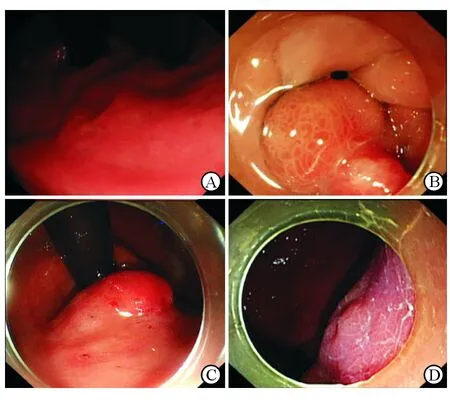
图1 GCP患者内镜下典型表现
A: 黏膜病变型(Ⅱa+Ⅱc型);B:息肉样隆起型;C:黏膜下隆起型;D:黏膜肥厚型
18例黏膜下隆起型患者中10例术前行超声内镜检查,分别表现为:黏膜下层内均匀低回声(5例)、黏膜下层内均匀无回声(1例)、黏膜下层内均匀低回声伴内部分隔或多囊样改变(2例,图2)、局部胃黏膜增厚伴黏膜下层不清(1例)、黏膜下层内不均匀高回声(1例)。根据术前超声胃镜表现,仅8例患者术前诊断为GCP。内镜表现为黏膜肥厚、皱襞粗大型患者接受诊断性ESD治疗,最终病理确诊为GCP。

表1 深在性囊性胃炎患者的内镜下表现 N=40
*1例位于胃窦近幽门处;△共39例,排除1例内镜下全层切除患者
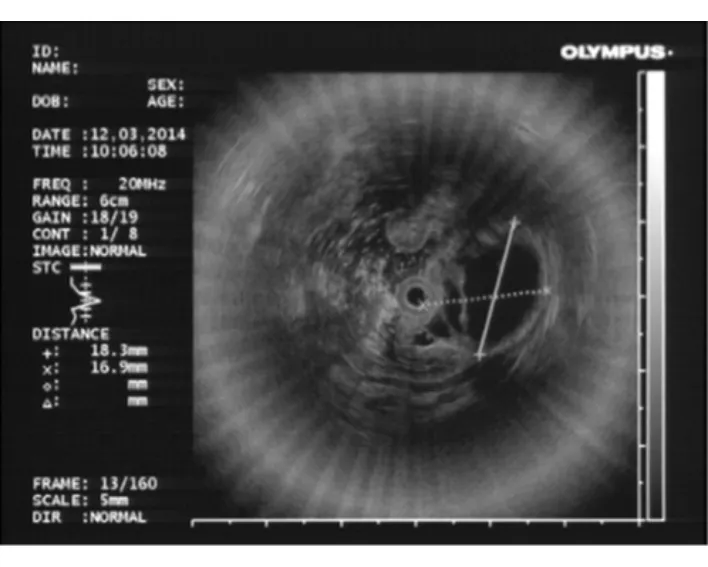
图2 黏膜下隆起型GCP患者超声胃镜表现
2.3 内镜下治疗GCP的疗效 所有内镜治疗过程均顺利完成,治疗方式以ESD为主(31%),其中33例(82.5%)病灶完整、大块切除,平均手术时间42 min(表1)。1例患者ESD术后第3天出现迟发性出血,内镜下止血后3 d顺利出院。所有患者经电话及内镜随访,术后均无复发,平均随访时间39个月。
2.4 GCP合并早期胃癌的治疗 40例患者中5例(12.5%)最终病理确诊为GCP合并早期胃癌(图3)。5例患者均为老年男性:4例表现为黏膜病变型(Ⅱa+Ⅱc),病灶位于贲门或胃体上部近贲门;1例表现为息肉样隆起型,病灶位于胃窦近幽门,均接受ESD治疗。3例黏膜病变型患者既往因胃癌行远端胃大部切除,病灶均位于贲门,因胃癌术后定期随访而发现病灶。5例患者内镜治疗均为根治性R0切除,最终病理为分化型胃癌,随访过程中均无复发(表2)。
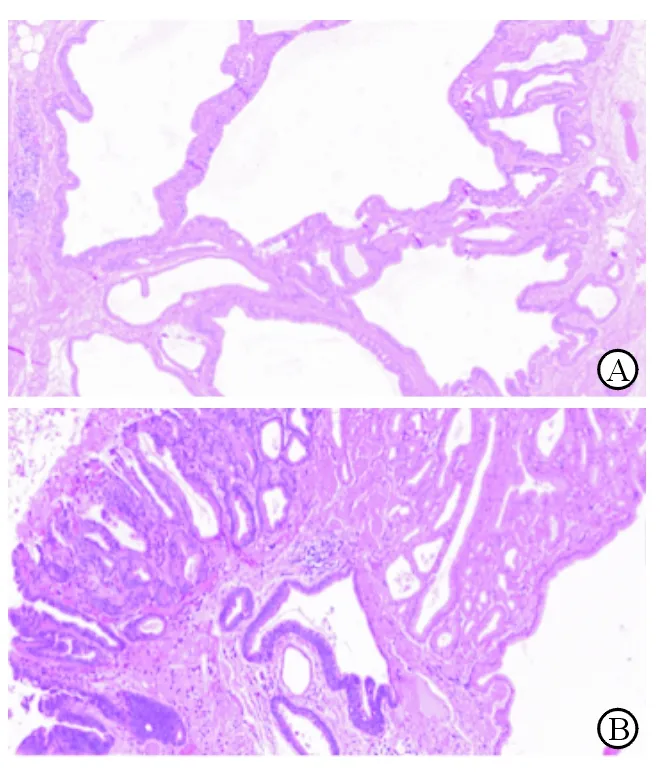
图3 深在性囊性胃炎合并早期胃癌组织H-E染色
A:深在性囊性胃炎;B:深在性囊性胃炎合并早期胃癌. Original magnification: ×50(A), ×100(B)
2.5 典型病例
2.5.1 病例1 患者男性,77岁,因“腹痛、腹胀2个月余”于2016年7月27日来我院就诊,胃镜检查提示贲门见直径约2.0 cm黏膜下隆起,表面黏膜光滑(图4A)。超声胃镜提示病灶呈无回声区,内部回声尚均匀,约1.2 cm×0.8 cm,起源于黏膜下层(图4B)。遂于2016年8月4日行STER治疗,食管下段距肿块6 cm处开窗,建立黏膜下隧道至肿块处(图4C),肿块位于黏膜下层,沿肿块边缘剥离(图4D),因肿块与表面黏膜粘连,连同黏膜完整、大块切除病灶(图4E),金属夹夹闭隧道入口及肿块表面黏膜缺损(图4F)。切除标本大小直径约1.0 cm,质地软(图4G),H-E染色可见黏膜下腺体增生及扩张,考虑深在性囊性胃炎。2017年10月1日复查胃镜示食管下段及贲门见瘢痕样改变,未见明显隆起及肿块(图4H)。

表2 深在性囊性胃炎合并早期胃癌患者的临床及病理资料 N=5
*既往远端胃大部切除史;△胃体上部近贲门
2.5.2 病例2 患者男性,71岁,10年前因胃癌行远端胃大部切除术(毕Ⅱ式),2016年3月22日随访胃镜发现贲门后壁小弯侧见1处黏膜隆起,约1 cm×1.5 cm,中央轻度凹陷(图5A、5B),表面黏膜粗糙糜烂(图5C)。活检病理提示:慢性非萎缩性胃炎,部分区域腺上皮中度异型增生。术前检查:腹部增强CT检查未见明显胃壁增厚、腹腔淋巴结肿大;甲胎蛋白: 3.7 ng/mL;癌胚抗原: 2.1 ng/mL;糖类抗原19-9: 9.7 U/mL。遂于2016年8月10日行ESD治疗(图5D~5F)。治疗过程顺利,切除标本大小4.5 cm×4.2 cm×0.6 cm(图5G),黏膜表面见2.5 cm×1.5 cm浅表隆起伴增厚。最终病理提示:贲门高分化管状腺癌,癌组织大部分位于黏膜固有层内,局灶侵犯黏膜肌层,未见溃疡形成,无脉管侵犯,水平及基底切缘未见病变累及,病变距水平切缘最近距离0.8 cm;周围胃黏膜呈深在性囊性胃炎样改变。2017年10月14日复查胃镜贲门呈瘢痕样改变,表面黏膜未见隆起及肿块(图5H)。

图4 典型GCP患者接受内镜下STER治疗
A:内镜下贲门后壁小弯侧见直径约2.0 cm黏膜下隆起;B:超声胃镜见无回声区,内部回声均匀;C:食管下段开窗后建立黏膜下隧道;D:肿块位于黏膜下层,色白、质软;E:切除肿块后隧道表面黏膜缺损;F:金属夹夹闭隧道入口;G:切除标本(黄箭头:黏膜侧;红箭头:基底侧);H:术后随访见隧道入口处瘢痕. STER:内镜经黏膜下隧道肿瘤切除术
3 讨 论
深在性囊性胃炎尚无明确发病原因,普遍认为可能是由于炎症的慢性刺激,导致黏膜肌层完整性缺失、胃腺体上皮向下生长穿过黏膜肌层移行至黏膜下层增生并呈囊性扩张形成。炎症的慢性刺激可能来源于消化性溃疡、医源性溃疡(内镜治疗后)、外科术后胆汁或小肠液的反流等[1-4]。部分深在性囊性胃炎可发生于吻合口,可能与局部胃黏膜完整性的破坏而导致胃黏膜异位有关[3-4]。本研究中12.5%(5/40)的患者存在明确的上述慢性炎症刺激病史,但本研究局限于回顾性分析,无法统计是否有更多的患者治疗前存在胆汁反流、幽门螺旋杆菌感染或EB病毒感染[10-12]。
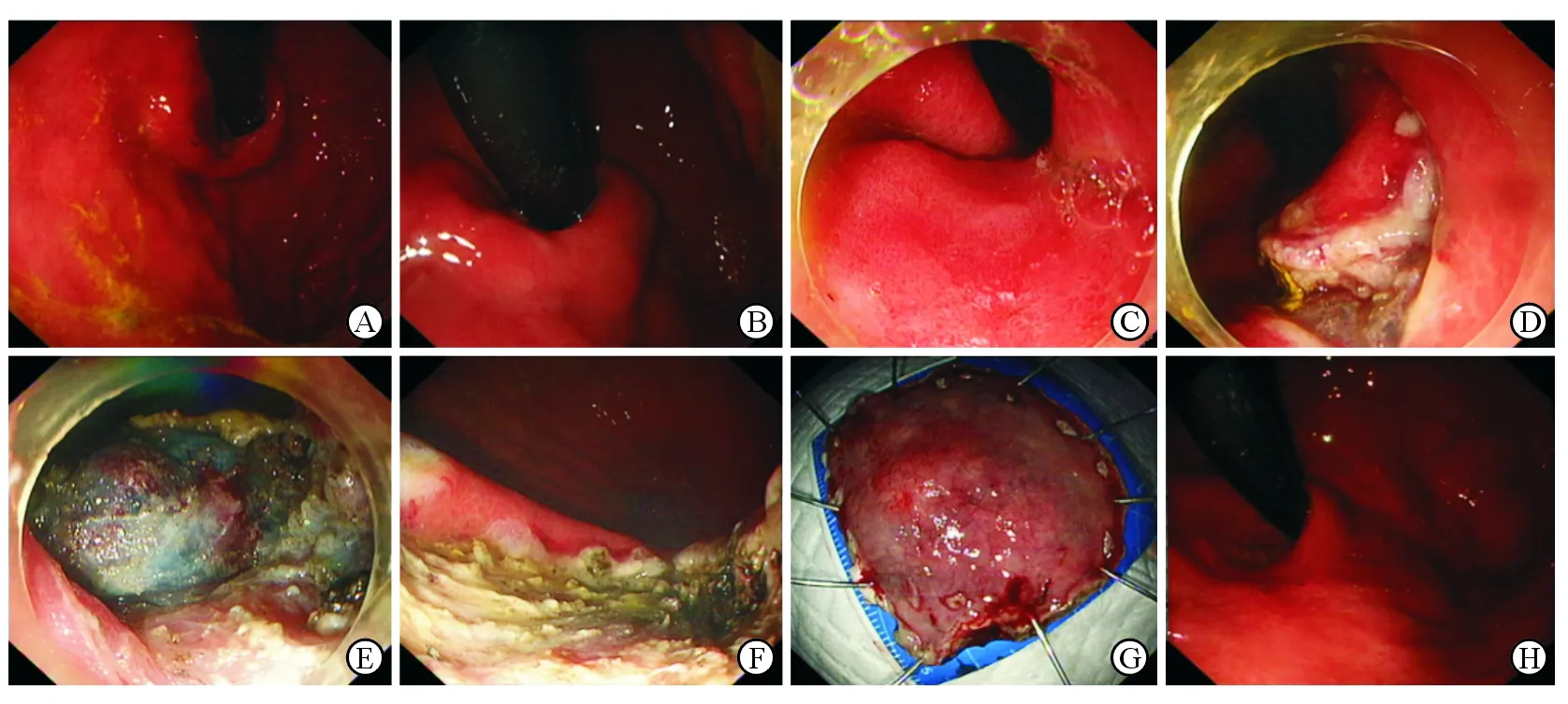
图5 典型GCP患者接受内镜下ESD治疗
A, B:内镜下贲门后壁小弯侧可见1处黏膜隆起,中央轻度凹陷;C:病灶中央凹陷处黏膜;D:病灶边缘标记、黏膜下注射、环形切开边缘后;E:剥离黏膜下层;F:内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术后创面;G:ESD标本可见中央隆起,黏膜下白色增厚区域;H:术后胃镜随访可见瘢痕形成
由于缺乏特异性临床表现和典型内镜特征,GCP术前诊断多不明确。鉴别诊断主要包括胃癌、胃间质瘤、胃平滑肌瘤、胃增生性息肉、胃淋巴瘤和巨大肥厚性胃炎等[13]。临床表现包括反酸、嗳气、恶心、呕吐、腹痛、腹胀或呕血等。内镜表现包括胃黏膜肥厚型、息肉样隆起型、胃黏膜病变型及黏膜下隆起型等。其中黏膜下隆起型(45%)为主要表现,其典型超声胃镜改变为黏膜下低回声或无回声的囊性改变[14]。本研究中黏膜下隆起型患者术前超声胃镜检查符合深在性囊性胃炎的比例为80%(8/10),但术前诊断为深在性囊性胃炎而接受治疗的比例仅为20%。此外,由于未对内镜表现为黏膜病变型、息肉样隆起型及黏膜肥厚型的病灶进行术前超声胃镜检查,无法评估超声内镜对上述病灶诊断为深在性囊性胃炎的价值。
基于术前诊断的不确定性,深在性囊性胃炎的治疗方式包括内镜治疗和外科手术。目前内镜治疗主要根据内镜下表现而决定,以ESD治疗为主(77.5%)。本研究中整块切除率为82.5%,术后除1例患者出现迟发性出血(2.5%)外均无手术相关性并发症,术后随访未见明显复发。因此对深在性囊性胃炎而言,内镜治疗尤其是ESD治疗是一种安全、有效的微创治疗方法。然而,由于本研究未对外科手术患者进行回顾性分析,无法对比内镜治疗与外科手术的疗效差异。
既往已有较多文献报道深在性囊性胃炎合并胃癌的发生[15-17]。因此,深在性囊性胃炎也被认为是一种癌前病变。本研究中12.5%的患者合并有早期胃癌,其高危因素包括老年男性、既往远端胃切除史、病灶位于贲门、内镜表现为Ⅱa+Ⅱc型等。由于未对该部分患者进行术前放大胃镜加内镜窄带成像术(NBI)观察,无法对比单纯深在性囊性胃炎、单纯早期胃癌及深在性囊性胃炎合并早期胃癌的内镜下微结构差异。与ESD治疗SM1期早期胃癌(浸润黏膜下层≤500 μm)类似,ESD同样是治疗深在性囊性胃炎合并早期胃癌的安全、有效的微创治疗手段。由于本研究为单中心回顾性研究,且仅对病理诊断为深在性囊性胃炎的患者进行再次阅片,因此无法判断是否有更多的胃癌患者合并有深在性囊性胃炎,后续有待更大样本量的研究分析。
综上所述,深在性囊性胃炎术前诊断多不明确,因深在性囊性胃炎而接受治疗的患者较少。内镜下表现主要为黏膜下隆起型,术前超声胃镜对黏膜下隆起型的深在性囊性胃炎有较高的诊断价值。在接受内镜治疗的深在性囊性胃炎中,合并早期胃癌并不罕见。老年男性、既往远端胃切除史、病灶位于贲门、内镜表现为Ⅱa+Ⅱc型可能是深在性囊性胃炎合并早期胃癌的高危因素。无论是否合并有早期胃癌,ESD治疗都是一种安全、有效的微创治疗方式。
[ 1 ] LITTLER E R, GLEIBERMANN E.Gastritis cystica polyposa. (Gastric mucosal prolapse at gastroenterostomy site, with cystic and infiltrative epithelial hyperplasia)[J].Cancer,1972,29(1):205-209.
[ 2 ] FRANZIN G, NOVELLI P. Gastritis cystica profunda[J]. Histopathology, 1981,5(5):535-547.
[ 3 ] GRIEFFEL B, ENGLEBERG M, REISS R. Multiple polypoid cystic gastritis in old gastroenteric stoma[J]. Arch Pathol, 1974,97(5):316-318.
[ 4 ] QIZILBASH A H. Gastritis cystica and carcinoma arising in old gastrojejunostomy stoma[J]. Can Med Assoc J, 1975,112(12):1432-1433.
[ 5 ] MUKAISHO K, MIWA K, KUMAGAI H, et al. Gastric carcinogenesis by duodenal reflux through gut regenerative cell lineage[J]. Dig Dis Sci, 2003,48(11):2153-2158.
[ 6 ] FRANZIN G, MUSOLA R, ZAMBONI G, et al. Gastritis cystica polyposa: a possible precancerous lesion[J]. Tumori, 1985,71(1):13-18.
[ 7 ] MITOMI H, IWABUCHI K, AMEMIYA A, et al. Immunohistochemical analysis of a case of gastritis cystica profunda associated with carcinoma development[J]. Scand J Gastroenterol, 1998,33(11):1226-1229.
[ 8 ] PARK C H, PARK J M, JUNG C K, et al. Early gastric cancer associated with gastritis cystica polyposa in the unoperated stomach treated by endoscopic submucosal dissection[J]. Gastrointest Endosc, 2009,69(6):e47-e50.
[ 9 ] KIM Y S, HEO W S, CHAE K H, et al. Clinicopathological features and differences of p53 and Ki-67 expression in adenosquamous and squamous cell carcinomas of the stomach[J].Korean J Gastroenterol,2006,47(6):425-431.
[10] KIM L,KIM J M,HUR Y S,et al.Extended gastritis cystica profunda associated with Epstein-Barr virus-positive dysplasia and carcinoma with lymphoid stroma[J].Pathol Int, 2012,62(5):351-355.
[11] CHOI M G, JEONG J Y, KIM K M, et al. Clinical significance of gastritis cystica profunda and its association with Epstein-Barr virus in gastric cancer[J].Cancer, 2012,118(21):5227-5233.
[12] WANG T C,DANGLER C A,CHEN D,et al.Synergistic interaction between hypergastrinemia and Helicobacter infection in a mouse model of gastric cancer[J].Gastroenterology, 2000,118(1):36-47.
[13] CARVALHO J R,QUADROS A C,MEIRELES L,et al. Gastritis cystica profunda mimicking a GIST-A diagnostic challenge[J].Gastroenterol Hepatol,2017.pii: S0210-5705(17)30187-5.
[14] MACHICADO J, SHROFF J, QUESADA A, et al. Gastritis cystica profunda: endoscopic ultrasound findings and review of the literature[J]. Endosc Ultrasound, 2014,3(2):131-134.
[15] 邓万银, 林 瀛, 何利平, 等. 深在性囊性胃炎合并早期胃癌的内镜诊治初步探讨[J].中华消化内镜杂志, 2015,32(9):591-594.
[16] XU G,PENG C,LI X,et al.Endoscopic resection of gastritis cystica profunda: preliminary experience with 34 patients from a single center in China[J].Gastrointest Endosc, 2015,81(6):1493-1498.
[17] OGASAWARA N,NODA H,KONDO Y,et al.A case of early gastric cancer arising from gastritis cystica profunda treated by endoscopic submucosal dissection[J].Case Rep Gastroenterol, 2014,8(3):270-275.
