心脏神经节丛刺激对急性心肌梗死后心力衰竭犬心脏功能及自主神经重构的影响*
2018-05-04胡慧慧罗达秦智亮马瑞松余小梅何勃鲁志兵李元红江洪
胡慧慧 罗达 秦智亮 马瑞松 余小梅 何勃 鲁志兵 李元红 江洪
自主神经失衡是心力衰竭(简称心衰)的重要特征之一,与心衰的发生、发展密切相关[1-3]。通过迷走神经刺激(VNS)提高副交感神经活性已被证明有助于调控自主神经平衡和改善心衰预后。既往大量的实验研究表明,VNS可抑制心衰中左室进行性扩大和改善左室收缩功能[4-5]。临床研究也证实了VNS在心衰患者中的有效性和安全性[6-8]。心房神经节丛(GP)是心脏副交感节后神经元聚集的部位,不仅可以作为迷走神经和心脏之间的中继站,而且可作为心脏内在和外在自主神经系统的“整合中心”[9]。笔者探讨低强度GP刺激对急性心肌梗死(AMI)后心衰犬心脏功能及自主神经重构的影响。
1 材料与方法
1.1动物准备 本研究所用动物由武汉大学动物实验伦理委员会审核并批准。体重18~20 kg的健康成年杂种犬18只,由武汉大学人民医院实验动物中心提供。实验动物按4∶5比例随机分为对照组(n=8)和GP刺激组(GPS组,n=10)。所有犬以苯巴比妥钠30 mg/kg静脉麻醉,实验过程中每小时补充2 mg/kg以维持麻醉状态。气管插管接动物呼吸机(ALC.V10,上海奥尔科特生物科技有限公司),给予持续正压通气。分离一侧股动脉,连接压力感受器监测动脉血压,分离一侧股静脉,置入鞘管,实验过程中用于静脉滴注生理盐水补液。持续记录体表标准肢体导联心电图。所有电生理信号和血压信号在多导电生理仪系统(Lead.7000成都锦江电子公司)上记录和分析。
1.2心肌梗死后心衰模型建立 所有犬经左侧第4肋间隙开胸暴露位于左心耳和左肺动脉之间、左上肺静脉与左房交界处的左上GP及冠状动脉前降支。结扎左冠状动脉前降支近端(发出第一对角支前)制造AMI模型[10]。左室体积增大伴左室射血分数(LVEF)<0.40定义为心衰。将自制的双极电极缝于左室游离壁,电极连接刺激器(Lead 7000,锦江公司,成都,中国)用于心室起搏(图1)。心室起搏参数为:频率180~220次/分,脉宽1.5 ms,电压为2倍起搏阈值。AMI 1 h后开始心室起搏(VP),持续6 h。

PA=肺动脉;LAD=冠状动脉左前降支;D=对角支动脉;LSPV=左上肺静脉;LIPV=左下肺静脉;LAA=左心耳;LV=左室;LSGP:左上神经节丛;LOM=Marshall韧带;Ligation Site=结扎位点;Pacing Site=起搏位点
图1心脏电极位置示意图
1.3低强度GP刺激 另一个自制的双极电极植入位于左上肺静脉与心房交界处相邻含有左上GP的脂肪垫中,电极尾端连于电刺激仪(Grass-S88,Grass Instruments,Quincy,MA)(图1)。GPS组AMI 1 h后进行GP刺激。GP刺激的参数[11]为:频率20 Hz;脉宽2 ms;刺激强度,引起窦性心率下降10%的电压强度(1.0~10 V)。低强度GP刺激持续6 h,每2 h对刺激电压进行校正以使其维持降低心率10%。对照组不给于刺激。
1.4心脏超声检查 在犬左、右侧卧位时,分别使用M4S-RS探头(频率1.5 ~3.6 MHz)获得经胸二维超声心动图。记录标准的短长轴胸骨旁切面和心尖二腔四腔切面的图像并测量左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)、收缩末期室间隔厚度(IVSS)和LVEF。GPS组分别在基础状态、AMI-1 h、VP-3 h、VP-6 h进行心脏超声检测。对照组于相应时间点检测。测量前闭合手术切口并抽取胸膜腔内空气。所有参数均在三个心动周期内测定并取平均值。
1.5血清指标测定 GPS组于基础状态、AMI-1 h、VP-2 h、VP-4 h、VP-6 h,对照组于相应时间点分别采所有犬颈静脉血注入肝素钠抗凝管摇匀,静置 10 min后以3 000 r/min 离心15 min,分离血清,-80℃冰箱保存。采用犬酶联免疫吸附(ELISA)试剂盒(美国Sigma公司),按照试剂盒说明书规范操作检测血浆去甲肾上腺素(NE)、脑钠肽(BNP)、血管紧张素Ⅱ(Ang-Ⅱ)。
1.6梗死周边区及左侧星状神经节(LSG)相关蛋白测定 在实验结束时,取左室梗死周边区新鲜心肌组织和LSG并存放在-80℃冰箱保存。采用Western Blot法检测心肌梗死周边区生长相关蛋白 43(GAP-43)、酪氨酸羟化酶(TH)以及LSG中c-fos、神经生长因子(NGF)的表达。冰冻组织制成匀浆液,取适量组织裂解液提取相应组织总蛋白,采用SDS-PAGE凝胶电泳,之后转至PVDF膜。含有抗GAPDH、GAP-43、TH、β-actin、c-fos、NGF抗体封闭液浸泡 PVDF膜, 4℃ 孵育过夜。各蛋白相应的二抗体室温孵育1 h。各蛋白质的特异性抗体的浓度均从供应商的说明书中获得。ECL显现条带。分别用GAPDH、β-actin标准化待测蛋白的表达。

2 结果
实验过程中,对照组有2只犬死于心室颤动,GPS组有1只死于心衰。所有犬制作心肌梗死后心衰模型成功。最后入组例数分别为对照组6只,GPS组9只。
2.1两组心脏超声指标比较 与基础状态相比,两组AMI-1 h、VP-3 h、VP-6 h的LVEDV、LVESV均有增加趋势,LVEF和IVSS均有减少趋势,但组内各时间点的LVEDV、LVESV、LVEF无差异(P均>0.05)。然而,GPS组VP-3 h、VP-6 h的IVSS明显高于对照组(P均<0.05)。另VP 6 h后,与对照组相比,GPS组LVEF有改善的趋势,但无差异(P=0.074)。见表1。

表1 低强度GP刺激对左室功能的影响
注:与对照组相应时间比较,*P<0.05
2.2两组血浆BNP、NE和AngⅡ水平的比较 与基础状态相比,两组AMI 1 h后血浆BNP、NE、AngⅡ均显著升高(P<0.05)。与对照组相比, GPS组VP-6 h显著抑制BNP、NE、AngⅡ水平的升高(P均<0.05),而GPS组血浆BNP、NE、AngⅡ在VP-2 h和VP-4 h无差异(P均>0.05)。见表2。
2.3两组左室梗死周围心肌组织中GAP43和TH蛋白表达 与对照组比较,GPS组心肌组织中GAP43和TH显著降低(P均<0.05)。见图2、表3。
2.4两组LSG中c-fos、NGF的蛋白表达 与对照组相比,GPS组c-fos和NGF的蛋白水平均显著降低(P均<0.05)。见图2、表3。
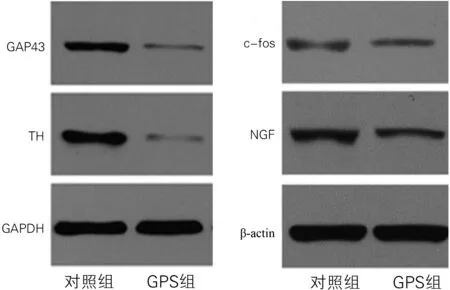
图2两组左室梗死周围心肌细胞中GAP43、TH及LSG中c-fos、NGF蛋白表达
3 讨论
本研究探讨了GPS对AMI后心衰犬心功能和自主神经的影响。结果表明,GPS可能有利于改善心脏功能,这可能与其抑制神经重塑和心脏神经内分泌系统有关。本研究采用AMI后快速心室起搏诱发心衰来模拟心衰逐渐恶化的进程,所有实验犬经过6 h起搏后LVEF均下降。
虽然两组之间的LVEF、LVEDV、LVESV无显著性差异,但在VP-6 h后显示GPS组LVEF有改善的趋势。 然而,GPS组在VP-3 h和VP-6 h的IVSS显著高于对照组,说明GPS可以改善室间隔室壁运动。这一结果提示,GPS可以缓解冠状动脉结扎造成的室间隔心肌梗死面积的快速扩张。6 h GPS对室间隔厚度的改善作用表明GPS对心脏重构有保护作用,进而可能会影响心脏功能。血浆BNP水平与左室心肌细胞重构[12]密切相关,可反映心衰严重程度。因而,血浆BNP水平的降低提示左室收缩功能的改善。在笔者的研究中,6 h GPS抑制了血浆BNP水平的增加,表明GPS可能有助于抑制急性心衰的进展。

表2 两组血浆BNP、NE和AngⅡ的水平变化
注:与同组基础状态比较,*P<0.05;与对照组相应时间点比较,#P<0.05
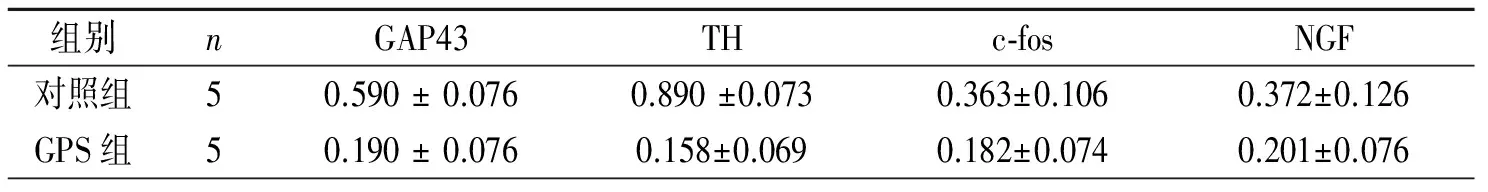
表3 两组左室梗死周围心肌组织中GAP43、TH及LSG中c-fos、NGF蛋白表达
交感神经的过度激活和肾素-血管紧张素-醛固酮系统(RAAS)的活化是心衰的病理生理的两个重要因素。心脏交感神经高度活化和心衰患者的血浆NE水平增加与左室功能不全的严重程度相关[13]。在笔者的研究中,6 h GPS显著减弱心肌梗死后快速心室起搏诱发的NE、AngⅡ水平的增加,说明GPS可以抑制交感神经活性和RASS。
心肌梗死后心肌组织以及LSG会出现神经重构。GAP43在神经发育、轴突再生及结构的可塑性中有至关重要的作用,TH可作为交感神经的标志物[14]。c-fos往往在神经元放电时表达,也被作为神经元广泛活化的标记[15]。NGF是促进神经生长的重要因子。Zhou等[16]研究表明AMI可在3.5 h内诱导局部NGF浓度立即升高,同时GAP43也在梗死区表达上调。此外,NGF和GAP43可逆行转运至LSG,从而引发非梗死区的神经生长。本研究中,6 h GPS抑制左室梗死周围区GAP43和TH的表达,同时也可抑制c-fos和NGF蛋白在LSG的表达,表明GPS可以改善心肌梗死后心肌组织和LSG 中的交感神经重构。而交感神经重构与室性心律失常、心脏猝死密切相关。 GPS抑制AMI后交感神经重构,提示其对心肌梗死后室性心律失常和心源性猝死的发生可能有一定的保护作用。
1 Porter TR,Eckberg DL,Fritsch JM,et al. Autonomic pathophysiology in heart failure patients. Sympathetic-cholinergic interrelations[J]. Journal of Clinical Investigation,1990,85(5):1 362
2 Florea VG , JN Cohn. Autonomic nervous system and heart failure[J]. Circulation Research, 2014, 114(11):1 815
3 Ishise H, Asanoi H, Ishizaka S, et al. Time course of sympathovagal imbalance and left ventricular dysfunction in conscious dogs with heart failure[J]. Journal of Applied Physiology, 1998, 84(4):1 234
4 Hamann JJ, Ruble SB, Stolen C, et al. Vagus nerve stimulation improves left ventricular function in a canine model of chronic heart failure[J]. European Journal of Heart Failure, 2013, 15(12):1 319
5 Li M, Zheng C, Sato T, et al. Vagal nerve stimulation markedly improves long-Term survival after chronic heart failure in rats[J]. Circulation, 2004, 109(1):120
6 Ferrari GMD, Crijns HJGM, Borggrefe M, et al. Chronic vagus nerve stimulation: a new and promising therapeutic approach for chronic heart failure[J]. European Heart Journal, 2011, 32(7):847
7 Premchand RK, Sharma K, Mittal S, et al. Autonomic regulation therapy via left or right cervical vagus nerve stimulation in patients with chronic heart failure: results of the ANTHEM-HF Trial[J]. Journal of Cardiac Failure, 2014, 20(11):808
8 Zannad F, De Ferrari GM, Tuinenburg AE, et al. Chronic vagal stimulation for the treatment of low ejection fraction heart failure: results of the neural cardiac therapy for heart failure (NECTAR-HF) randomized controlled trial[J]. European Heart Journal, 2015, 36(7):425
9 Hou Y, Scherlag BJ, Lin J, et al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input: effects on sinus rate, atrioventricular conduction, refractoriness, and inducibility of atrial fibrillation[J]. Journal of the American College of Cardiology, 2007, 50(1):61
10 Rossi P, Ricci A, De PR, et al. Epicardial ganglionated plexus stimulation decreases postoperative inflammatory response in humans[J]. Heart Rhythm, 2012, 9(6):943
11 He B, Lu ZB, He WB, et al. The effects of atrial ganglionated plexi stimulation on ventricular electrophysiology in a normal canine heart[J]. J Interv Card Electrophysiol, 2013, 37(1):1
12 Fertin M, Dubois E, Belliard A, et al. Usefulness of circulating biomarkers for the prediction of left ventricular remodeling after myocardial infarction[J]. American Journal of Cardiology, 2012, 110(2):277
13 Kaye DM, Lefkovits J, Jennings GL, et al. Adverse consequences of high sympathetic nervous activity in the failing human heart[J]. Journal of the American College of Cardiology, 1995, 26(5):1 257
14 Benowitz LI, Routtenberg A. GAP-43: an intrinsic determinant of neuronal development and plasticity[J]. Trends in Neurosciences, 1997, 20(2):84
15 Dragunow M, Faull R. The use of c-fos as a metabolic marker in neuronal pathway tracing[J]. Journal of Neuroscience Methods, 1989, 29(3):261
16 Zhou S, Chen LS, Miyauchi Y, et al. Mechanisms of cardiac nerve sprouting after myocardial infarction in dogs[J]. Circulation Research, 2004, 95(1):76
