黑龙江省稗草对三种玉米田常用除草剂抗药性研究
2018-05-03刘亚光唐兴佳刘蓝坤朱金文张建树
刘亚光,唐兴佳,刘蓝坤,朱金文,张建树
(1.东北农业大学农学院,哈尔滨 150030;2.浙江大学农业与生物技术学院,杭州 310029)
杂草是影响作物产量主要因素。稗草[Echino⁃chloa crusgalli(L.)Beauv]属于稗属一年生禾本科杂草,是玉米田主要恶性杂草,根系发达、再生力强,不易清除[1]。稗草密度达20株·m-2时可使玉米减产15%。为减少杂草对玉米影响,除草剂应用广泛。目前黑龙江省玉米田防除稗草常用除草剂主要有乙草胺、莠去津、烟嘧磺隆和硝磺草酮等,已连续应用多年,乙草胺、莠去津和烟嘧磺隆近年用量均保持在每年2 000 t,硝磺草酮年用量也达1 000 t。长期大量使用除草剂导致杂草抗药性增强,Giannopolitis等报道美国马里兰州稗草对莠去津产生抗性[2],加拿大和法国也在玉米田内检测到抗莠去津稗草[3-4],孙会杰等研究表明玉米田反枝苋(Amaranthus retroflexus)对莠去津抗性水平处于敏感性下降阶段[5]。张宏军等在我国东北、华北地区发现对烟嘧磺隆抗性达1 100倍的马唐(Digi⁃taria sanguinali)[6]。井秋月等报道黑龙江省部分地区稗草对烟嘧磺隆产生抗性[7]。但未见有关黑龙江省玉米田稗草对乙草胺、莠去津和硝磺草酮抗性研究。
杂草对除草剂抗性主要分为靶标抗性和非靶标抗性两大类。除草剂作用位点改变是抗性产生原因之一,Hernández等研究表明假高粱(Sorghum halepense)因ALS酶作用位点改变对烟嘧磺隆产生靶标抗性[8]。靶标酶基因表达量变化也可导致杂草产生靶标抗性,EPSPS(5-烯醇式丙酮酸莽草酸-3-磷酸合成酶)为作用靶标的草甘膦,过量5~17倍的EPSPS可对草甘膦至少增加8倍抗性[9]。很多杂草对ALS抑制剂中磺酰脲类和咪唑啉酮类、ACCase抑制剂类及二硝基苯胺类除草剂产生抗性是由于除草剂作用点改变引起,而三氮苯类、酰胺类以及取代脲类PSII抑制剂抗性产生大多涉及非靶标抗性机制。
非靶标抗性也是杂草抗性产生的重要原因,植物通过提高对除草剂轭和作用、降解作用及清除除草剂产生的有毒代谢产物解毒能力,对除草剂产生抗性,非靶标抗性大多抗性水平不高。杂草体内谷胱甘肽-S-转移酶(Glutathione-S-transfer⁃ase,GSTs)、超氧化物歧化酶(Superoxide dis⁃mutase,SOD)、过氧化物酶(Peroxidase,POD)和过氧化氢酶(Catalase,CAT)等均与杂草对除草剂解毒代谢能力有关[10]。谷胱甘肽-S-转移酶(GSTs)是植物体内主要解毒代谢酶,GSTs酶在大部分抗性杂草体内,可快速将除草剂转变成对植物无毒化合物。吴小虎等报道,谷胱甘肽(Glutathione)共轭作用可增强其解毒能力使苘麻(Abutilon theo⁃phrasti)对莠去津产生抗性[11]。稗草[12]、狗尾草[13]、黑麦草[14]、大穗看麦娘[15]除草剂抗性均由抗性生物型体内GSTs酶对除草剂解毒活性增强导致,三氮苯类除草剂重要解毒机制之一为抗性杂草体内GSTs活性和解毒能力增强[16]。Pyon等研究表明,小飞蓬(Erigeron canadensis)对草甘膦产生抗性可能是由抗氧化酶系活性提高和还原型谷胱甘肽含量升高共同导致[17]。
本研究以采自黑龙江省12个主要玉米产区稗草为试验材料,开展其对乙草胺、莠去津和硝磺草酮抗性水平测定,同时测定稗草体内SOD、POD、CAT和GSTs酶活性。旨在明确黑龙江省玉米田稗草对乙草胺、莠去津和硝磺草酮抗性水平,初步探讨稗草体内酶与稗草产生抗性关系,为进一步研究稗草抗性机制奠定基础。同时为该抗性杂草治理及黑龙江省农业“三减”政策中除草剂减量使用提供理论依据,为黑龙江省玉米高产稳产提供技术保障。
1 材料与方法
1.1 供试材料
1.1.1 供试植物
供试稗草种子采集于黑龙江省东北农业大学校内(农大)、青冈县、通河县、肇东市、五常市、鸡西市、汤原县、哈尔滨市阿城区、牡丹江市东京城镇、宾县、铁力市、齐齐哈尔(齐市)12个地区田块,将采集成熟种子带回实验室,晾干后装纸袋保存待用。
1.1.2 供试除草剂
38%莠去津悬浮剂(购自吉林金秋农药有限公司);15%硝磺草酮悬浮剂(购自吉林金秋农药有限公司);90%乙草胺乳油(购自美国孟山都公司)。
1.1.3 供试药剂
Tris-HCl缓冲液、1-氯-2,4-二硝基苯(CD⁃NB)、还原型谷胱甘肽、聚乙烯吡咯烷酮(PVP)、无水乙醇、磷酸缓冲液、甲硫氨酸(Met)、氮蓝四唑(NBT)、乙二胺四乙酸钠(EDTA-Na2)、核黄素(FD)、1%愈创木酚、氯化硫胺素焦磷酸盐(TPP)、丙酮酸钠、1-萘酚、黄素腺嘌呤二核苷酸(FAD)、NaOH、KNO3、硫酸铵、肌酸、氯化镁、石英砂、30%H2O2。
1.1.4 供试仪器
微量移液器(购自Gilson公司);离心机(购自日本日立公司);电热恒温水浴锅HWS-28(购自上海一恒科学仪器有限公司);双光束紫外可见分光光度计TU-1901(购自北京普析通用仪器有限责任公司);背负式WS-18D电动喷雾器(购自山东卫士)。
1.2 方法
1.2.1 琼脂法测定稗草对三种除草剂抗性
选取饱满、均匀稗草种子,打破休眠。在预备试验基础上,配制表1浓度梯度药液,将药液与6‰琼脂液均匀混合装入口径6.2 cm高9 cm塑料杯内,冷却备用,以不加药剂琼脂液为对照,选取长势一致且刚露白种子,于各处理琼脂表面均匀接种10粒稗草种子,3次重复。保鲜膜封住杯口保持湿润,置于(28±5)℃培养箱中培养(光照/黑暗:12 h/12 h)。处理后72 h测量芽长,计算IC50,根据IC50明确抗性生物型。

表1 琼脂法药剂浓度Table 1 Concentrations of different herbicides in agar methods (μL·L-1)
1.2.2 整株盆栽法测定稗草对三种除草剂抗性
1.2.2.1 整株盆栽法测定稗草对乙草胺和莠去津抗药性
第一步:播种。将未施用除草剂,经风干过筛后土壤装入直径14 cm塑料盆钵内,浇足底水,均匀播种10粒稗草种子,种子表面覆盖1 cm细土,置于室外培养。第二步:施药。配制如表2浓度梯度乙草胺和莠去津药液,于播种1 d后,背负式喷雾器土壤处理,设置3次重复,对照为清水处理。第三步:调查。于施药后30 d剪取地上部分,称量鲜重,计算鲜重抑制率并求出抑制中剂量值(ED50)和抗性指数。
1.2.2.2 整株盆栽法测定稗草对硝磺草酮抗药性
第一步:播种。将未施用除草剂,经风干过筛后土壤装入直径14 cm塑料盆钵内,浇足底水,均匀播种20粒稗草种子,种子表面覆盖1 cm细土;室外自然条件下培养,出苗后间苗,每桶保留10株。第二步:施药。配制如表2浓度梯度莠去津、硝磺草酮和乙草胺药液,待稗草长到3~5叶期时,背负式喷雾器喷雾处理,设置3次重复,对照为清水处理。第三步:调查。于施药后15 d剪取地上部分,称量鲜重,计算鲜重抑制率、抑制中剂量值(ED50)和抗性指数。

表2 整株盆栽法药剂浓度Table 2 Concentration of different herbicides in the whole plant method (g a.i·hm-2)
1.2.3 莠去津对不同抗性水平稗草酶活性影响
稗草对莠去津酶活性测定试验于2016年2~3月在东北农业大学农学院杂草生测实验室内完成。
1.2.3.1 供试材料准备
莠去津材料采集方法:选取宾县稗草种子,记作高抗性生物型(R),五常稗草种子记作中等抗性生物型(M),农大稗草种子记作敏感性生物型(S),将滤纸平铺于培养皿内,每个培养皿注入5 mL 0.083 mL·L-1莠去津药液,以清水为对照,并放入适量对应生物型稗草种子,置于(28±5)℃培养箱中培养(光照/黑暗:12 h/12 h),于整株盆栽法喷药前1 d、喷药后第1、3、5、7、9、11、13 d分别采样,记为0、1、3、5、7、9、11、13 d,取样后放于冰箱保存待用。
1.2.3.2 莠去津对SOD酶活性测定
超氧化物歧化酶测定参照并改进高越方法[18]。①提取酶液。取0.2 g稗草叶片放入研钵中,加入2 mL pH 7.8磷酸缓冲液研磨,匀浆倒入3 mL离心管中,于10 000 r·min-1下冷冻离心20 min,上清夜为试验用粗提液,置于0~4℃下保存待用。②测定SOD酶活性。按母液顺序配制SOD反应液,磷酸缓冲液∶Met∶NBT∶EDTA-Na2∶核黄素(FD)∶H2O比例为15∶3∶3∶3∶3∶2.5。取型号相同试管,吸取0.05 mL酶液,加入2.95 mL反应液,4 000 lx照光30 min(尽量保证照光一致);同时取4支试管,2支不加酶液,以pH 7.8磷酸缓冲液代替,其中1支置暗处,作空白;另1支作对照(CK)与酶液同置于4 000 lx条件下照光30 min,遮光保存,以空白调零,560 nm比色。③超氧化物歧化酶活性测定和计算。置暗处加入缓冲液试管作空白调零,其余管560 nm下测定吸光值,已知SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位表示。
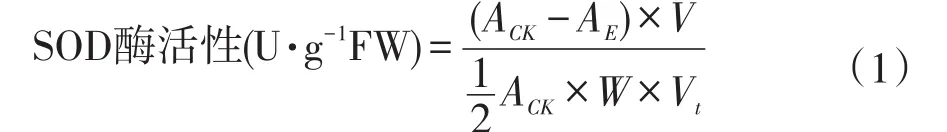
式(1)中,SOD酶活性以每克鲜重酶单位表示;ACK表示光照对照管吸光值;AE表示样品管吸光值;V表示样液总体积(mL);Vt表示测定样品用量(mL);W表示样重(g)。
1.2.3.3 莠去津对POD酶活性测定
①提取酶液。取0.2 g稗草叶片放入研钵中,加入2 mL pH 7.8磷酸缓冲液研磨,匀浆倒入3 mL离心管中,于10 000 r·min-1下冷冻离心20 min,上清夜为试验用粗提液,置于0~4℃下保存待用。②测定POD酶活性。POD酶活性测定反应:取10 mmol·L-1pH 7.0磷酸缓冲液2.2 mL,0.6 mL 1%愈创木酚,0.05 mL酶液于试管中,加入0.15 mL H2O2后反应开始,室温或37℃水浴5 min,以磷酸缓冲液代替酶液为对照调零。③过氧化物酶活性测定和计算。470 nm下每隔1 min读数1次,共读3次,以每分钟吸光度变化值表示酶活力。

式(2)中,△470为反应时间内吸光度变化;t为反应时间(min);Vs表示测定时取用酶液体积(mL);Vt表示提取酶液总体积(mL);W表示样重(g)。
1.2.3.4 莠去津对CAT酶活性测定
①提取酶液。取0.2 g稗草叶片放入研钵中,加入2 mL pH 7.8磷酸缓冲液研磨,匀浆倒入3 mL离心管中,10 000 r·min-1下冷冻离心20 min,上清夜为试验用粗提液,0~4℃下保存待用。②测定CAT酶活性。CAT酶活性测定反应:取10 mmol·L-1pH 7.0磷酸缓冲液2.865 mL和0.1 mL酶液。25℃水浴5 min后,逐管加入0.035 mL H2O2反应液,沸水浴10 min对照管调零。③过氧化氢酶活性测定和计算。每管加入H2O2反应液后计时,迅速倒入石英比色杯中,240 nm下比色,每隔1 min读数1次,共读数3次。

1.2.3.5 莠去津对谷胱甘肽-S-转移酶活性测定
谷胱甘肽-S-转移酶(GSTs)测定参照并改进Pamela等方法[19]。①提取酶液。取0.2 g稗草新鲜组织,加入3 mL pH 7.5、0.1 mol·L-1Tris-HCl缓冲液冰块上研磨,将匀浆液于4℃,12 000 r·min-1离心20 min,上清夜为试验用粗酶提取液。②测定GSTs酶活性。取0.5 mL的3 mmol·L-1还原型谷胱甘肽,加入pH 6.5磷酸缓冲液2.3 mL,再加入10 μL粗酶提取液,最后加入0.15 mL 96%无水乙醇配制的20 mmol·L-1CDNB,分光光度计测定340 nm处OD值,GSTs活性以OD340nm表示。
1.3 数据处理
1.3.1 抗性指数计算
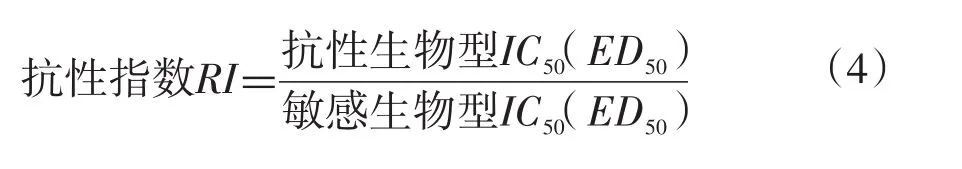
将IC50(ED50)最小稗草生物型定为敏感生物型,其他稗草生物型IC50(ED50)与之对比,根据抗性指数=抗性生物型IC50/敏感生物型IC50,计算抗性指数(RI),RI越大表示该生物型抗性越强[20]。抗性水平评价参考文献[21]。当RI<3时,处于敏感阶段;RI在3~5时,为敏感性下降阶段;RI在5~10时,处于低水平抗性阶段;RI在10~40时,为中等水平抗性阶段;RI在40~60时,处于高水平抗性阶段;RI>160时,处于极高水平抗性阶段。
1.3.2 酶活性用活性变化率表示
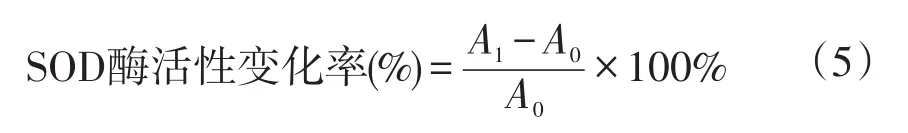
式(5)中,A1表示除草剂处理后SOD活性,A0表示清水对照SOD活性。
GSTs酶、POD酶、CAT酶活性变化率计算同SOD。
2 结果与分析
2.1 不同稗草生物型对3种除草剂抗性测定结果
利用琼脂法和整株盆栽法检测黑龙江省12个地区稗草生物型对莠去津、乙草胺和硝磺草酮抗性,各地区用不同方法测定结果及抗性指数分级如下所述。其中M代表中等水平抗性、L代表低等水平抗性、D代表敏感性下降阶段、S代表敏感阶段。
2.1.1 不同稗草生物型对莠去津抗性测定结果
由表3可知,琼脂法测定结果表明,农大生物型稗草对莠去津表现最为敏感,IC50值为536.4599 μL·L-1,以此稗草为敏感生物型,作为计算其他生物型抗性指数标准。其中宾县生物型对莠去津抗性指数为5.25,产生低等水平抗性;五常和佳木斯生物型对莠去津抗性指数分别为3.72和3.31,属于敏感性下降阶段;肇东等其他8个生物型的抗性水平均低于3,处于敏感阶段。
整株法测定结果与琼脂法基本一致,符合度达83.33%。农大生物型对莠去津表现最为敏感,因此将其作为敏感生物型,计算其他生物型抗性指数。宾县生物型抗性指数为5.01,产生低等水平抗性;鸡西和五常生物型抗性指数分别为3.40和3.23,属于敏感性下降阶段;肇东等其他8个生物型抗性水平均低于3,处于敏感阶段。
2.1.2 不同稗草生物型对硝磺草酮抗性测定结果
由表4可知,琼脂法测定结果表明,农大生物型稗草对硝磺草酮 IC50值最低为 81.8924 μL·L-1,以此IC50值作为计算其他生物型抗性指数标准,鸡西等11个稗草生物型IC50值139.5284~219.969 μL·L-1,抗性指数在1.70~2.69,均低于3,处于敏感阶段。
整株法测定结果与琼脂法一致,符合度达100%。农大生物型对莠去津表现最为敏感,因此将其作为敏感生物型,计算其他生物型抗性指数。鸡西等11个生物型抗性指数1.08~2.15,均低于3,并未对硝磺草酮产生抗性。

表3 两种测定方法稗草对莠去津抗性测定结果Table 3 Comparison of resistance of barnyardgrass to atrazine determined by two methods
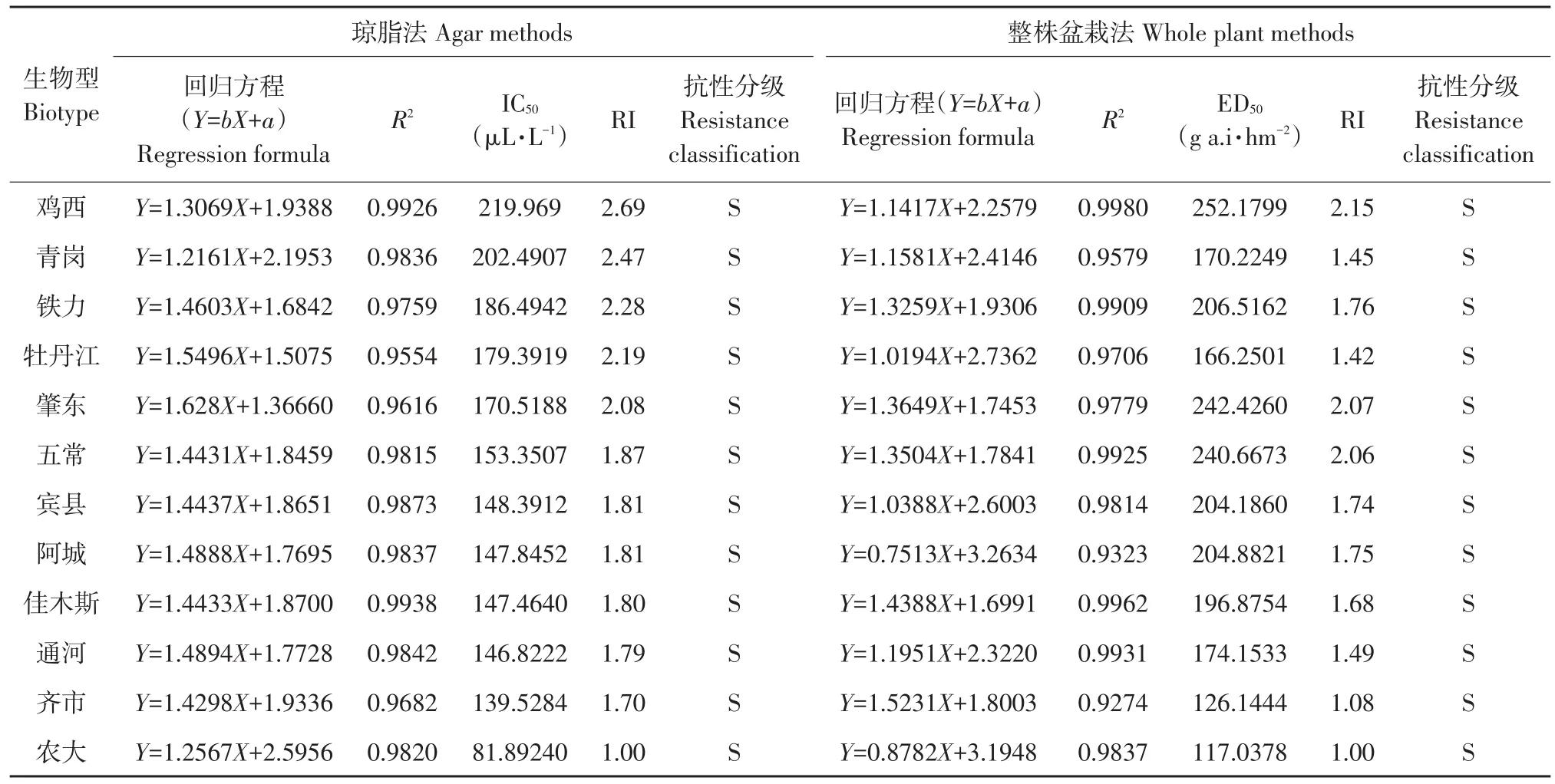
表4 两种测定方法稗草对硝磺草酮抗性测定结果Table 4 Comparison of resistance of barnyardgrass to mesotrione determined by two methods
2.1.3 不同稗草生物型对乙草胺抗性测定结果
两种测定方法稗草对乙草胺抗性测定结果见表5。由表5可知,琼脂法测定结果表明,农大生物型稗草对莠去津表现最敏感,IC50值0.1842 μL·L-1,以此稗草作为敏感生物型,作为计算其他生物型抗性指数标准。佳木斯等11个生物型抗性指数1.59~2.95,均低于3,处于敏感阶段。
整株法测定结果与琼脂法一致,符合度达100%。农大生物型对莠去津表现最为敏感,因此将其作为敏感生物型,计算其他生物型抗性指数。佳木斯等11个生物型抗性指数1.17~2.58,均低于3,并未对乙草胺产生抗性。

表5 两种测定方法稗草对乙草胺抗性测定结果Table 5 Comparison of resistance of barnyardgrass to acetochlor determined by two method
2.2 莠去津对稗草酶活性影响
2.2.1 莠去津对稗草SOD酶活性影响
同一位超声科医生检查。采用SIMENS ACUSON X-300型的彩色多普勒超声诊断仪,超声探头频率范围:7.5~12.0 MHZ。采用纵横切面探查颈动脉,观察有无动脉粥样硬化斑块。测量IMT,IMT>50%周围血管IMT,或IMT>1.5 mm且为低回声或混合回声视为存在不稳定斑块,强回声视为稳定斑块。
以施用清水和莠去津的宾县、五常和农大生物型稗草组织为研究对象,分别记作抗性生物型(R)、中等抗性生物型(M)、敏感性生物型(S),即农大(S)、五常(M)和宾县(R),研究3种不同种生物型内SOD酶变化率(见图1)。施用莠去津2 d后,SOD酶活性变化率为农大(S)>五常(M)>宾县(R),五常(M)和宾县(R)均与敏感生物型农大(S)差异显著;第3天时,五常(M)>农大(S)>宾县(R),宾县(R)与敏感生物型农大(S)差异显著,而五常(M)与敏感生物型农大(S)差异不显著;第7天时,SOD酶变化率为宾县(R)>农大(S)>五常(M),宾县(R)与五常(M)和农大(S)均差异显著。由此可见,3种生物型SOD酶活性变化率无规律,说明稗草对莠去津产生抗性与体内SOD酶活性无关。

图1 不同处理时间SOD酶活性变化Fig.1 Change of SOD activity at different treatment times
2.2.2 莠去津对稗草CAT酶活性影响
试验材料和处理方法同2.2.1,研究3种不同生物型体内CAT酶活性不同时间内变化情况(见图2)。
施用莠去津2 d后,CAT酶活性变化率为农大(S)>五常(M)>宾县(R);第3天时五常(M)>农大(S)>宾县(R);第7天时,CAT酶活性变化率为宾县(R)>农大(S)>五常(M)。第2、3和7天时,3种生物型间CAT酶活性变化率均差异显著。3种生物型CAT酶活性变化并无规律,因此稗草CAT酶活性与其对莠去津产生抗性无关。

图2 不同处理时间CAT酶活性变化Fig.2 Change of CAT enzyme activity at different treatment time
2.2.3 莠去津对稗草POD酶活性影响
试验材料和处理方法同2.2.1,研究不同稗草生物型体内POD活性变化情况(见图3)。农大(S)、五常(M)和宾县(R)3个生物型施用莠去津后11 d内,各生物型稗草体内POD活性变化率趋势均呈先升再降趋势。0~11 d农大(S)POD酶活性平均变化率为16.72%,第5天达到高峰,峰值46.51%;五常(M)POD酶活性平均变化率为31.96%,也是第5天达到高峰,峰值133.33%;宾县(R)在11 d内POD酶活性平均变化率为88.45%,第3天达到峰值234.38%,同期宾县(R)POD酶活性变化率与农大(S)间差异极显著,五常(M)与农大(S)间达差异极显著,宾县(R)与五常(M)间差异达极显著。POD酶活性平均变化率和峰值顺序均为宾县(R)>五常(M)>农大(S),可知,稗草体内POD酶活性与莠去津抗性呈正相关。
2.2.4 莠去津对稗草GSTs酶活性影响
试验材料和处理方法同2.2.1,研究不同生物型稗草体内GSTs酶活性变化情况(见图4)。
由图4可知,施用莠去津后11 d内,各生物型稗草体内GSTs活性变化率均呈先升再降趋势。0~11 d农大(S)GSTs酶活性平均变化率为17.52%,第3天达到高峰,酶活性变化率峰值为39.29%;五常(M)GSTs酶活性平均变化率为33.08%,第3天达到高峰,酶活性变化率峰值为94.29%;宾县(R)GSTs酶活性平均变化率为58.32%,于第5天达到高峰,酶活性变化率峰值为122.58%,此时宾县(R)、五常(M)和农大(S)3个生物型体内GSTs酶活性差异极显著,GSTs酶活性平均变化率和峰值顺序均为:宾县(R)>五常(M)>农大(S),由此可见稗草体内GSTs酶活性与其对莠去津抗性呈正相关。

图3 不同处理时间POD酶活性变化Fig.3 Change of POD enzyme activity at different treatment time

图4 不同处理时间GSTs活性变化Fig.4 Change of GSTs enzyme activity at different treatment time
3 讨 论
3.1 不同稗草生物型对3种除草剂抗性水平
采用琼脂法和整株盆栽法测定黑龙江省12个地区玉米田稗草生物型对莠去津、乙草胺和硝磺草酮抗性水平。检测出稗草对莠去津产生抗性,宾县生物型对莠去津产生低等水平抗性,占比8.3%;鸡西和五常生物型属于敏感性下降阶段,占比16.7%;其余生物型处于敏感阶段,占比75%;12种生物型稗草均未对乙草胺和硝磺草酮产生抗性,但黑龙江省其他地区稗草对乙草胺和硝磺草酮是否产生抗性仍不确定,需扩大检测范围方可确定。
本研究首次发现黑龙江省玉米田稗草对莠去津产生抗性。虽然抗性仅达低等水平且抗性生物型占比不高,但抗性杂草在田间具有一定适合度和竞争力,在高浓度药剂定向选择下,抗性群体将逐渐扩大,抗性水平也逐渐提高,给莠去津防除玉米田稗草带来一定风险。Gronwald等在马里兰州发现苘麻对莠去津产生10倍于敏感生物型抗性,Gray等试验结果表明,马里兰州苘麻对莠去津抗性已达敏感生物型100倍[22-23]。因此应对莠去津抗性发展给予重视,加强黑龙江省玉米田稗草抗性监测力度,逐步扩大抗性稗草生物型监测范围,及时了解抗性稗草生物型发展动态。
目前黑龙江省土壤处理剂以乙草胺、莠去津、异丙甲草胺、嗪草酮及其混剂为主[24],特别是乙莠混剂近年发展迅速,已成为玉米田苗前除草主导产品。茎叶处理除草剂中莠去津和烟嘧磺隆及烟莠混剂用量最大,吴翠霞等报道玉米田中稗草已对烟嘧磺隆产生抗性[25]。因此,生产中应减少莠去津及其混剂用量,尽量选取不同类型除草剂替换使用。封闭处理时乙草胺尽量选择与嗪草酮、异恶草酮和苯嘧磺草胺等除草剂混用,茎叶处理时可将莠去津与硝磺草酮、噻吩磺隆等除草剂混用。此外,还要结合轮作、耕作、生态等多种措施综合防控,避免化学除草主导下抗性稗草发生和蔓延。
3.2 琼脂法与整株盆栽法测定稗草对除草剂抗性符合度分析
琼脂法和整株盆栽法是目前杂草研究者广泛应用的测定杂草抗药性水平方法。琼脂法灵敏度高、操作简单;整株盆栽法中除草剂活性及使用情况类似田间,为最适宜抗性鉴定方法[26],但测定种群数量较多时工作量大,试验周期较长。
本试验采用琼脂法和整株盆栽法测定12个地区稗草生物型对三种除草剂抗性水平,通过确定两种方法符合度明确琼脂法能否代替最接近田间实际情况的整株盆栽法鉴定稗草对除草剂抗药性。结果表明,采用琼脂法和整株盆栽法对供试12个稗草生物型作抗性测定,对硝磺草酮和乙草胺抗性分级一致;对莠去津抗性分级符合度为83.33%。因此在检测稗草生物型对莠去津、乙草胺和硝磺草酮是否产生抗药性时,为确保省时省力、结果准确,可先利用更为灵敏、简便琼脂法初步测定,然后整株盆栽法进一步验证可疑稗草种群。
3.3 稗草体内酶活性与其对莠去津抗性关系
通常情况下,植物体内处于活性氧平衡状态,但植物受除草剂、干旱、低温、病、虫、盐碱及涝害逆境胁迫后,活性氧产生和清除系统平衡被打破,活性氧自由基在植物体内不断累积,对植物产生毒害作用,引起生物膜损伤。SOD、POD、CAT等酶组成植物抗氧化保护酶体系,在胁迫条件下可通过自身防御机制作出保护性应激反应,有效阻止活性氧在植物体内积累,避免生物膜受伤害[27]。
本研究中抗性生物型稗草在施用莠去津后POD酶活性升高,且与对莠去津抗性程度呈正相关。可能因施用莠去津后,稗草体内发生氧化胁迫反应产生大量有毒物质H2O2,胁迫反应产生的H2O2在植物体内主要由POD酶催化转换成H2O和无毒物质,因此POD酶活性高的生物型对莠去津抵御能力越强。李萍等研究显示,大部分谷子品种对扑草净有耐药性原因是扑草净药剂处理后谷子POD酶活性提高[28]。马鹏生报道猪殃殃对双氟磺草胺抗性可能是因为POD酶对双氟磺草胺产生一种保护机制,与SOD活性变化无明显关系[29]。毕亚玲等研究表明麦田荠菜对苯磺隆产生抗性与CAT酶活性无关[30]。宾县(R)、五常(M)、农大(S)3种生物型SOD和CAT酶活性无明显变化规律,与稗草对莠去津抗性程度无关,因此SOD和CAT酶活性与对莠去津抗性产生无关。
GSTs酶是植物体内重要代谢解毒酶,也是非靶标抗性关键酶。GSTs酶对大多数如三氮苯、氯代乙酞胺、芳氧苯氧丙酸、二苯醚等类除草剂在植物体内代谢起重要作用,GSTs酶通过缀合作用完成代谢导致除草剂失活,使杂草产生抗性[31]。Huffman等研究表明长芒苋对莠去津代谢解毒能力增强产生抗性[32],Wright等研究证实GSTs酶参与稗草对精喹禾灵非靶标抗性机制[33]。本研究中,3种生物型施药后GSTs酶活性变化趋势相同,上升后恢复初始状态。3种生物型GSTs酶活性平均变化率与峰值时酶活性均为:宾县(R)>五常(M)>农大(S),与稗草对莠去津抗性水平呈正相关。可能由于杂草体内GSTs催化自身还原型谷胱甘肽(GSH)中巯基基团对除草剂作亲核攻击,两者结合后减少除草剂形成某些中间产物造成杂草损害,GSTs酶活性越高,对除草剂抵御能力越强。王彦辉等研究表明广西省甘蔗田马唐对莠去津产生抗性是马唐体内GSTs酶活性增强导致[34]。GSTs酶活性升高可能是宾县(R)和五常(M)两种生物型稗草对莠去津产生抗性原因之一。
本研究仅从代谢抗性和抗氧化酶系活性方面初步研究抗性产生机理,但抗性产生是否涉及其他酶系作用,有待进一步研究。
4 结 论
a.本研究采用室内琼脂法与整株盆栽法检测稗草对三种除草剂抗药性,检测抗性水平结果基本一致,因此可利用琼脂法快速筛选稗草三种除草剂抗性生物型,再以整株盆栽法进一步验证。
b.黑龙江省12个地区玉米田稗草生物型中,宾县生物型对莠去津产生低水平抗性,鸡西和五常生物型属于敏感性下降阶段;12个稗草生物型均未对乙草胺和硝磺草酮产生抗性。
c.稗草体内GSTs和POD酶活性变化率与莠去津抗性呈正相关;SOD和CAT酶活性变化无规律,与莠去津抗性无关。宾县(R)和五常(M)两种生物型稗草可能对莠去津产生基于代谢能力增强的非靶标抗性。
[参考文献]
[1] 李茂生,王哲,陶波.北方农田杂草识别与防除[M].哈尔滨:黑龙江人民出版社,2003.
[2] Giannopolitis C N,Vassiliou G.Provanil tolerance in Echinochloa crusgalli(L.)Beauv[J].Tropieal Pest Manageinent,1989,35:6-7.
[3] Beckie H,Stephenson G R,Dykstra M D,et al.Agronomic prac⁃tices influencing triazine-resistant weed distribution in Ontario[J].Weed Technol,1990(4):199-207.
[4] Jacques G,Prado D R,Menendez J.Management of herbicide-re⁃sistant grass weeds in Europe[C].In Second International Weed Control Congress Copenhagen,1996:393-398.
[5] 孙会杰,纪明山,刘郁,等.玉米田杂草反枝苋对莠去津的敏感性试验研究[J].安徽农业科学,2007,35(17):5193.
[6] 张宏军,王贵启,刘学,等.马唐对烟嘧磺隆的抗药性研究[J].杂草学报,2013,31(1):34-36.
[7] 井秋月,焦梓洲,刘蓝坤,等.黑龙江省玉米田稗草和反枝苋对四种常用除草剂的抗性测定[J].作物杂志,2014(5):128-132.
[8] Hernández M J,León R,Fischer A J,et al.Target-site resistance to nicosulfuron in johnsongrass(Sorghum halepense)from chilean corn fields[J].Weed Science,2015,63(3):631-640.
[9] Gaines T A,Preston C,Leach J E,et al.Gene amplification is a mechanism for glyphosate resistance evolution[J].Proc Natl Acad Sci USA,2010,107:1029-1034.
[10] 崔海兰.播娘蒿对苯磺隆的抗性研究[D].北京:中国农业科学院,2009.
[11] 吴小虎,崔夕英,郭鹤久,等.杂草抗性的研究进展[J].现代农药,2010,9(2):13-17.
[12] Li M,Yu Q,Han H P,et al.ALS herbicide resistance mutations in Raphamis raphamstrum:Evaluation of pleiotropic effects on vegetative growth and ALS activity[J].Pest Management Science,2013,69;689-695.
[13] Hatton P J,Cummins I,Cole D J,et al.Glutathione transferases involved in herbicide detoxification in the leaves of Setaria faberi(giant foxtail)[J].Physiologia Plantarum,1999,105:9-16.
[14] Yu Q,Ahmad-Hamdani M S,Han H.Herbicide resistance-en⁃dowing ACCase gene mutations in hexaploid wild oat(Avena fatua):Insights into resistance evolution in a hexaploid species[J].Hered⁃ity(Edinb),2013,110(3):220-231.
[15] Milner L J,Reade J P,Cobb A H.Developmental changes in glu⁃tathione S-transferase activity in herbicide-resistant populations of Alopecurns myosuroides Huds(black-grass)in the field[J].Pest Management Science,2001,57(12):1100-1106.
[16] Han H,Yu Q,Owen M J,et al.Widespread occurrence of both metabolic and target-site herbicide resistance mechanisms in Lolium rigidum populations[J].Pest Management Science,2016,72(2):255-263.
[17] Pyon J Y,Piao R Z,Roh S W,et al.Differential levels of antioxi⁃dants in paraquat-resistant and-susceptible Erigeron canadensis biotypes in Korea[J].Weed Biology&Management,2004,4(2):75-80.
[18] 高越.抗草甘膦野生大豆种质挖掘及抗性机制研究[D].哈尔滨:东北农业大学,2013.
[19] Pamela J H,David D.Glutathione transferase activities and herbi⁃cide Selection in maize and associated weed species[J].Pesticide,1996,46:267-275.
[20] 杜丽娟.玉米田化学除草的药害及方法[J].农业科技通讯,2015(6):227-230.
[21] 刘亚光,李敏,李威,等.黑龙江省萤蔺对苄嘧磺隆和吡嘧磺隆抗性测定[J].东北农业大学学报,2015,46(10):29-36.
[22] Gronwald J W,Andersen R N,Yee C.Atrazine resistance in vel⁃vetleaf(Abutilon theophrasti)due to enhanced atrazine detoxifica⁃tion[J].Pesticide Biochemistry&Physiology,1989,34(2):149-163.
[23] Gray J A.Absence of herbicide cross-resistance in two atrazineresistant velvetleaf(Abutilon theophrasti)biotypes[J].Weed Sci⁃ence,1995,43(3):352-357.
[24] 赵长山,何付丽,闫春秀.黑龙江省化学除草现状及存在问题[J].东北农业大学学报,2008,39(8):136-139.
[25] 吴翠霞,张宏军,张佳,等.玉米田主要杂草对烟嘧磺隆的抗性[J].植物保护,2016,42(3):198-203.
[26] 王险峰,刘友香.水稻、大豆、玉米田杂草发生与群落演替及除草剂市场分析[J].现代化农业,2014(11):1-3.
[27] Sunohara Y,Matsumoto H.Oxidative injury induced by the herbi⁃cide quinclorac on Echinochloa oryzicola vasing,and the involve⁃ment of antioxidative ability in its highly selective action in grass species[J].Plant Science,2004,167(3):597-606.
[28] 李萍,杨小环,王宏富,等.不同谷子(Setaria italica(L.)Beauv)品种对除草剂的耐药性[J].生态学报,2009,29(2):860-868.
[29] 马鹏生.猪殃殃抗双氟磺草胺的生理机制研究[J].山东农业大学学报:自然科学版,2014(5):778-781.
[30] 毕亚玲,刘君良,王兆振,等.麦田抗性生物型荠菜对苯磺隆的抗性机制研究[J].农药学学报,2013,15(2):171-177.
[31] DeRidder B P.Induction of glutathione-S-transferases in arabi⁃dopsis by herbicide safeners[J].Plant Physiol,2002,130:1497-1505.
[32] Huffman J,Hausman N E,Hager A G,et al.Genetics and inheri⁃tance of nontarget-site resistances to atrazine and mesotrione in a waterhemp(Amaranthus tuberculatus)population from Illinois[J].Weed Science,2015,63(4):799-809.
[33] Wright A A,Nandula V K,Grier L,et al.Characterization of fenoxaprop-P-ethyl-resistant junglerice(Echinochloa colona)from Mississippi[J].Weed Science,2016,64(4):588-595.
[34] 王彦辉,杨彩英,马永林,等.广西甘蔗田马唐对莠去津抗性水平检测及机理初探[J].西南农业学报,2017,30(8):1790-1794.
