百药煎中转化鞣质生成没食子酸的最佳菌种组合筛选△
2018-05-03胡梦程玉冰张培燕刘英胡海峰
胡梦,程玉冰,张培燕,刘英,胡海峰*
(1.上海医药工业研究院,上海 200040;2.国药集团健康产业研究院有限公司,上海 201203)
百药煎是我国传统中药饮片的一种,由五倍子、茶叶和酒曲等原料经自然发酵而成,临床上多用于消化系统疾病的治疗或调理。没食子酸为百药煎的主要药效物质,由五倍子中的可水解鞣质经产单宁酶微生物转化而来[1],其具有抗肿瘤、杀锥虫、抗炎、抑菌、抗病毒、降糖和降酯等活性[2],其中百药煎的传统炮制是在自然状态下由原料中所含微生物混合发酵而成,参与发酵的菌种和数量波动性较大,且易受致病菌及有害菌的污染,生产条件不易控制,产品质量随环境变化波动较大,发酵终点凭主观经验判断,因人而异,从而影响产品的质量和稳定性,不利于百药煎工业化大规模生产[3]。为克服百药煎传统炮制的不足,本研究在前期分离并初步鉴定了百药煎传统炮制过程中微生物的基础上,剔除致病菌后以药效物质没食子酸的含量变化为筛选指标,分别考察单菌及混菌发酵组合对百药煎中鞣质转化生成没食子酸的能力,期望筛选得到协同降解鞣质生成没食子酸的最佳混菌组合。
1 仪器与材料
1.1 样品信息
百药煎传统炮制品由四川辅正药业提供,鉴定人:河南中医药大学张振凌教授。五倍子(安徽亳州沪谯中药饮片公司,批号:20160824);绿茶(中国农业科学院茶叶专业市场);酒槽(镇江酒厂);没食子酸对照品(上海勃生物工程有限公司,纯度99%以上)。样品编号C1~C8分别是在发酵时间0、6、18、24、30、42、48、66 h取样,样品经60 ℃烘干3 h,打粉过40目筛。
1.2 菌种及细胞
百药煎传统炮制过程中所分离得到的菌种,纸片法初筛得到的细菌HMB1、HMB2、HMB3、HMB5、HMB6;酵母菌HMY1、HMY2、HMY5、HMY6、HMY7;丝状真菌HMF1、HMF2、HMF3均具有降解鞣质能力,详情见文献[4]。金黄色葡萄球菌本实验室保藏。
1.3 培养基
LB培养基、PDA培养基。1#液体培养基:2% C2粉末(m·v-1),pH自然,装液量30 mL,121 ℃灭菌30 min;2#固体培养基:25% C2粉末(m·v-1),pH自然,2.5 g添加,121 ℃灭菌30 min;3#固体培养基:50%C2粉未(m·v-1),PH自然,装量5 g,121 ℃灭菌30 min。。
1.4 仪器
电子天平(上海精科天平);精密数显示酸度计(Sartorius);压力蒸汽灭菌锅(上海华线医用核子仪器有限公司);超净工作台(上海智城分析仪器制造有限公司);生化培养箱(上海一恒科学仪器有限公司);恒温培养振荡器(上海智城分析仪器制造有限公司);高效液相仪(Waters1525二元泵+2707自动进样器+2998DAD检测器);离心机Avanti J-26 XP(BECK MAN CONLTER)。
2 方法
2.1 种子液制备
细菌用LB液体,酵母菌、丝状真菌用PDA液体,在30 ℃下培养,150 r·min-1条件下培养12 h后,调整细菌、酵母菌活菌数为1×106CFU·mL-1,丝状真菌菌体量达3 mg·mL-1。
2.2 摇瓶发酵筛选
液体摇瓶培养筛选降解1#培养基中鞣质生成没食子酸能力较好的菌株及其与同类菌株和非同类菌株间协同作用较优的混菌组合。发酵摇瓶接种总量为2 mL,各菌接种比例相同,在30 ℃、150 r·min-1条件下振荡培养6 d,HPLC测定发酵液中没食子酸的量,以1#培养基为空白对照。
2.3 摇瓶筛选获得最佳混菌组合固态发酵验证
采用2#培养基进行固态发酵培养,验证筛选菌株间协同降解鞣质生成没食子酸的作用,每瓶接种总量为2 mL,不同菌株间接种比例相同,30 ℃条件下培养66 h测定发酵液中没食子酸含量。
2.4 最佳混菌组合固态发酵时间曲线测定
最佳混菌组合的菌株接种于3#培养基中,细菌接种量各为0.2 mL、酵母菌接种量各为0.4 mL,分别于发酵0、18、30、42、48、66、72 h取样测定发酵液中没食子酸和鞣质的含量。
2.5 指标检测
没食子酸标准溶液配制:用甲醇配制没食子酸,质量浓度为1.03 mg·mL-1标准品溶液。
供试液1的制备:分别精密称取百药煎炮制样品(C1~C8)粉末各0.5 g,加水30 mL,称重后浸提2 h,超声提取2次,每次30 min,补足重量过滤。取滤液1 mL过0.45 μm滤膜后测定没食子酸含量。
供试液2的制备:取20 mL供试液1,添加10 mL 12 mol·L-1浓盐酸,振荡混合均匀后,沸水浴30 min,取水解液1 mL于洁净试管中,滴加明胶液1~2滴,若无白色沉淀出现,则表明鞣质水解完全,取滤液1 mL过0.45 μm滤膜过滤后测定没食子酸含量。
可水解鞣质含量=水解后没食子酸的含量-水解前没食子酸含量[5]
(1)
没食子酸HPLC检测的色谱条件[6]:色谱柱Unitary C18(150 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸(15∶85);流速为1 mL·min-1;检测波长为273 nm;柱温为30 ℃;进样量20 μL。
2.6 样品抑菌活性测定
供试液3制备:取百药煎终样品粉末0.5 g,加水10 mL,超声提取30 min,过滤得百药煎提取液。
抑菌活性检测:LB制备金黄色葡萄球菌的菌浓约为1×106CFU菌悬液,取0.5 mL菌悬液,加至25 mL LB培养基振荡混匀倒平板。滴加20 μL样品提取液于直径为3 mm的圆形纸片上,后于37 ℃培养2 d,测量纸片周围抑菌圈直径。
3 结果与分析
3.1 百药煎传统炮制过程中没食子酸及鞣质含量变化
百药煎传统炮制过程中没食子酸和鞣质含量变化见图1。
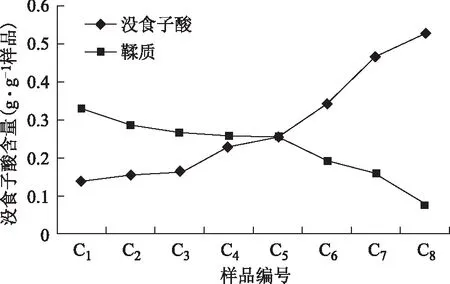
图1 百药煎传统炮制过程中没食子酸和鞣质的含量变化
由图1可知,随百药煎传统炮制时间的增加,样品中鞣质含量逐步减少,没食子酸含量逐步增加,表明百药煎中微生物逐步将鞣质转化成没食子酸。
3.2 鞣质降解菌株的筛选
通过摸索性实验发现,菌株液体摇瓶筛选过程中,随着培养时间的增加其代谢转化鞣质生长没食子酸量增多,造成培养基pH逐步降低,对菌株生长代谢影响较大,实验发现,当接种量为2 mL时,能明显缩短发酵周期至6 d。
3.2.1 单菌摇瓶筛选 分别单独于1#液体培养基中接种各菌种子液各2 mL,在30 ℃、150 r·min-1条件下发酵培养6 d,后测定发酵液中没食子酸的量,1#液体培养基为空白对照,结果见图2 。
由图2可知,单菌摇瓶培养发现,细菌HMB5、酵母菌HMY2分别是同类菌株中具转化百药煎中鞣质生成没食子酸能力最强的菌株,而各丝状真菌间能力对比差别不大。
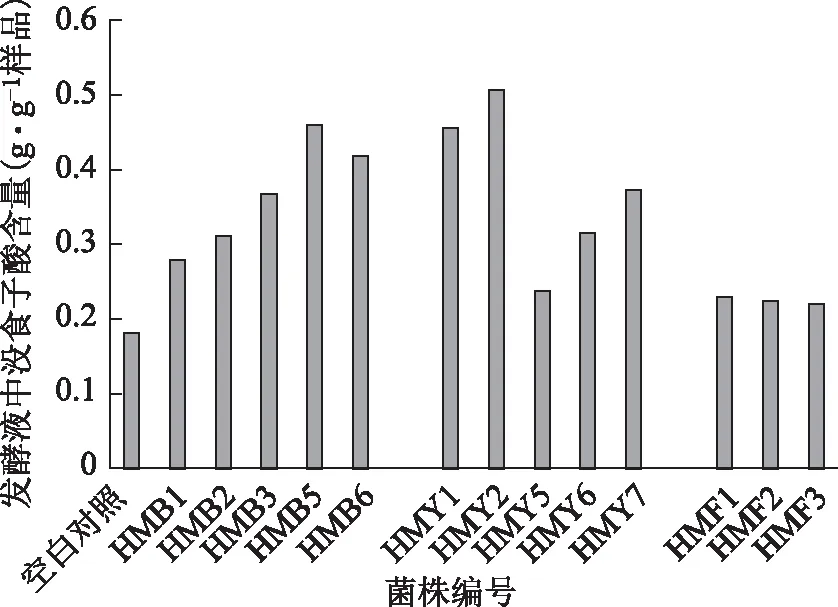
图2 单菌摇瓶培养筛选结果
3.2.2 同类菌株混合培养 分别将同类菌株中转化百药煎中鞣质生成没食子酸能力最强单菌与其他同类菌株两两组合发酵培养,接种量各为1 mL,在30 ℃、150 r·min-1,发酵培养6 d后测定没食子酸的量,以1#培养基和单菌发酵培养为对照,结果见图3。
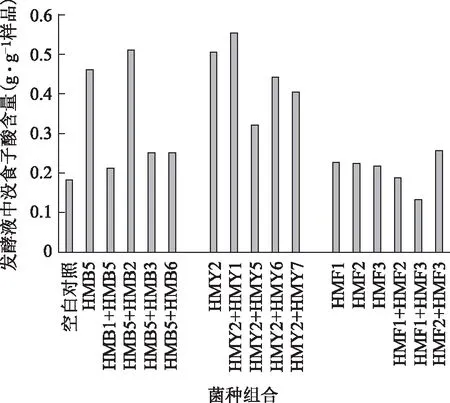
图3 同类菌株混合摇瓶培养筛选
由图3可知,摇瓶筛选发现细菌HMB2和HMB5,酵母菌HMY1和HMY2,丝状真菌HMF2和HMF3的各组合中菌株具有相互协同增强降解百药煎中鞣质生成没食子酸的作用。
3.2.3 非同类菌株间混合培养
3.2.3.1 细菌、酵母菌混合培养 将细菌组合HMB5、HMB2与酵母菌组合HMY1、HMY2间分别进行三菌和四菌组合,接种于1#液体培养基中,每瓶接种总量为2 mL,各菌接种量比例相同,在30 ℃、150 r·min-1,培养6 d后检测发酵液中没食子酸的量,以同类菌株混合发酵为对照,结果见图4。
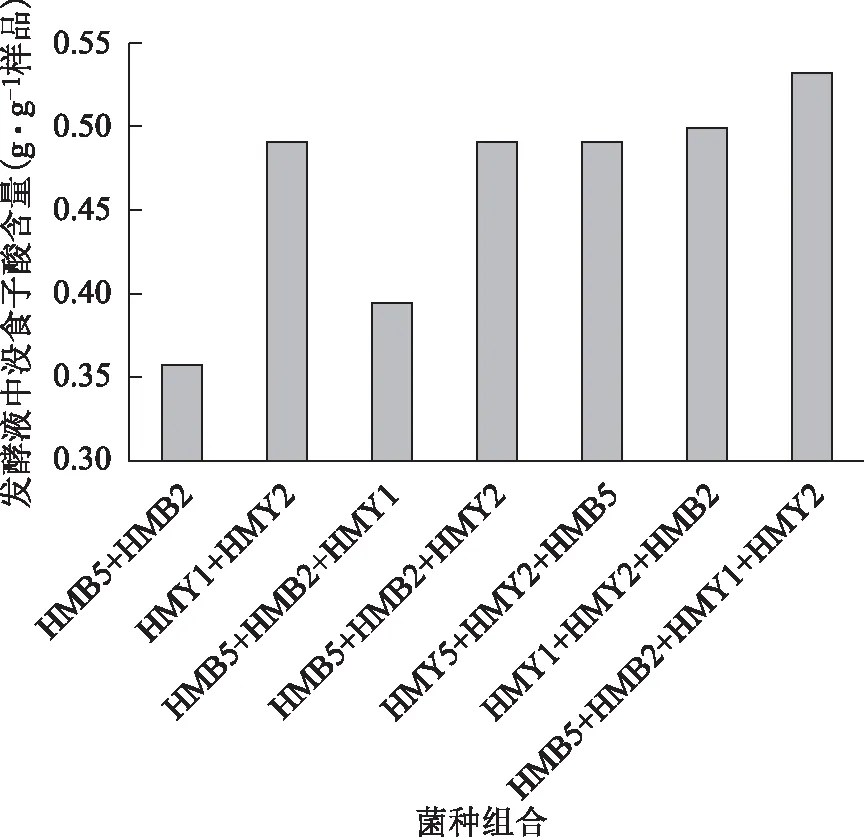
图4 细菌酵母菌混合培养结果
由图4可知,菌株HMB2、HMB5、HMY1、HMY2间具有协同增强转化百药煎鞣质成没食子酸的作用。
3.2.3.2 细菌、酵母菌、丝状真菌混合培养 分别将混菌HMB2、HMB5、HMY1、HMY2与最优丝状真菌组合HMF2、HMF3间进行组合,接种于1#培养基中,每瓶接种总量为2 mL,各菌接种量比例相同,在30 ℃、150 r·min-1,发酵培养6 d后检测发酵液中没食子酸的量,结果见图5。
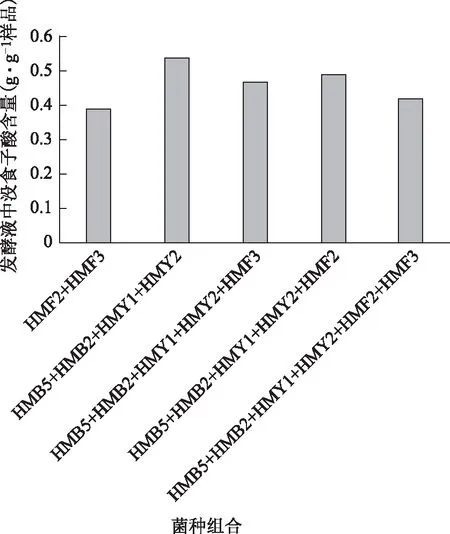
图5 最优细菌酵母菌组合与丝状真菌混合摇瓶培养
由图5可知,丝状真菌HMF2、HMF3与最优细菌酵母菌组合HMB2、HMB5、HMY1、HMY2间具有拮抗转化百药煎鞣质生成没食子酸作用。因此摇瓶发酵筛选得到的组合HMB2、HMB5、HMY1、HMY2为转化百药煎鞣质生成没食子酸的最佳混菌组合。
3.3 摇瓶筛选获得最佳混菌组合固态发酵验证
分别将最强单菌HMB5和HMY2、最佳细菌混菌组合(HMB1与HMB5)、最佳酵母菌混菌组合(HMY1与HMY2)、最佳混菌组合(HMB5、HMB1、HMY1和HMY2)接种于2#固态发酵培养基中,接种总量为2 mL,各菌株接种比例相同,在30 ℃条件下静置培养66 h,结束后检测发酵物中没食子酸的含量,结果见图6。
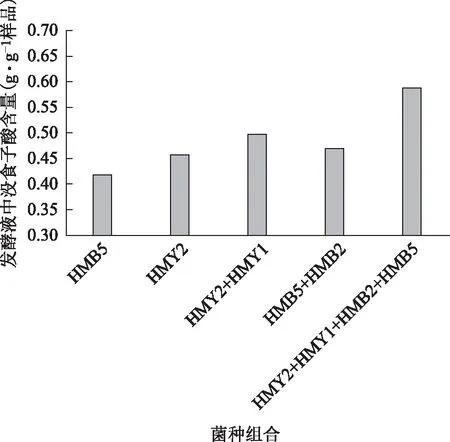
图6 最优混菌组合固态发酵培养
由图6可知,最佳混菌HMB2、HMB5、HMY1、HMY2组合固态发酵培养协同转化百药煎中鞣质生成没食子酸的能力优于最强单菌及最优同类混菌组合。
3.4 最佳混菌组合固态发酵时间曲线
初步研究了最佳混菌组合固态发酵相关条件,包括接种量、菌株接种比例和底物浓度的影响,研究结果发现,菌株接种于3#培养基,细菌接种量各为0.2 mL、酵母菌接种量各为0.4 mL时发酵效果最好,因此在该发酵条件下分别于发酵0、18、30、42、48、66、72 h取样测定发酵液中没食子酸和鞣质随时间的变化情况,结果见图7。
由图7可知,百药煎最佳混菌组合固态发酵过程中,随着发酵时间的增加鞣质含量呈递减趋势,没食子酸的含量呈先增加后减少趋势,培养至66 h样品中没食子酸含量最大为0.589 g·g-1样品,优于百药煎传统炮制品中没食子酸含量(0.52 g·g-1样品)。
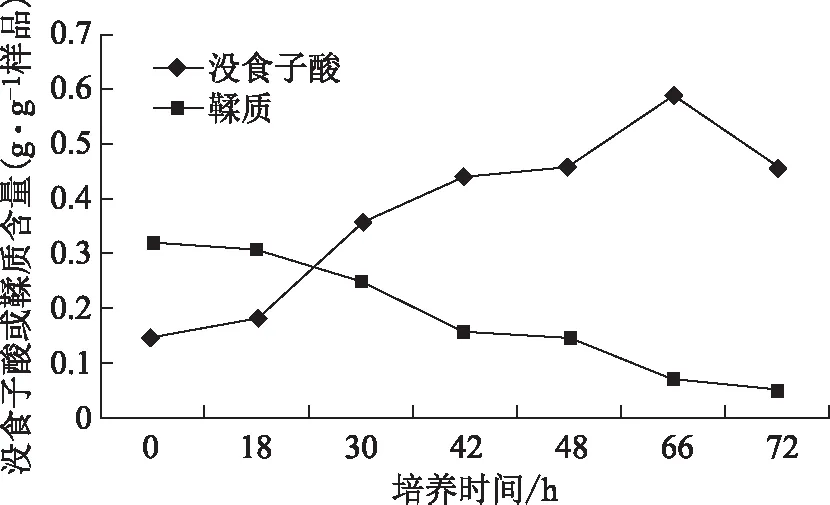
图7 最优混菌组合固态发酵培养过程中没食子酸和鞣质含量变化
3.5 百药煎传统炮制品和百药煎最佳混菌发酵样品抑菌活性测定
比较测定百药煎传统炮制品和百药煎的最佳混菌组合固态发酵培养至66 h,各样品对金黄色葡萄球菌的抑制活性,结果见图8。
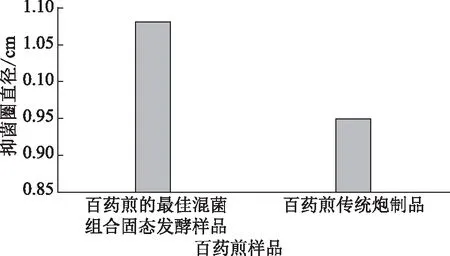
图8 百药煎炮制品和发酵样品抑菌活性测定
由图8可知,百药煎最佳混菌固态发酵66 h所得样品对金黄色葡萄球菌抑制活性优于百药煎传统炮制品。
4 讨论
百药煎传统炮制饮片是在自然状态下混菌发酵制成,随着炮制时间的增加样品中鞣质含量呈递减趋势,没食子酸的含量则呈递增趋势,该结果表明,百药煎中所含微生物逐步将鞣质转化成没食子酸。因此本实验以百药煎传统炮制过程中分离纯化获得具降解鞣质能力的微生物作为筛选出发菌种库,分别进行单菌发酵和混菌发酵,以HPLC方法检测发酵液中没食子酸或鞣质的含量,摇瓶筛选得到具协同降解鞣质生成没食子酸的能力的最佳混菌组合HMB2、HMB5、HMY1、HMY2。最佳混菌组合固态发酵后样品中没食子酸的量约为0.59 g·g-1百药煎,而百药煎传统炮制品中没食子酸为0.52 g·g-1百药煎,增加了约11%,且最佳混菌固态发酵后样品对金黄色葡萄球菌的抑制活性优于百药煎传统炮制品。
本研究筛选得到最佳混菌组合HMB2、HMB5、HMY1、HMY2不仅为实现百药煎的现代工业化生产提供了可发酵调控菌种基础,同时也为分离并利用传统发酵中药的微生物提供了一定的参考。
[1] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,2001.
[2] 柯以敏,张开莲.没食子酸的研究进展[J].泸州医学院学报,2011,30(4):440-442.
[3] 李弈,万德光.试论传统中药的发酵炮制[J].成都医学院学报,2006,1(2):99-101.
[4] 胡梦,王瑞生,文雯,等.百药煎传统炮制过程中微生物的分离与初步鉴定及其鞣质水解特性研究[J].中国现代中药,2017,19(8):1120-1125.
[5] 王广娟.五倍子没食子酸的提取、纯化及抑菌效果研究[D].保定:河北农业大学,2010.
[6] 肖芳,黄勤挽,易佳佳.百药煎质量标准研究[J].中药与临床,2016,7(4):18-21.
