不同活性炭处理对丹参生长、活性成分和土壤微生物影响的研究△
2018-05-03张燕赵瑜金艳任振丽朱继忠李丰胜李颖郝庆秀郭兰萍
张燕,赵瑜,金艳,任振丽,朱继忠,李丰胜,李颖,郝庆秀,郭兰萍*
(1.道地药材国家重点实验室培育基地/中国中医科学院 中药资源中心,北京 100700;2.山东省肥城市人民医院,山东 肥城 271600;3.菏泽步长制药有限公司,山东 菏泽 274000;4.吉林华康制药有限公司,吉林 敦化 133700;5.莱芜紫光生态园有限公司,山东 莱芜 271100)
丹参是我国常用大宗中药材[1],种植面积极广,但其生产上存在严重的自毒和连作障碍问题,常表现为土壤板结、酸化、线虫增加、土传真菌病害加重等[2]。
对于以生产次生代谢产物为利用价值的中药材,其次生代谢产物有时又是自毒物质,直接影响药用植物生长发育,其中酚类和类萜类化合物是高等植物的主要化感物质,它们分别是水溶性和挥发性物质的典型,这恰恰与雨雾淋溶和挥发是化感物质的主要释放方式相吻合。它们分子量较小,结构简单。这类小分子物质在药用植物栽培中很容易释放到环境中,从而改变根际土壤理化性质,并进而影响土壤环境的微生物群落结构[3]。丹参的有效成分可分为两类,即脂溶性丹参酮类(脂溶性二萜醌类)和水溶性酚酸类,此外还含黄酮类、三萜类和甾醇等成分[4]。这些成分进入土壤后就会产生自毒作用,所以丹参的连作障碍现象严重。
而活性炭是孔隙结构发达、比表面积很大(1500 m2·g-1以上)、吸附能力很强的炭,可有效吸附土壤中的化学物质[5]。为了缓解丹参的自毒和连作障碍,设计以活性炭对其自毒物质进行吸附,为栽培丹参的规范化生产提供参考。
1 材料与方法
1.1 供试材料
紫花丹参种苗(山东莱芜,经中国中医科学院黄璐琦研究员鉴定为唇形科植物丹参Salviamiltiorrhiza,采用常规栽培管理),吸附用活性炭粉末(食品级,500 g袋装),丹参素、迷迭香酸、二氢丹参酮、隐丹参酮及丹酚酸B,丹参酮I,丹参酮IIA对照品(江西本草天工科技有限责任公司,批号分别为1103-110101,M24-110421,E06-110116,Y53-110616,1022-101019,1428-070321,1067-080314),乙腈为色谱纯,磷酸为优级纯,水为自制高纯水,其余试剂均为分析纯。
1.2 试验方法
1.2.1 试验设计 于山东莱芜丹参GAP试验示范基地进行,分别在新土(头茬)和连作土(重茬)两片地上进行,新土(头茬)的供试土壤理化特性为壤土,pH 6.0,有机质0.807 g·kg-1,全氮0.147%,速效磷4.979 mg·kg-1,速效钾206.349 mg·kg-1。连作土(重茬)的供试土壤理化特性为砂壤土。每种土均设4个处理,分别为处理1(对照,不加活性炭),处理2(加活性炭50 g·m-2)、处理3(加活性炭100 g·m-2)、处理4(加活性炭150 g·m-2)。采用田间小区试验,小区面积15 m2,移栽密度50 cm×30 cm,重复3次,随机区组设计。丹参于3月份进行移栽,选择10月份进行观测、采收取样,每个小区取10株,即每个处理调查30株。
1.2.2 测定项目和方法 株高采用钢卷尺测量,芦头直径采用游标卡尺测量,生物量和单株产量采用天平称量。丹参中有效成分测定样品于10月取样,每个处理取10株作为混合样,晾干,样品采用常温、避光、防潮方式保存,次年3月测定。样品粉碎后过60目筛,60 ℃烘烤14 h,采用HPLC测定,2695型高效液相色谱系统,Waters 2996 PDA检测器(美国Waters公司),电子精密天平(Sartorius BS 2202S)型。色谱条件为SGE ENDURO C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈(A)-0.1%磷酸水(B)梯度洗脱(0~15 min,25%A;15~16 min,25%~40%A;16~18 min,40%~50%A;18~55 min,50%~75%A;55~56 min,75%~25%A),柱温30 ℃,流速1 mL·min-1,进样量10 μL,检测波长280 nm。经方法学考察,本法准确、快速、重复性好。土壤主要微生物类群测定好气性细菌、真菌、放线菌,采用培养-平板计数法[6]。
1.3 数据分析
数据采用Excel进行录入和作图,运用SPSS 18.0软件进行描述性统计和方差分析。
2 结果与分析
2.1 不同石灰处理对丹参生长指标和生物量的影响
从图1至图4可以看出,添加活性炭未对连作土上种植的丹参产生显著地生长促进作用。而添加活性炭对新土上种植的丹参芦头直径、单株地上鲜重、单株地下鲜重3个指标影响显著。
添加活性炭未对连作土上种植的丹参产生显著地生长促进作用,可能与连作土是砂壤土,前茬丹参对营养元素的选择吸收导致土壤营养物质失衡和释放到环境中的连作自毒物质尚有危害作用,所以连作土上种植的丹参各项生长指标均低于新土上种植的丹参。又因为试验地干旱,未形成土壤胶体,土壤胶体是指颗粒直径<2 μm的土壤中颗粒最细小的部分,包括粘粒、铁铝氧化物、碳酸盐以及微生物等,是土壤中最活跃的物质。由于比表面积大,胶体具有较高的吸附容量,是环境中污染物的重要吸附剂[5]。而有机碳是胶体起吸附作用的核心所在,但这需要分散在胶体中的水分起促进作用,缺水和含沙量太高影响了胶体的形成,所以活性炭在干燥砂质连作土上的吸附效果未得到很好的发挥。

图1 不同活性炭处理对丹参株高的影响
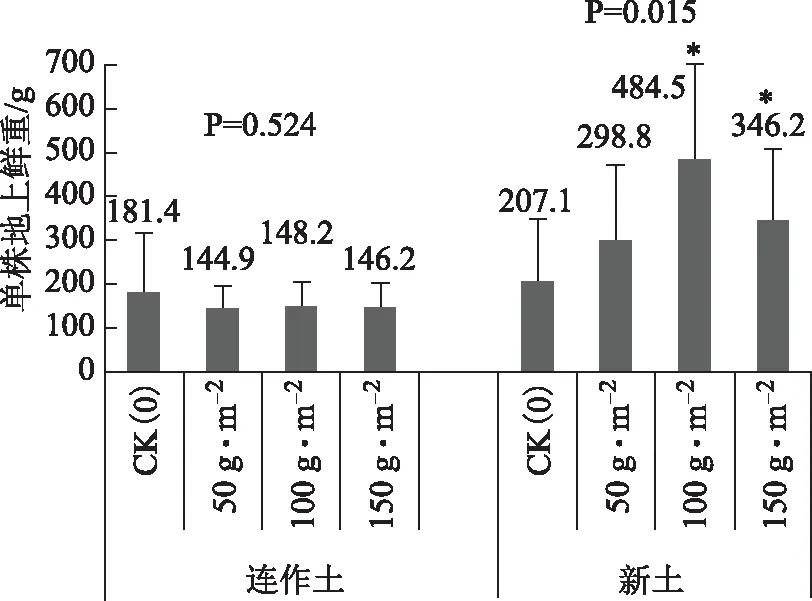
图3 不同活性炭处理对丹参单株地上鲜重的影响
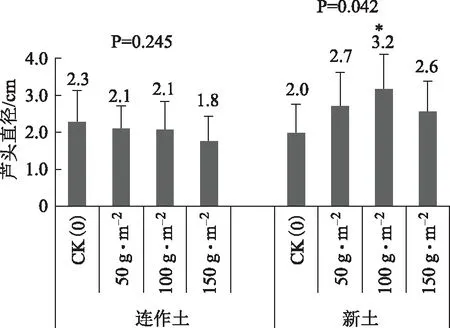
图2 不同活性炭处理对丹参芦头直径的影响
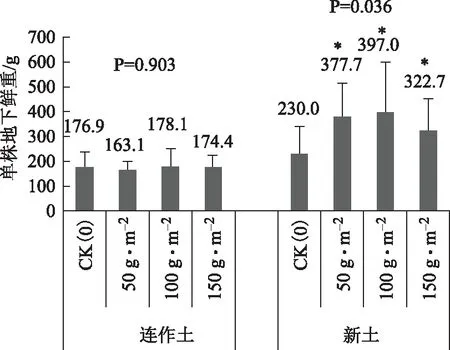
图4 不同活性炭处理对丹参单株根鲜重的影响
添加活性炭对新土上种植的丹参芦头直径、单株地上鲜重、单株地下鲜重3个指标影响显著,加活性炭100 g·m-2和150 g·m-2对此3个指标的促进作用显著,以100 g·m-2促进作用最大,而添加活性炭50 g·m-2也对根鲜重产生了显著地促进作用。
通过对图1、图2、图3、图4四幅图可以看出连作土上种植的丹参比新土上种植的丹参各项生长指标均有下降,说明丹参是典型的连作障碍植物,所以生产上建议丹参基地要进行变迁,不能在同一块地上重复种植。另外,在新土上种植时,添加100 g·m-2的活性炭会增加土壤胶体的吸附能力,促进丹参产量的提高。
2.2 不同活性炭处理对丹参内丹参酮ⅡA和丹酚酸B等7种活性成分的影响
不同活性炭处理对丹参内丹参素、迷迭香酸、丹酚酸B、二氢丹参酮、隐丹参酮、丹参酮ⅡA等7种活性成分的影响见表1,从表1可以看出,不同活性炭处理未对丹参的活性成分产生显著影响。
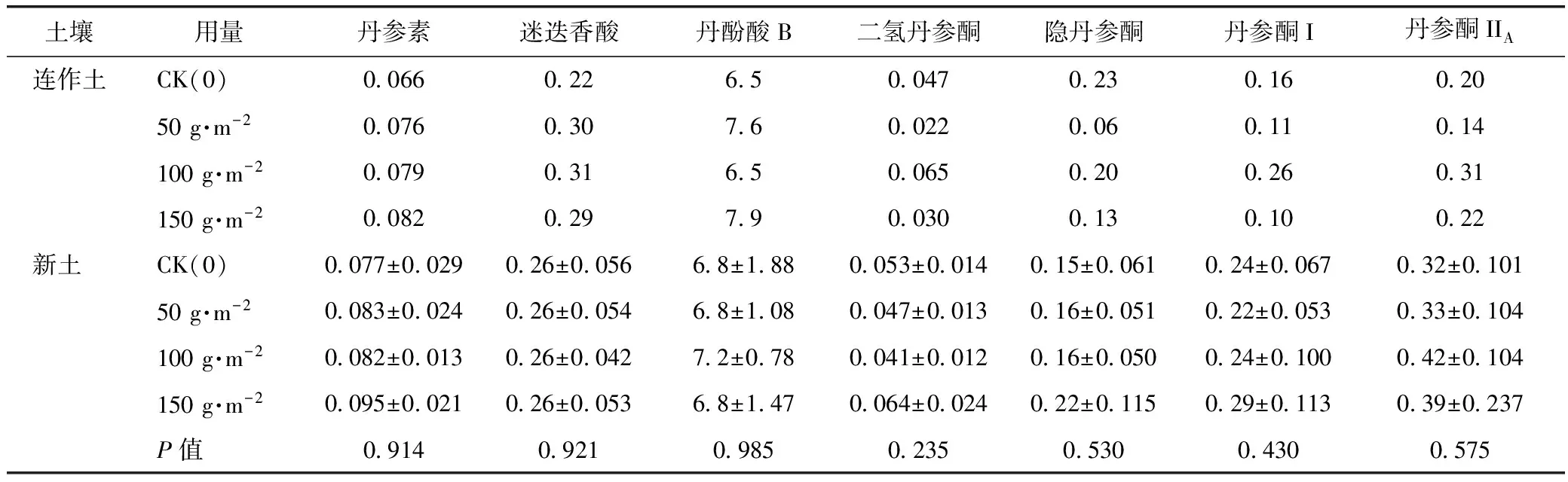
表1 不同活性炭处理对丹参内丹参酮ⅡA和丹酚酸B等7种活性成分的影响
2.3 不同活性炭处理对土壤细菌、真菌、放线菌的影响
由于连作土丹参长势差异不大,所以本次菌落检测仅针对从长势上看差异显著地新土丹参试验。不同活性炭处理对新土栽培丹参土壤细菌、真菌和放线菌的影响见表2,从表2可以看出,由于土壤样品只有3份,组内差异偏大,不同活性炭处理对丹参土壤微生物的影响在统计学上未达到显著水平。但表2中的试验数据显示,随着活性炭的添加,出现好氧性细菌数量增加,真菌数量减少的现象,未添加活性炭的对照土壤好氧性细菌为每克45.3×106个,添加50 g·m-2的土壤中的好氧性细菌为每克61.0×106个,添加而100 g·m-2的土壤中的好氧性细菌为每克57.3×106个;而未添加活性炭的对照土壤真菌为每克7.3×104个,添加50 g·m-2的土壤中的好氧性细菌为每克5.8×106个,添加而100 g·m-2的土壤中的好氧性细菌为每克6.3×106个。
由于大豆连作使土壤pH值降低,直接影响了微生物的区系分布,使土壤微生物区系从高肥的“细菌型”土壤向低肥的“真菌型”土壤转化[7-8]。连作障碍的土壤菌落表现经常是好氧性细菌降低,真菌增加。而细菌占土壤微生物总量的70%,是土壤中最活跃的因素,对植物根系微生态系统具有重要作用,其中的有益菌属具有参与土壤营养循环、降解化感自毒物质及改善土壤质地等作用[9]。丹参活性炭的添加虽然未使土壤菌落差异达到显著性水平,但目前的趋势说明适宜活性炭的添加能促使土壤微生物中的好氧性细菌增加,真菌减少,从而促进了丹参的生长。

表2 不同活性炭处理对土壤菌落的影响
3 结论与讨论
通过不同剂量的活性炭在连作土和新土上施加后检测丹参的株高、芦头直径、主根数、单株地上鲜重、单株地下鲜重等生长指标和生物量指标,以及丹参酮类和丹酚酸类7种活性成分含量及栽培后土壤好氧性细菌、真菌和放线菌的数量,经对比发现:添加活性炭提高了丹参的产量,增加了土壤的健康水平,但对活性成分影响未达到显著性水平。
所以建议丹参种植时适当的添加活性炭以减少其自毒作用,添加剂量在50~100 g·m-2为好。由于试验用活性炭粉成本比较高,也可以在研发丹参专用肥时,适当考虑增加成本低的有机炭类成分,以提高丹参的产量和土壤可持续利用水平。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:化学工业出版社,2015:70.
[2] 郭兰萍,黄璐琦,蒋有绪,等.药用植物栽培种植中的土壤环境恶化及防治策略[J].中国中药杂志,2006,31(9):714-717.
[3] 张重义,牛苗苗,陈婷,等.药用植物化感自毒作用研究对栽培技术创新的启示[J].中国现代中药,2011,l3(l):4-7,20.
[4] 赵娜,郭治怡,赵雪,等,丹参的化学成分与药理作用.国外医药·植物药分册,2007,2(4):155-160.
[5] 百度百科-活性炭[EB/OL].http://baike.baidu.com/link?url=8YSi3cuhb2k WJWrwciHm2P8IUVBRBLZ CatJPusb7 HMbPsEoE-VeV_Sb PLaOORXfJ.
[6] 土壤微生物研究会(日).土壤微生物实验方法[M].北京:科学出版社,1983.
[7] 邹莉,袁晓颖,李玲,等.连作对大豆根部土壤微生物的影响研究[J].微生物学杂志,2005,25(2):27-30.
[8] 张子龙,王文全.植物连作障碍的形成机制及其调控技术研究进展[J].生物学杂志,2010,27(5):69-72.
[9] 皇甫晶晶.不同轮作模式消减太子参连作障碍的机制研究[D].福州:福建农林大学,2012.
