大黄素对CCl4诱导小鼠肝纤维化的作用机制△
2018-05-03王云龙郭海魏睦新
王云龙,郭海,魏睦新
(1.南京医科大学 附属淮安第一医院,江苏 淮安 223001;2.南京医科大学 第一附属医院,江苏 南京 210003)
肝纤维化是各种感染性或非感染性因素引起的肝脏慢性损伤后导致细胞外基质过度沉积的病理过程。肝纤维可进展为肝硬化,甚至是肝癌,给家庭、社会带来了沉重的经济负担,目前尚缺乏有效的治疗肝纤维化的药物[1-3]。随着对肝纤维化病理生理机制研究的深入,越来越多的研究表明巨噬细胞参与了肝损伤和纤维化的发生、发展,在肝纤维化形成过程中起着关键的作用,被称为肝纤维化的“中心调控者”[4-6]。
肝脏内的巨噬细胞主要是由肝脏本身的库夫细胞(resident Kupffer cells,KFs)和外周趋化而来的单核细胞组成。现在研究表明在肝脏损伤时肝脏内KFs急剧减少,而外周和骨髓中大量的单核细胞受单核细胞趋化因子(monocyte chemoattractant protein,MCP-1)趋化进入肝脏,分化为单核细胞来源的巨噬细胞[4]。肝脏损伤时趋化进入肝脏的单核细胞,可以通过多种途径活化肝星状细胞,如释放促纤维化的细胞因子转化生长因子(Transforming growth factor,TGF-β1)[5-6],导致纤维化的发生、进展。因此减少单核细胞的趋化被认为是治疗肝脏纤维化的重要方向之一。
大黄素是大黄、虎杖等常用中药材中的关键活性成分。而大黄和虎杖则是中医药治疗肝纤维化的常用药物[7]。近年来对大黄素研究发现其具有良好的抗炎、抗肿瘤和抗纤维化效果[8]。如展玉涛等[9-10]研究发现大黄对肝纤维化大鼠具有良好的保护作用,但大黄素抗纤维化机制仍不清楚。本研究拟在前人研究的基础上,验证大黄素对CCl4诱导小鼠肝纤维化的作用,并从单核细胞浸润的角度探索可能的机制。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠,7~8周龄,体质量(24±2)g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK2016-0001,小鼠分笼饲养,自由饮水进食,实验前置实验环境中适应6~8 d,实验环境温度控制在(24±2)℃,相对湿度为60%~80%,小鼠处理符合江苏省人民医院实验动物管理的相关规定。
1.2 药物及试剂
大黄素(上海源叶生物科技有限公司,纯度>90%,HPLC,CAS号:518-82-1)。四氯化碳(CCl4,上海凌峰化学试剂有限公司,批号:20161011)。橄榄油(四川科龙化工有限公司,批号:2015060702)。免疫组化一抗抗体CD45(Abcam公司,ab10558)、CD11B(Abcam公司,ab133357)、F4/80(Abcam公司,ab16911)、α平滑肌肌动蛋白(α-SMA)抗体(Abcam公司,ab5694)。免疫组化二抗-辣根过氧化酶标记羊抗兔IgG(北京中杉金桥生物科技有限公司,PV-6001)。Trizol试剂盒(Invitrogen公司,批号:15596-019)、RT-PCR逆转录/荧光试剂盒(TaKaRa公司,批号:RR420A/RR036A)。
1.3 仪器
applied biosystems QuantStudioTM 6 Flex Real-time PCR仪(美国Life Technologies),applied biosystems 2720 Thermal cycler逆转录仪(美国Life Technologies),Allegra X-15R型台式高速冷冻离心机(美国Benchtop),BMJ-1型石蜡包埋机(天津爱华),Leica RM-2235型石蜡切片机(德国Leica),Bx60型生物显微镜(日本Olympus),T50型匀浆机(德国IKA)。
2 方法
2.1 分组及肝纤维化模型制备
肝纤维化模型制备参考Karlmark等[4]制作的小鼠肝纤维化模型。将小鼠随机分为3组:空白组、模型组、CCl4+大黄素即大黄素组,每组8只。适应性饲养7 d后开始造模:大黄素组及模型组按0.6 mL·kg-1的剂量腹腔注射CCl4[CCl4-橄榄油(1∶4),腹腔注射3 μL·g-1CCl4油剂,每周2次,连续注射4周,建立肝纤维化小鼠模型]。肝纤维化造模成功判断依据:病理可见小鼠肝脏结构破坏,假小叶形成,大量胶原沉淀。空白组腹腔注射等体积的橄揽油作为对照。大黄素粉末用0.25%羧甲基纤维素钠(CMC-Na)水溶液混悬,配制成适当的浓度,大黄素组小鼠每天给予5 μL·g-1大黄素药液灌胃,大黄素的剂量为40 mg·kg-1·d-1,此剂量参照展玉涛等[9-10]实验结果,为治疗肝纤维化最适宜的浓度。每天1次,连续4周。空白组和CCl4组给予等体积的0.25% CMC-Na水溶液。
2.2 HE及Masson染色
小鼠麻醉后摘除眼球取血,取小鼠左小叶行中性甲醛固定48 h后,脱水,石蜡包埋,切片厚3 μm,后行HE染色和Masson染色。染色方法参照Huang R等的研究报道[11]。
2.3 免疫组化
采用免疫组化SABC法检测CD45、CD11B、F4/80、a平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)。石蜡切片烘烤后于二甲苯脱蜡,75%乙醇透明,3%过氧化氢溶液封闭内源性过氧化氢酶,EDTA高温抗原修复,加相应浓度的一抗(CD45 1∶2000、CD11B 1∶50000、F4/80 1∶500、α-SMA 1∶2000)孵育过夜,再加二抗37 ℃ 25 min,最后DAB显色,中性树脂封片。
2.4 Real time PCR方法检测小鼠肺组织的TGF-β1和MCP-1 mRNA相对表达量
取冻存肝组织4 ℃解冻以后,放入DEPC预处理的EP管中,在低温冰块上将其剪碎,加入1 mL TRozl进行组织匀浆。提取总RNA:按RNAiso Reagent试剂盒提取小鼠肝脏组织总RNA,并测其浓度。逆转录反应:按照TaKaRa逆转录试剂盒操作规范,反转录反应37 ℃、15 min,85℃反转录酶失活反应5 s。PCR反应:采用SYBR Premix Ex Taq kit试剂盒相应反应体系,总体积为20 μL,引物序列如下:MCP-1,上游5′-ATTGGGATCATCTTGCTGGT-3′,下游5′-CCTGCTGTTCACAGTTGCC-3′,引物长度187 bp;TGF-β1,上游5′-GTGGAAATCAACGGGATCAG-3′,下游5′-ACTTCCAACCCAGGTCCTTC-3′,引物长度210 bp;β-actin作为内参,上游5′-GGCTGTATTCCCCTCCATCG-3′,下游5′-CCAGTTGGTAACAATGCCATGT-3′,引物长度205 bp;分别扩增MCP-1、TGF-β1和β-actin,每个样本3个复孔,得到阈循环值(Ct)平均值,计算△△Ct值,各个样本的mRNA表达水平均以2-△△Ct表示。
2.5 免疫组化结果判断
在光学显微镜下观察组织切片,Masson染色结果及α-SMA免疫组化染色结果在低倍镜下(×100)进行拍照。用Image-ProPlus软件测量每个视野中蓝色(Masson阳性)或棕黄色(α-SMA免疫组化阳性)区域的面积(像素),用每个视野Masson阳性或α-SMA免疫组化阳性染色面积(像素)占整个视野面积(像素)的比例为该切片Masson阳性或α-SMA免疫组化阳性的比例。每张切片随机拍5个视野,取平均值作为该样本Masson阳性或α-SMA免疫组化阳性的比例。对于CD45、F4/80及CD11b免疫组化结果则选择在高倍镜下(×400)。每只动物选取5张切片,每张切片随机选取5个视野,采用Image-ProPlus软件计数每个视野下CD45、F4/80及CD11b阳性细胞数,取平均值作为该样本CD45、F4/80及CD11b阳性的细胞数。
2.6 统计学处理
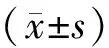
3 结果
3.1 动物一般情况
空白组小鼠活泼好动,皮毛柔顺有光泽,体质量无明显变化;模型组小鼠活动和摄食明显减少,精神不振,拱背蜷缩,背毛杂乱无光泽,身体较其他组消瘦;大黄素组大鼠皮毛、饮食与模型组比较有所改善,大便色黄稀软,小便较黄,体质量较模型组减轻。
3.2 肝组织HE染色
如图1所示,空白组小鼠肝组织结构完整,肝细胞无坏死,汇管区未见明显炎性细胞浸润,结构清晰;而模型组小鼠的整个肝组织结构紊乱,肝小叶结构明显破坏,形成许多假小叶,汇管区见大量炎性细胞浸润。而经大黄素治疗后的小鼠肝组织整个肝区炎症较模型组则有明显改善,肝细胞坏死及假小叶的形成明显减少,而整个汇管区浸润的白细胞也较模型组明显减轻。
3.3 肝组织Masson染色和α-SMA免疫组化
图2中Masson染色可见空白组小鼠肝脏的肝小叶中央静脉壁纤维着色,而汇管区及小叶间隔仅有少量纤维着色。模型组小鼠肝组织内的阳性染色较空白组明显增多,从图2中可以看出已经形成肝小叶之间的纤维间隔,以及在中央静脉和汇管区周围有许多纤维沉积。大黄素组的小鼠肝脏也存在纤维沉积,而这些纤维沉积的分布与模型组小鼠亦相同,但是其胶原沉积的数量、分布密度明显少于模型组。α-SMA是肝星状细胞(hepatic stellate cell,HSC)的活化标志蛋白,当HSC被激活并转化为肌成纤维细胞,即表达α-SMA。在本实验中α-SMA阳性染色为棕色。空白组小鼠肝脏组织中除了血管平滑肌有少量表达α-SMA以外,其余部位几乎无表达(见图2)。模型组小鼠肝组织的α-SMA表达明显增多,沿汇管区大量分布,呈强阳性染色。而大黄素组虽然也能见到许多阳性染色,但相比较于模型组,α-SMA阳性染色的数量、密度明显少于模型组。对各组Masson染色和α-SMA免疫组化阳性比例结果做统计分析,结果显示模型组小鼠Masson染色和α-SMA免疫组化阳性比例明显高于空白组,而大黄素组Masson染色和α-SMA免疫组化阳性比例虽然高于空白组,但也明显低于模型组(见图3)。可见大黄素可明显改善CCl4所致的小鼠肝纤维化。
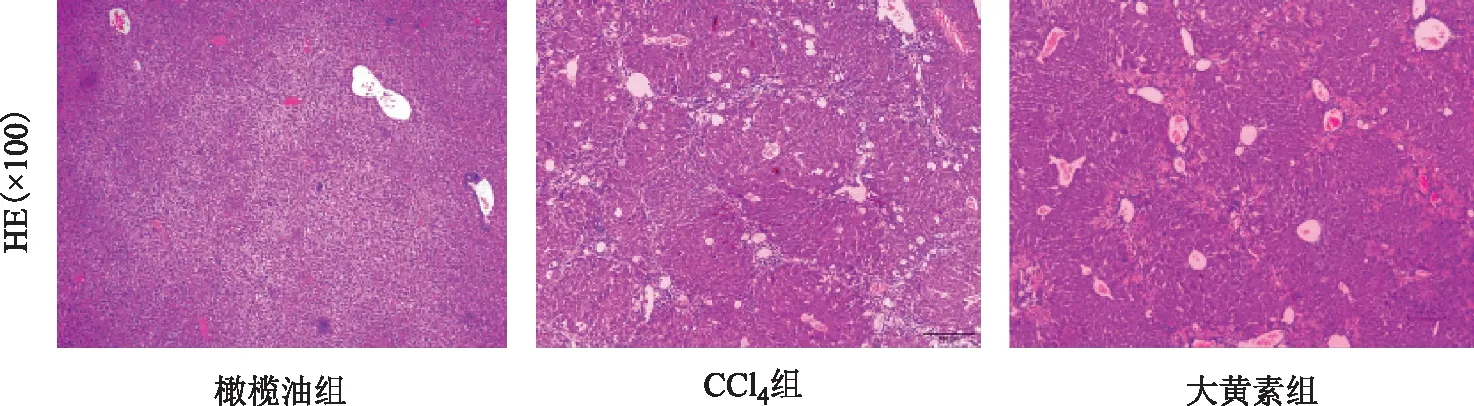
图1 不同组小鼠肝脏HE染色图

图2 不同组小鼠肝脏Masson和α-SMA染色图
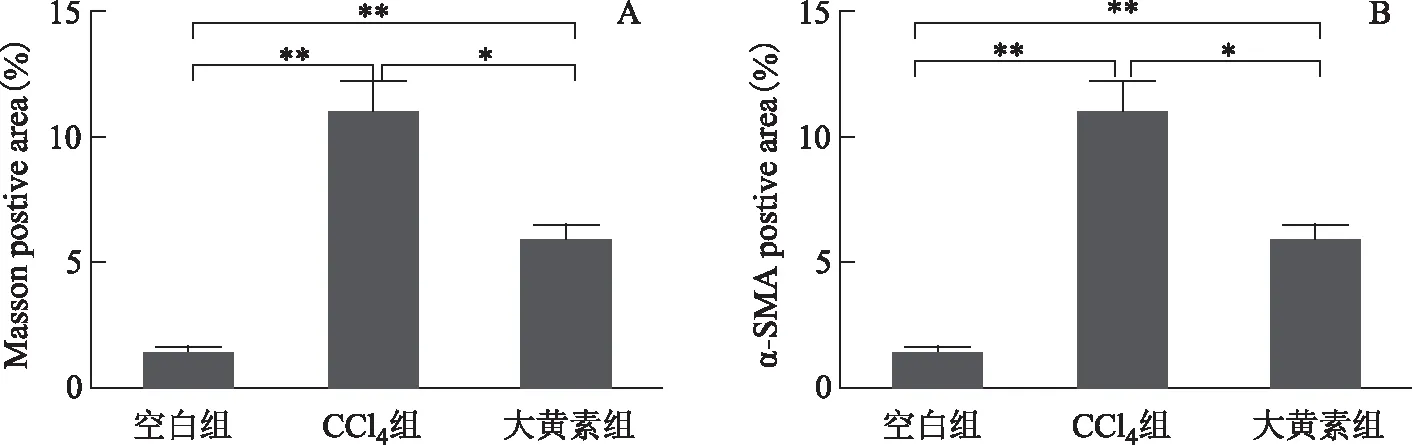
注:*P<0.05,**P<0.01;下同。图3 不同组小鼠肝脏Masson染色(A)和α-SMA免疫组化(B)分析
3.4 CD45、CD11B、F4/80免疫组化
空白组小鼠肝组织中仅有少量的CD45+、CD11B+、F4/80+细胞浸润,且分布均匀(见图4);而模型组小鼠肝组织中见有大量的CD45+、CD11B+、F4/80+细胞浸润,主要集中在汇管区周围。对空白组和模型组CD45+、CD11B+、F4/80+阳性细胞进行统计,差异有统计学意义(P<0.01,P<0.01,P<0.01);大黄素组小鼠肝脏中亦有CD45+、CD11B+、F4/80+细胞浸润,但明显少于模型组。对大黄素组和模型组的CD45+、CD11B+、F4/80+阳性细胞行进行统计,差异有统计学意义(P<0.01,P<0.01,P<0.05)。见图5。
3.5 小鼠肝组织TGF-β1和MCP-1的RealTime PCR
如图6所示,在腹腔反复注射CCl4引起肝纤维化过程中,小鼠肝脏中TGF-β1表达明显上升(P<0.01),而给予大黄素灌胃的小鼠肝脏中TGF-β1表达明显减少(P<0.05)。同时,从图6中可以看出,与空白组比较,模型组小鼠肝组织中MCP-1的mRNA表达明显升高(P<0.01);与模型组比较,大黄素组肝组织MCP-1的mRNA表达显著降低(P<0.05),相关结果具有统计学意义。
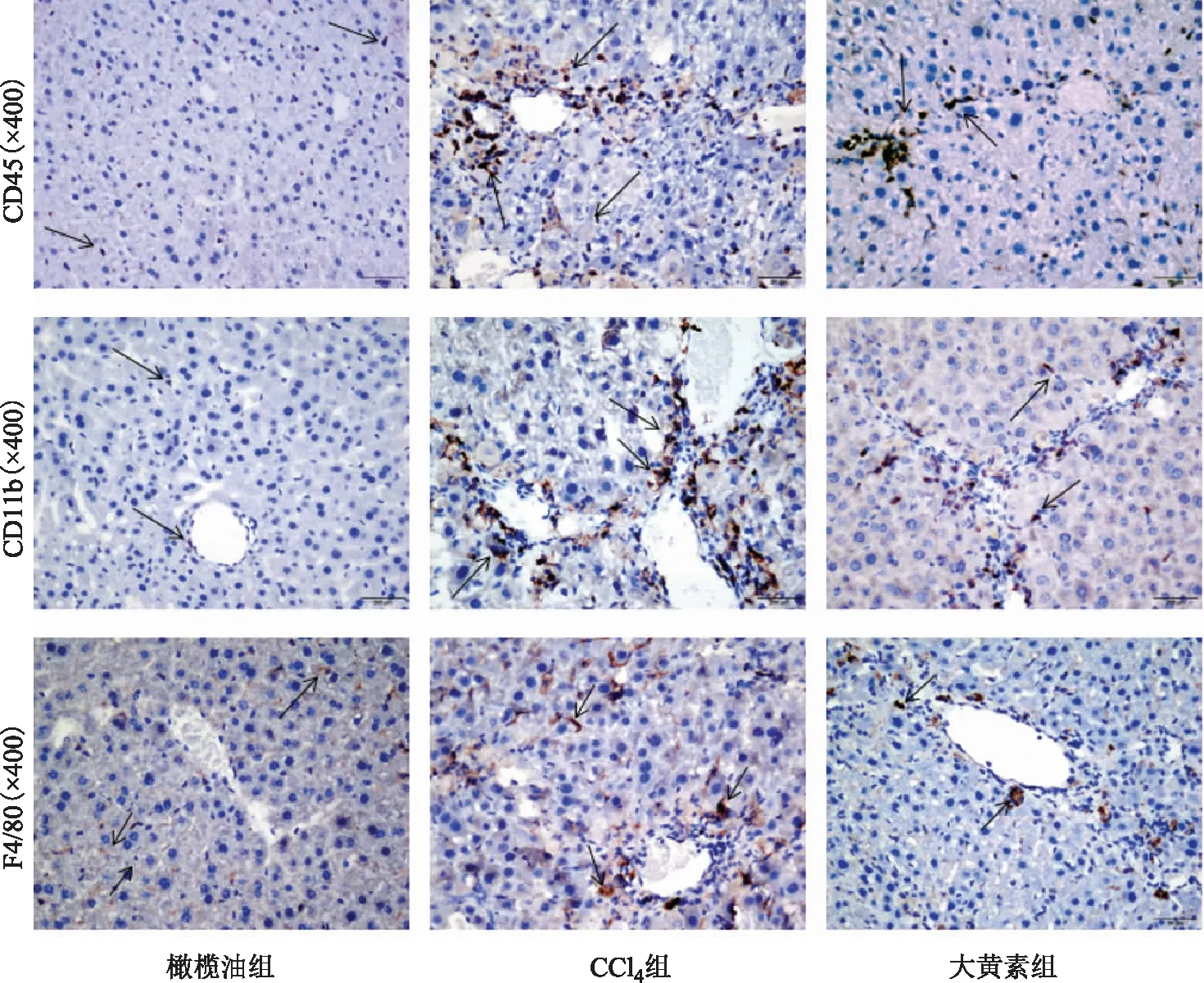
图4 不同组小鼠肝脏CD45、CD11B和F4/80免疫组化染色
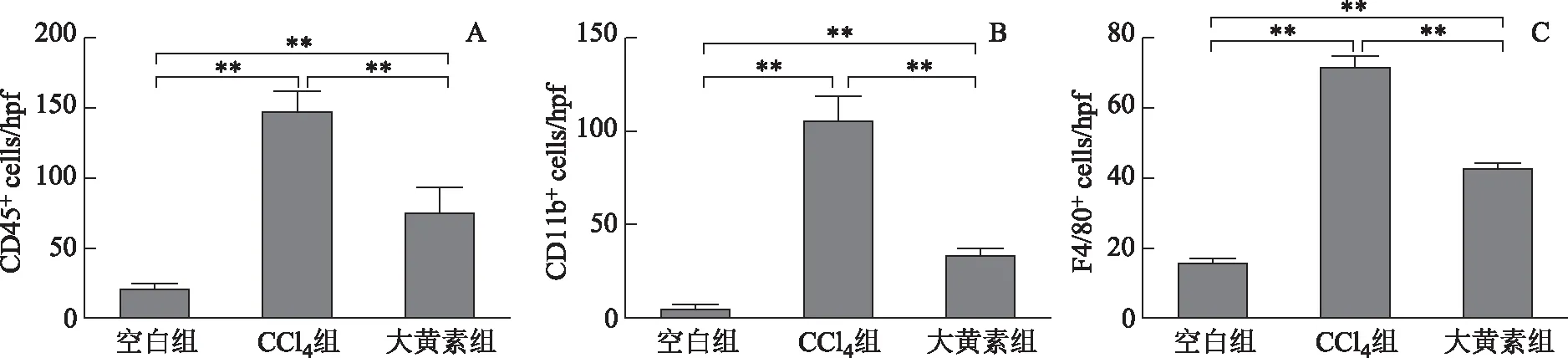
图5 不同组小鼠肝脏CD45(A)、CD11B(B)和F4/80(C)免疫组化分析

图6 不同组小鼠肝脏TGF-β1(A)和MCP-1的mRNA(B)表达变化
4 讨论
肝纤维化是临床多种肝脏慢性疾病的并发症,其发病机制复杂,尚缺乏有效的治疗手段。近年来研究发现巨噬细胞在肝纤维化发生的病理机制中发挥着重要的作用[12-13]。巨噬细胞可分泌肿瘤坏死因子(tumor necrosis factor,TNF-α)、白介素-1β(Interleukin-1β,IL-1β)等细胞因子,通过核转录因子(nuclear transcription factor,NF-κB)促进HSC活化[14];并能合成和分泌大量的促纤维化细胞因子,如TGF-β1和血小板衍生生长因子(platelet-derived growth factor,PDGF),TGF-β1和PDGF可直接激活HSC,导致胶原纤维大量合成,引起纤维化[15]。肝脏中巨噬细胞主要有两个方面的来源,一是肝脏本身的库夫细胞(resident Kupffer cells,KFs)的自我更新;二是炎症期间趋化进入的单核细胞。研究发现,去除肝脏本身的库夫细胞只能部分减轻肝纤维化。而将单核细胞去除后的小鼠,在进行肝纤维化造模过程中,发现肝纤维化较普通小鼠明显减轻[4]。进一步深入研究发现,炎症期趋化进入肝脏的单核细胞可以分化为单核细胞来源的巨噬细胞,其可释放促炎和促纤维化的细胞因子,加重肝损伤和引起肝纤维化。除此之外,近年来还发现一种非典型的单核细胞,细胞膜表面分子标记为Ceacam1+Msr1+Ly6C-F4/80-Mac1+,在肝纤维化过程中被招募至肝脏,具有明显促纤维化作用,但其促纤维化机制尚不明确[16]。这些研究结果既提示了单核细胞在肝纤维化中的关键作用,如何减少单核细胞浸润可能是治疗肝纤维化的一个重要靶点。
大黄素是大黄和虎杖等中药的主要药物成分,而大黄和虎杖等中药是中医治疗肝纤维化的常用药物。现代研究发现大黄素具有抗炎、抗肿瘤和抗纤维化的作用[17-18],其中大黄素的抗纤维化治疗作用已经在肺纤维化和肝纤维化上得到证实[19-20],但相关机制还没有完全清楚。近年来有研究发现大黄素有抑制内毒素引起的单核细胞趋化作用[21]。故本研究拟通过检测肝纤维化过程中单核细胞浸润的变化来探索大黄素治疗肝纤维化的机制。
本研究通过腹腔反复注射CCl4复制小鼠肝脏慢性炎症造成肝纤维化模型,这也是目前比较认可的肝纤维化模型。结果证实CCl4腹腔反复注射可以引起小鼠肝脏损伤和肝纤维化,发现肝纤维化时肝脏中单核细胞和巨噬细胞浸润明显增加,TGF-β1的合成增多,这与既往认识相符[15]。通过分析各组小鼠肝脏的HE染色和Masson染色结果,发现大黄素可以明显减轻肝脏炎症和肝脏纤维化。α-SMA是HSC的活化标志蛋白,α-SMA的表达降低说明了大黄素减少肝星状细胞活化和增殖[22]。CD45、CD11b和F4/80分别是白细胞、单核细胞和巨噬细胞膜表面特异性的标记分子。通过各组小鼠肝脏中CD45、CD11b和F4/80免疫组化检测,发现大黄素可以减少CCl4腹腔注射引起的白细胞、单核细胞、巨噬细胞在小鼠肝脏中的浸润。这说明了大黄素可以减少肝纤维化期间单核细胞来源的巨噬细胞的数量。
TGF-β1是目前发现的最强促纤维化细胞因子,可以直接活化肝星状细胞,分泌细胞外基质,引起肝纤维化[23-24]。研究发现,在肝纤维化形成过程中,TGF-β1主要是单核细胞来源的巨噬细胞所分泌的[25]。这也是单核细胞促进肝纤维化的重要机制。本研究也验证了在肝纤维化期TGF-β1表达升高,而给予大黄素灌胃后,TGF-β1表达明显下降。这可能与大黄素减少肝纤维化期单核细胞来源的巨噬细胞浸润相关。
MCP-1是单核细胞趋化的关键细胞因子[26-27]。对MCP-1-/-小鼠进行腹腔反复注射CCl4制备肝纤维化模型时,MCP-1-/-小鼠肝脏中单核细胞浸润减少和肝纤维化程度减轻[26]。药理性拮抗MCP-1也有相似作用[27]。这些研究证实了单核细胞在肝纤维化期的趋化主要通过MCP-1实现的。Real time PCR的结果显示大黄素可以明显减少肝脏纤维化期MCP-1的表达,推测大黄素是通过减少MCP-1分泌来抑制单核细胞浸润。
综上所述,本研究表明大黄素能够抑制CCl4导致的肝纤维化,其抗纤维化作用的机制可能是通过减少单核细胞来源的巨噬细胞向肝脏浸润,进而抑制TGF-β1等促纤维化因子的表达,减轻肝脏的炎症反应和HSC活化发挥其抗纤维化的作用。本研究明确了单核细胞来源的巨噬细胞可能是肝纤维化治疗靶点,也进一步揭示了大黄素抗肝纤维化的部分机制,为肝损伤和纤维化的治疗提供了新的思路。
[1] Bataller R,Brenner D A.Liver fibrosis[J].Clin Invest,2005,115(2):209-218.
[2] Trautwein C,Friedman S L,Schuppan D,et al.Hepatic fibrosis:Concept to treatment[J].J hepatology,2015,62(Suppl 1):S15-S24.
[3] Tsochatzis E A,Bosch J,Burroughs A K.Liver cirrhosis[J].Lancet,2014,383(9930):1749-1761.
[4] Karlmark K R,Weiskirchen R,H W Zimmermann,et al.Hepatic recruitment of the inflammatory Gr1+ monocyte subset upon liver injury promotes hepatic fibrosis[J].Hepatology,2009,50:261-274.
[5] Adhyatmika A,Putri K S,Beljaars L,et al.The Elusive Antifibrotic Macrophage[J].Front Med,2015,2:81.
[6] Karlmark K R,Wasmuth H E,Trautwein C,et al.Chemokine-directed immune cell infiltration in acute and chronic liver disease[J].Expert Rev Gastroenterol Hepatol,2008,2(2):233-242.
[7] 刘鸣昊,薛博瑜.近5年来肝纤维化中医证治用药规律的文献研究[J].中国实验方剂学杂志,2011,17(18):279-282.
[8] Dong X,Fu J,Cao S,et al.Emodin:A Review of its Pharmacology,Toxicity and Pharmacokinetics[J].Phytotherapy research,2016,30(8):1207-1218.
[9] 张丽丽,张慧英,王黎敏,等.大黄素对肝纤维化大鼠肺损伤的保护作用[J].中国病理生理志,2014,30(2):291-296.
[10] 展玉涛,李定国,王志荣,等.大黄素对大鼠肝纤维化形成的影响[J].中国中西医结合杂志,2000,20(4):276-278.
[11] Huang R,Liu Y,Xiong Y,et al.Curcumin protects against liver fibrosis by attenuating infiltration of Gr1hi monocytes through inhibition of monocyte chemoattractant protein-1[J].Discov Med,2016,22(Suppl 2):447-457.
[12] Wynn T A,Barron L.Macrophages:master regulators of inflammation and fibrosis[J].Semin Liver Dis,2010,30(3):245-257.
[13] Pellicoro A,Ramachandran P,Iredale J P,et al.Liver fibrosis and repair:immune regulation of wound healing in a solid organ[J].Nat Rev Immunol,2014,14:181-194.
[14] Liaskou E,Zimmermann H W,Li K K,et al.Monocyte subsets in human liver disease show distinct phenotypic and functional characteristics[J].Hepatology,2013,57(1):385-398.
[15] Pradere J P,Kluwe J,MS De,et al.Hepatic macrophages but not dendritic cells contribute to liver fibrosis by promoting the survival of activated hepatic stellate cells in mice[J].Hepatology,2013,58:1461-1473.
[16] Satoh T,Nakagawa K,Sugihara F,et al.Identification of an atypical monocyte and committed progenitor involved in fibrosis[J].Nature,2017,541:96-101.
[17] 林玩福,汪晨,凌昌全.大黄素抗肿瘤作用研究进展[J].中国中药杂志,2015,40(20):3937-3940.
[18] Dong M X,Jia Y,Zhang Y B,et al.Emodin protects rat liver from CCl4-induced fibrogenesis via inhibition of hepatic stellate cells activation[J].World J Gastroentero,2009,15(38):4753.
[19] Gao R,Chen R,Cao Y,et al.Emodin suppresses TGF-beta1-induced epithelial-mesenchymal transition in alveolar epithelial cells through Notch signaling pathway[J].Toxicol Appl Pharm,2017,318:1-7.
[20] Dong M X,Jia Y,Zhang Y B,et al.Emodin protects rat liver from CCl4-induced fibrogenesis via inhibition of hepatic stellate cells activation[J].World J Gastroentero,2009,15(38):4753.
[21] Heo S K,Yun H J,Noh E K,et al.Emodin and rhein inhibit LIGHT-induced monocytes migration by blocking of ROS production[J].Vascular pharmacology,2010,53(1-2);28-37.
[22] Tsuchida T,Friedman S L.Mechanisms of hepatic stellate cell activation[J].Nat Rev Gastroenterol Hepatol,2017,14:397-411.
[23] Hernandez-Gea V,Friedman S L.Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011,6:425-456.
[24] Inagaki Y,Higashiyama R,Higashi K,et al.Novel anti-fibrotic modalities for liver fibrosis:molecular targeting and regenerative medicine in fibrosis therapy[J].J Gastroenterol Hepatol,2012,54(7):85-98.
[25].Heymann F,Hammerich L,Storch D,et al.Hepatic macrophage migration and differentiation critical for liver fibrosis is mediated by the chemokine receptor C-C motif chemokine receptor 8 in mice[J].Hepatology,2012,55(3):898-909.
[26] Ehling J,Bartneck M,Wei X,et al.CCL2-dependent infiltrating macrophages promote angiogenesis in progressive liver fibrosis[J].Gut,2014,63:1960-1971.
[27] Baeck C,Wei X.Pharmacological inhibition of the chemokine C-C motif chemokine ligand 2(monocyte chemoattractant protein 1)accelerates liver fibrosis regression by suppressing Ly-6C(+)macrophage infiltration in mice[J].Hepatology,2014,59:1060-1072.
