红皮火龙果皮多糖过氧化氢脱色工艺及抑菌活性研究
2018-05-02方晓晖但德苗钱时权陆兆新
方晓晖 - 但德苗 - 钱时权 - 陆兆新 -
(1. 蚌埠学院食品与生物工程学院,安徽 蚌埠 233030;2. 南京农业大学食品科技学院,江苏 南京 210095)
红皮火龙果(Dragon fruit),又称红龙果、龙珠果等,属仙人掌科植物,果实营养丰富,富含多种活性物质,如甜菜苷、色素、植物多糖和酚醛树脂等[1],其中,植物多糖具有抑菌[2]、抗氧化[3]、免疫调节[4]和预防癌症[5]等生物活性。目前,有关红皮火龙果的研究主要集中在果皮色素和果胶的提取等方面[6]。
红皮火龙果皮含有大量色素,不利于植物多糖的分离和提取。目前,主要利用活性炭粉末、大孔树脂和过氧化氢等对多糖进行脱色[7]。采用活性炭脱色得到的多糖保留率较低,而采用过氧化氢进行脱色可有效使有色物质分解且不易复色,其多糖保留率也较高,成本低廉,试验过程简单[8-10]。由于红皮火龙果皮多糖含有较多色素,如何对得到的多糖进行有效脱色也有一定困难。目前国内外还没有利用过氧化氢对红皮火龙果皮多糖进行脱色的报道。本研究以红皮火龙果果皮为研究对象,采用过氧化氢对红皮火龙果皮多糖进行脱色,优化多糖脱色的工艺条件,并研究红皮火龙果皮多糖对细菌的抑菌活性,旨在为红皮火龙果副产物的有效利用提供技术参考。
1 材料与方法
1.1 材料与仪器
红皮火龙果:购自蚌埠当地超市;
30%过氧化氢、95%乙醇、石油醚、氯仿、正丁醇、苯酚、浓硫酸:分析纯,国药集团化学试剂有限公司;
大肠杆菌属(Escherichiacoli)、蜡样芽孢杆菌(Bacilluscereus)、枯草芽孢杆菌属(Bacillussubtilis)、金黄色葡萄球菌属(Staphylococcusaureus):蚌埠学院食品与生物工程学院实验室保存;
LB固体培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂20 g/L,pH 7.0,121 ℃灭菌20 min;
高速离心机:TGl16-C型,上海安亭科学仪器厂;
真空干燥箱:DZF-6050型,上海圣科仪器设备有限公司;
电热恒温培养箱:DHP-9272型,上海圣科仪器设备有限公司;
紫外可见分光光度计:752型,上海光学仪器厂;
电子分析天平:FA1204C型,上海精密仪器有限公司。
1.2 试验方法
1.2.1 红皮火龙果皮多糖的制备 将新鲜红皮火龙果洗净,手工剥取颜色新鲜、无明显疤痕的果皮于60 ℃干燥箱中干燥至恒重,粉碎过60目筛,得红皮火龙果皮干燥粉末。精确称取3.00 g红皮火龙果果皮粉末(含粗脂肪0.16%,蛋白质0.75%)置于索氏抽提器中进行脱脂[11],按照料液比1∶15(g/mL)的比例加入蒸馏水,于90 ℃提取1 h后,6 000 r/min离心10 min,得上清液。向上清液中加入3倍体积的95%乙醇,静置12 h,6 000 r/min离心10 min,保留沉淀,用95%乙醇洗涤沉淀3次,合并沉淀,得到粗多糖。将粗多糖沉淀溶于100 mL蒸馏水,按 4∶1 的体积比加入Sevag 试剂[12],使溶液充分混匀后,4 000 r/min离心5 min,进行脱蛋白(重复3次),向上清液中加入3倍体积的95%乙醇,静置12 h,6 000 r/min 离心10 min,收集沉淀,得到纯化后的多糖(粗脂肪和蛋白质彻底除去)。将多糖充分溶解于蒸馏水中得到多糖溶液。加入一定浓度的过氧化氢,置于恒温水浴锅中水浴脱色处理,6 000 r/min离心10 min,得上清液。向上清液中加入3倍体积的95%乙醇,静置12 h,6 000 r/min离心10 min,收集沉淀,经真空干燥后,得到红皮火龙果皮多糖粉末。多糖得率和多糖保留率分别按式(1)、(2)计算:
(1)
(2)
式中:
A——多糖得率,%;
m——多糖粉末的质量,g;
M——红皮火龙果皮粉末的质量,g;
B——多糖保留率,%;
X0——脱色前多糖得率,%;
X1——脱色后多糖得率,%。
1.2.2 单因素试验
(1) 过氧化氢浓度对多糖脱色的影响:取0.30 g红皮火龙果皮多糖干粉溶于50 mL蒸馏水中,加入浓度为2%,3%,4%,5%,6%,7%的过氧化氢溶液,置于60 ℃恒温水浴锅中脱色2 h后,在450 nm处测定吸光度,计算脱色率。每组试验重复3次。脱色率按式(3)计算:
(3)
式中:
C——脱色率,%;
A1——过氧化氢脱色前450 nm处火龙果皮多糖溶液的吸光度;
A0——过氧化氢脱色后450 nm处火龙果皮多糖溶液的吸光度。
(2) 脱色温度对多糖脱色的影响:设置脱色温度为50,55,60,65,70,75 ℃,固定过氧化氢浓度为4%,脱色时间为2 h,每组试验重复3次。考察脱色温度对多糖脱色率的影响。
(3) 脱色时间对多糖脱色的影响:设置脱色时间为60,80,100,120,140,160 min,固定过氧化氢浓度为4%,脱色温度为60 ℃,每组试验重复3次。考察脱色时间对多糖脱色率的影响。
1.2.3 Box-Behnken设计 结合单因素试验结果,在单因素试验的基础上,对影响火龙果皮多糖脱色的显著因素过氧化氢浓度、脱色温度和脱色时间进行响应面优化试验,以多糖脱色率为考察指标,进行Box-Behnken设计。
1.2.4 抑菌活性试验 将脱色后的红皮火龙果皮纯多糖完全溶解于无菌水中,配置成浓度为10,20,40,80 mg/mL多糖溶液,用0.22 μm滤膜过滤,备用。挑取供试菌(大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌和金黄色葡萄球菌)单菌落接入新鲜LB斜面培养基后,于37 ℃恒温培养24 h,用无菌生理盐水制成活细胞浓度为106CFU/mL的菌悬液备用。采用滤纸片扩散法进行抑菌活性测定[13]。取0.2 mL菌悬液均匀涂布于凝固的琼脂培养基中。将经不同浓度的红皮火龙果皮多糖溶液浸泡过的滤纸片,放置在含菌培养皿上,每个平皿放3片,并以浸泡过无菌生理盐水的滤纸片作为对照。每一种菌重复3次,每个浓度作5个平行。于37 ℃培养24 h后,测量抑菌圈直径。
红皮火龙果皮多糖对大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌和金黄色葡萄球菌最小抑菌浓度(MIC)的测定方法采用2倍稀释法[14]。在测定4种供试菌抑菌活性所需多糖浓度的基础上,将纯多糖完全溶解于无菌水中,配置成浓度为1.875,3.750,7.500,15.000,30.000,45.000,60.000,120.000 mg/mL 多糖溶液,过0.22 μm滤膜。分别取1.0 mL 不同浓度的多糖溶液和0.2 mL活细胞浓度为106CFU/mL的菌悬液加入到培养皿中,再倒入40 ℃左右的琼脂培养基,充分混匀,凝固后,于37 ℃倒置培养24 h。以不加多糖的琼脂培养基为对照,观察平板上菌落生长情况,无菌生长的最低浓度为红皮火龙果皮多糖的最小抑制浓度。每一种菌重复3次,每个浓度做5次平行。
2 结果与分析
2.1 过氧化氢脱色单因素试验
2.1.1 过氧化氢浓度的影响 由图1可知,当过氧化氢浓度从1%增加到4%时,红皮火龙果皮多糖的脱色率显著增加,而过氧化氢浓度由4%提高到6%时,多糖脱色率增加缓慢。由于高浓度的过氧化氢容易分解,因此在进行过氧化氢稀释时,尽量保持低温。稀释后的过氧化氢由于浓度下降而使反应速率降低,从而减缓了过氧化氢的分解,利于提高过氧化氢利用效率。综合考虑,取4%为适宜的过氧化氢浓度。

图1 过氧化氢浓度对多糖脱色的影响
Figure 1 Effect of the hydrogen peroxide concentration on decolorization of polysaccharide
2.1.2 脱色温度的影响 由图2可知,随着脱色温度的升高,多糖脱色率逐渐增加;50~60 ℃时,多糖脱色率显著增加,之后多糖脱色率增加不明显。考虑到红皮火龙果皮多糖在高温条件下活性可能会受损,选择60 ℃为适宜脱色温度。
2.1.3 脱色时间的影响 由图3可以看出,随着脱色时间的延长,多糖脱色率升高;60~100 min时,多糖脱色率显著增加,之后继续延长脱色时间,多糖脱色率不再增加。考虑到节能等因素,选择100 min为适宜的脱色时间。
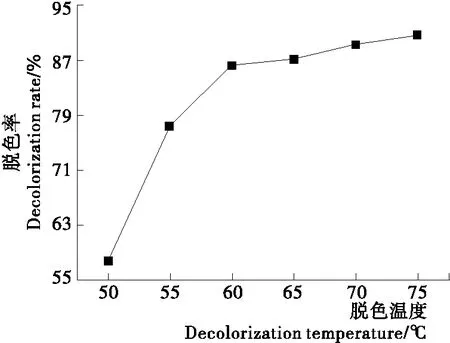
图2 脱色温度对多糖脱色的影响Figure 2 Effect of the decolorization temperature on decolorization of polysaccharide
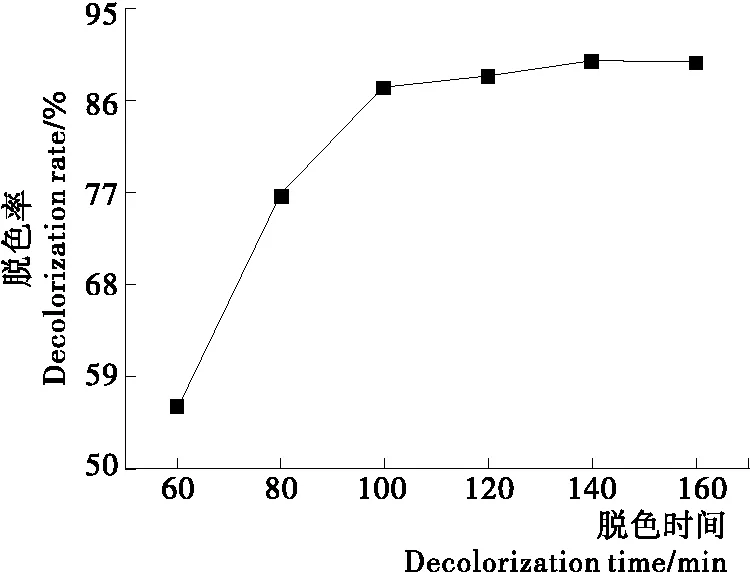
图3 脱色时间对多糖脱色的影响Figure 3 Effect of the decolorization time on decolorization of polysaccharide
2.2 响应面法优化过氧化氢脱色工艺
在单因素试验的基础上,选取过氧化氢浓度、脱色温度和脱色时间为自变量,以多糖脱色率为响应值,根据表1进行响应面试验设计,结果见表2。
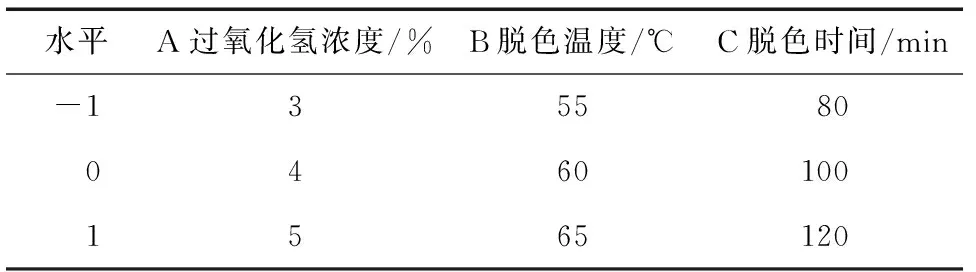
表1 因素水平表Table 1 Factors and levels
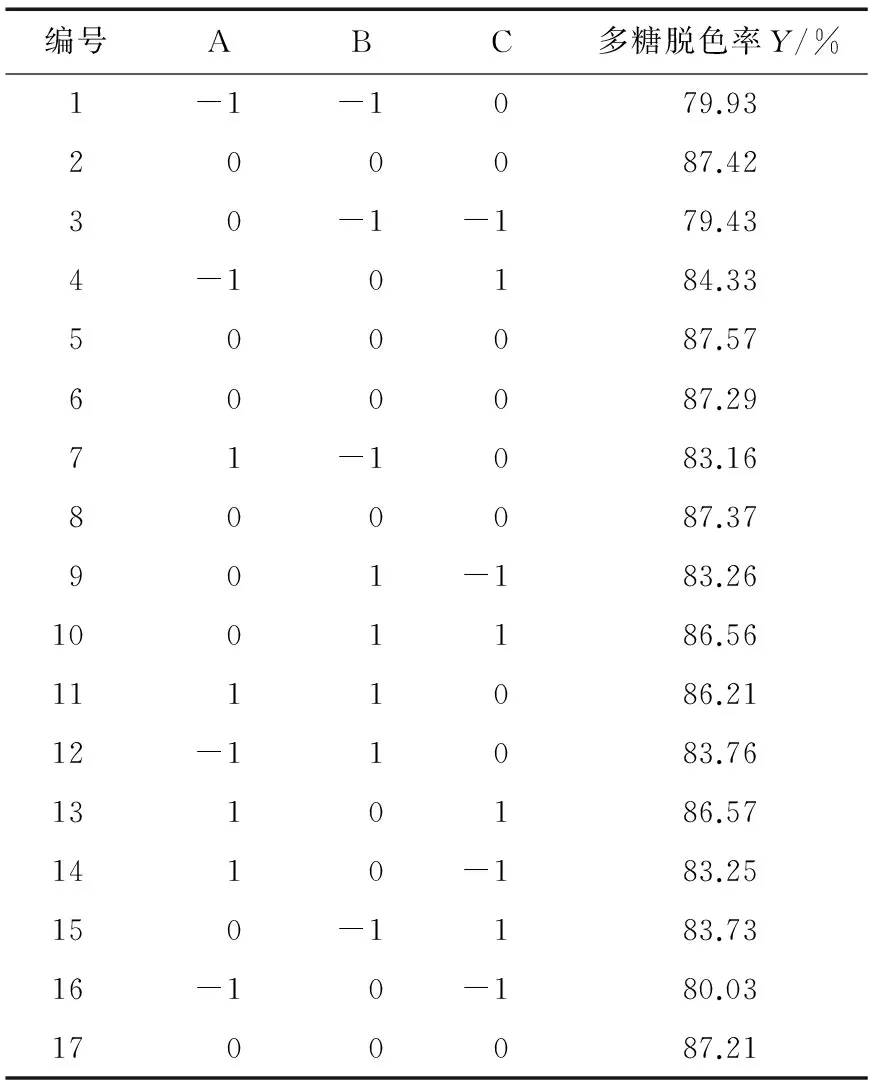
表2 响应面试验结果Table 2 Results ofresponse surface analysis
根据表2所得试验数据进行多元回归拟合,得到二次多项回归方程:
Y=-373.13+20.19A+11.32B+125C-0.04AB-0.01AC-2.5BC-1.9A2-0.09B2-4.81C2。
(4)
对表2的数据,进行方差分析,得到结果见表3。由表2、3可知,得到的模型(P<0.000 1)显著;失拟项不显著(P=0.879 7>0.05),表明该模型的拟合度较好;R2= 0.999 3,说明此模型能解释多糖脱色率99.93%的变异。一次项A、B和C极显著(P<0.000 1),表明过氧化氢浓度、脱色温度和脱色时间对多糖脱色率影响极显著。交互项(AB、AC、BC)和二次项(A2、B2、C2)影响均极显著(P<0.000 1),由F值大小可知,影响红皮火龙果皮多糖脱色率主要因素主次顺序为 C>B>A,即脱色时间>脱色温度>过氧化氢浓度。
2.3 响应面法分析
根据回归方程,得出过氧化氢浓度、脱色温度和脱色时间对多糖脱色率影响的响应面图和等高线图。由图4可知,当固定脱色时间不变时,红皮火龙果皮多糖的脱色率随过氧
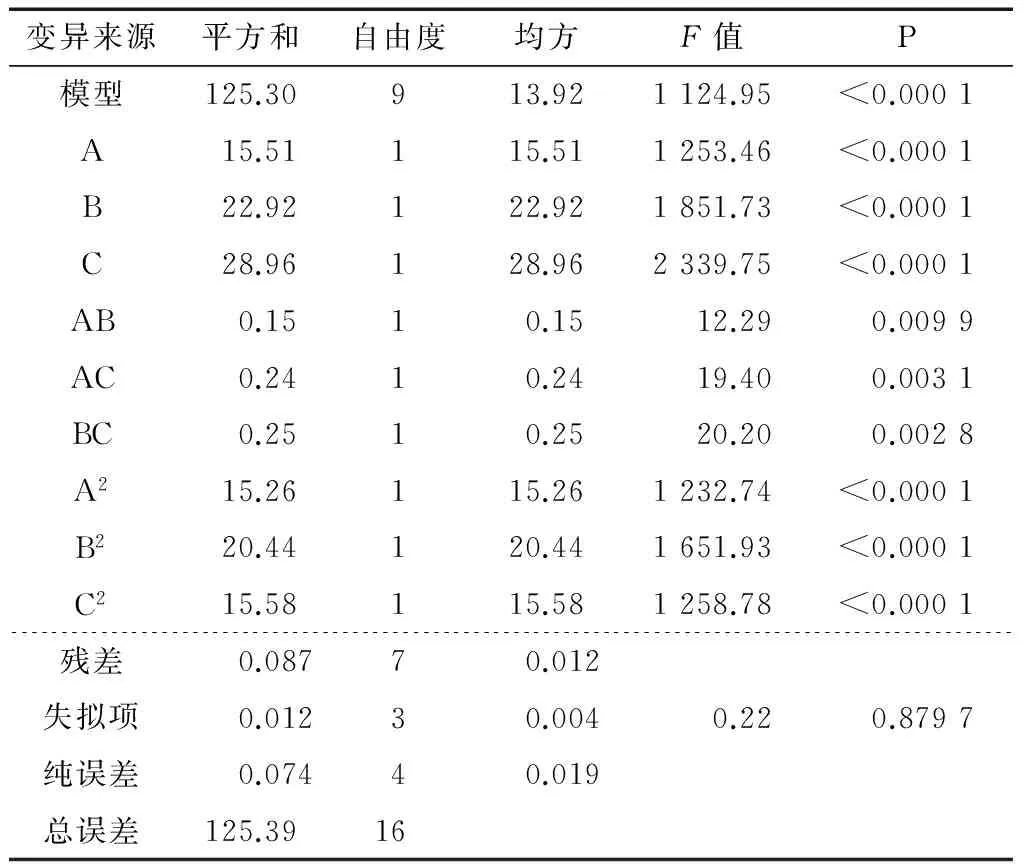
表3 方差分析表†Table 3 Variance analysis
化氢浓度和脱色温度的升高,表现为先升高后降低的趋势。图5表明,过氧化氢浓度和脱色时间对多糖的脱色率交互作用影响极显著。当固定脱色温度不变时,多糖脱色率随过氧化氢浓度的增加和脱色时间的延长,呈先升后趋于平缓的趋势。由图6可知,当固定过氧化氢浓度不变时,多糖脱色率随脱色温度和脱色时间的变化而变化,表现为先随脱色温度和脱色时间的增大而增大,当多糖脱色率达到一定值后不再增加。
通过对回归模型和响应面进行分析,确定采用过氧化氢对红皮火龙果皮多糖进行脱色的最佳工艺条件为:过氧化氢浓度4.32%,脱色温度61.72 ℃,脱色时间109.04 min,在该条件下红皮火龙果皮多糖的脱色率最大预测值为88.31%。考虑到实际试验条件,对最佳条件进行了调整:过氧化氢浓度4.3%,脱色温度62 ℃,脱色时间109 min,在该条件下进行验证实验,得到红皮火龙果皮多糖的实际脱色率为88.17%,平均误差为1.97%(n=3),实验值与理论值基本吻合。同时,测得红皮火龙果皮多糖保留率为82.39%,平均误差为1.52%(n=3)。结果表明该模型能有效预测过氧化氢对红皮火龙果皮多糖进行脱色的最佳工艺条件。
2.4 红皮火龙果皮多糖的抑菌活性
由表4可以看出,红皮火龙果皮多糖对4种供试菌都有一定的抑制作用,其抑菌活性随多糖浓度的增加而不断增强。

图4 过氧化氢浓度和脱色温度交互作用对多糖脱色率的影响Figure 4 Interaction effects of the hydrogen peroxide concentration (A) and the decolorization temperature (B) on the decolorization rate of the polysaccharide
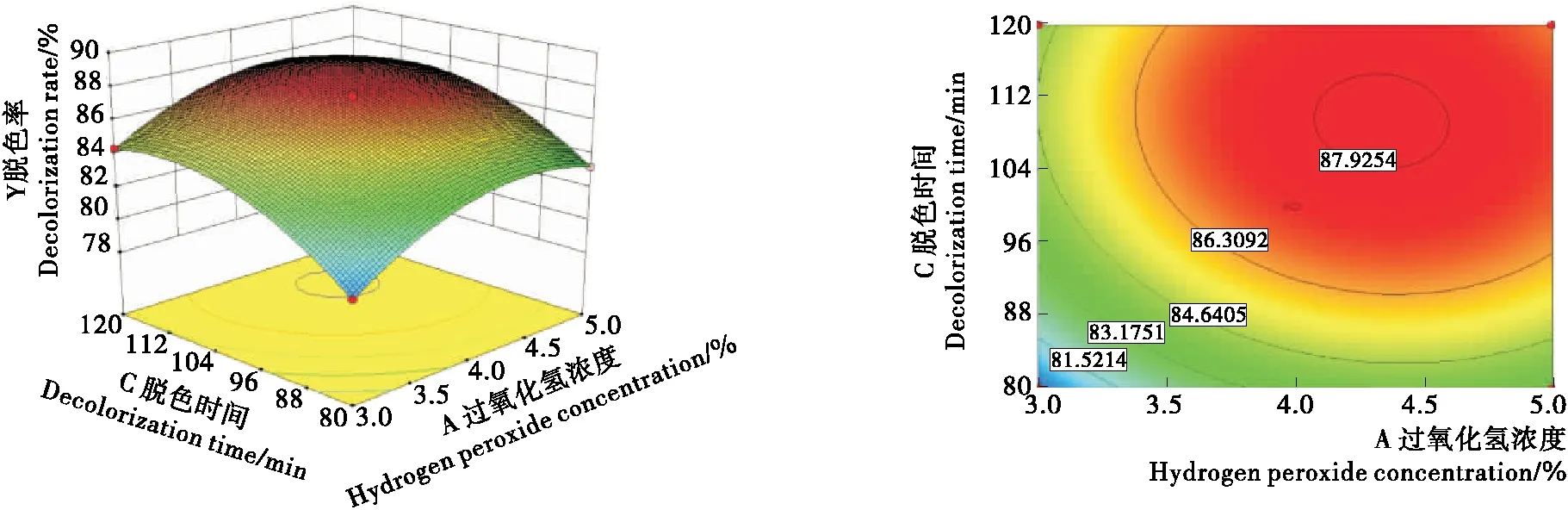
图5 过氧化氢浓度和脱色时间交互作用对多糖脱色率的影响Figure 5 Interaction effects of the hydrogen peroxide concentration (A) and the decolorization time (C) on the decolorization rate of the polysaccharide

图6 脱色温度和脱色时间交互作用对多糖脱色率的影响Figure 6 Interaction effects of the decolorization temperature (B) and the decolorization time (C) on the decolorization rate of the polysaccharide表4 红皮火龙果皮多糖的抑菌结果†Table 4 Antibacterial activity results of the polysaccharide from red dragon fruit peel
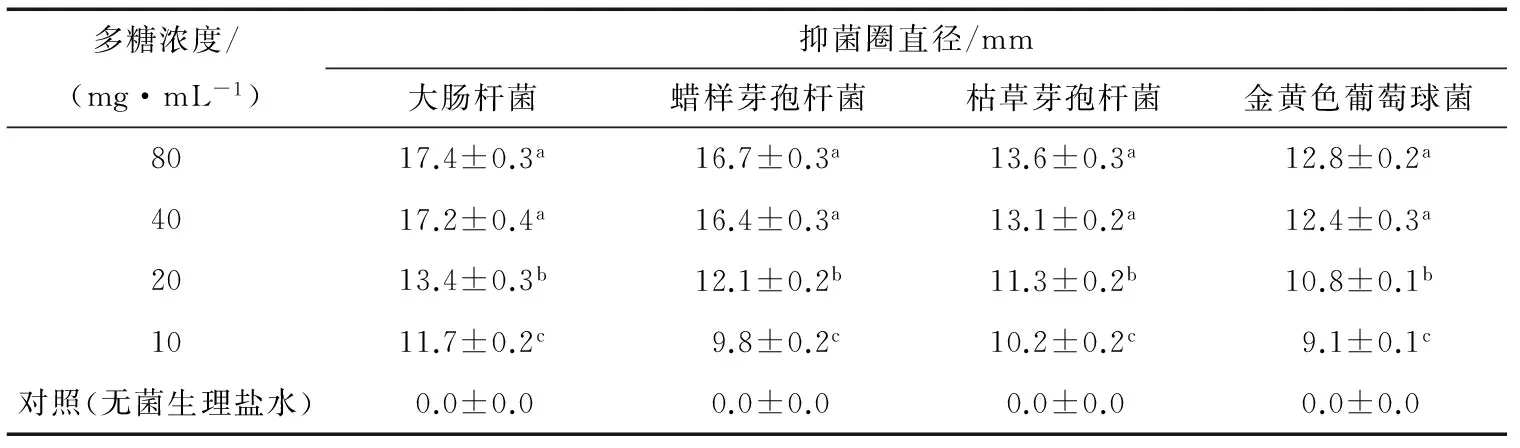
多糖浓度/(mg·mL-1)抑菌圈直径/mm大肠杆菌蜡样芽孢杆菌枯草芽孢杆菌金黄色葡萄球菌8017.4±0.3a16.7±0.3a13.6±0.3a12.8±0.2a4017.2±0.4a16.4±0.3a13.1±0.2a12.4±0.3a2013.4±0.3b12.1±0.2b11.3±0.2b10.8±0.1b1011.7±0.2c9.8±0.2c10.2±0.2c9.1±0.1c对照(无菌生理盐水)0.0±0.00.0±0.00.0±0.00.0±0.0
† 同列不同字母表示差异显著 (P<0.01)。
当红皮火龙果皮多糖浓度为20 mg/mL时,对大肠杆菌和蜡样芽孢杆菌抑制效果最好,抑菌圈分别为13.4,12.1 mm。当红皮火龙果皮多糖浓度为40 mg/mL时,红皮火龙果皮多糖对大肠杆菌和蜡样芽孢杆菌的抑菌圈直径均>15 mm,而对枯草芽孢杆菌和金黄色葡萄球菌的抑菌圈直径均<15 mm。总体来看,红皮火龙果皮多糖对大肠杆菌和蜡样芽孢杆菌的抑菌活性强于枯草芽孢杆菌和金黄色葡萄球菌。
由表5可知,红皮火龙果皮多糖对大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌和金黄色葡萄球菌都有不同程度的抑制作用。当培养基中多糖浓度为7.5 mg/mL时,未发现有大肠杆菌生长,因此确定大肠杆菌最小抑制多糖浓度为7.500 mg/mL。当培养基中多糖浓度为30.000 mg/mL时,金黄色葡萄球菌不再生长,因而金黄色葡萄球菌的最小抑菌浓度为30.000 mg/mL。当培养基中多糖浓度为45.000 mg/mL 时,蜡样芽胞杆菌和枯草芽孢杆菌不再生长,确定蜡样芽胞杆菌和枯草芽孢杆菌的最小抑制多糖浓度为45.000 mg/mL。
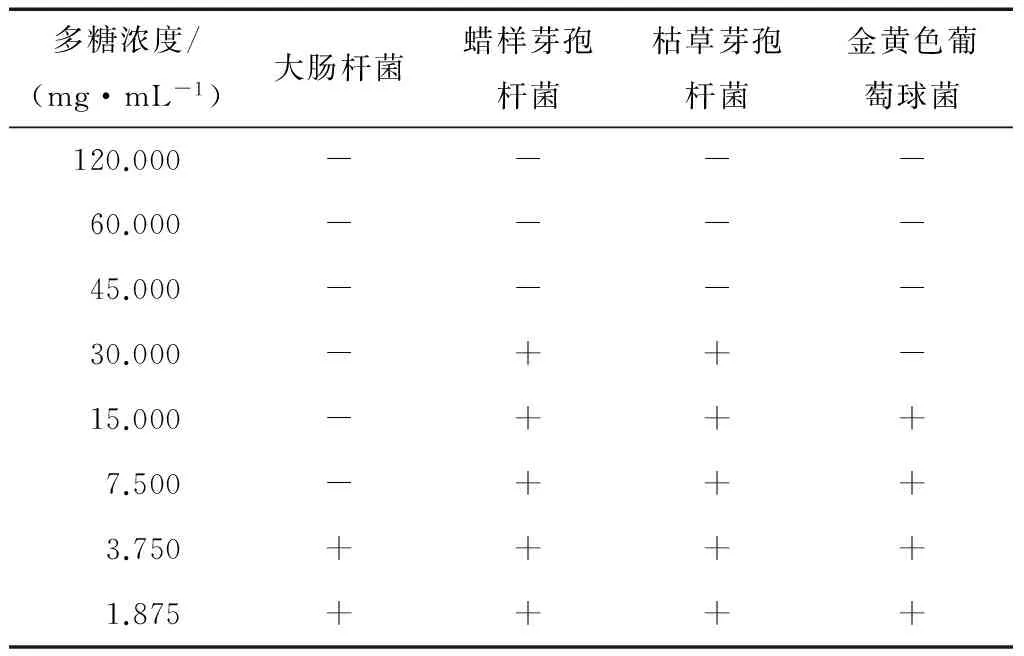
表5 红皮火龙果皮多糖的最小抑菌浓度†Table 5 Minimal inhibitory concentration (MIC) of the polysaccharide from red dragon fruit peel
† “+”表示有菌生长,“-”表示无菌生长。
3 结论
本试验以红皮火龙果为原料,采用过氧化氢对红皮火龙果皮多糖进行脱色,考察了过氧化氢浓度、脱色温度和脱色时间对红皮火龙果皮多糖脱色的影响,确定过氧化氢对红皮火龙果皮多糖进行脱色的最佳工艺条件为:过氧化氢浓度4.3%,脱色温度62 ℃,脱色时间109 min。红皮火龙果皮多糖脱色率为88.17%,红皮火龙果皮多糖保留率为82.39%。根据结果分析,采用过氧化氢法能对红皮火龙果皮多糖进行有效脱色,且多糖保留率较高。同时,如何进一步采用过氧化氢对红皮火龙果皮多糖脱色率和最大限度提高多糖保留率,仍有待进一步研究。另外,红皮火龙果皮多糖对大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌和金黄色葡萄球菌均有较好的抑制作用。这些结果证实,红皮火龙果皮多糖具有良好的杀菌作用,将红皮火龙果皮多糖进一步开发成食品添加剂具有良好的发展前景。
[1] XU Li-shan, ZHANG Yao-jie, WANG Li-zhi. Structure characteristics of a water-soluble polysaccharide purified from dragon fruit (Hylocereusundatus) pulp[J]. Carbohydrate Polymers, 2016, 146: 224-230.
[2] MENG Qing-ran, LI Ying-hao, XIAO Tian-cun, et al. Antioxidant and antibacterial activities of polysaccharides isolated and purified fromDiaphragmajuglandisfructus[J]. International Journal of Biological Macromolecules, 2017, 105: 431-437.
[3] WU Li-chen, HSU Hsiu-wen, CHEN Yun-chen, et al. Antioxidant and antiproliferative activities of red pitaya[J]. Food Chemistry, 2006, 95(2): 319-327.
[4] 梁英, 金迪, 李丹丹, 等. 黄芩多糖的免疫调节活性[J]. 中国食品学报, 2017,17(2): 23-27.
[5] HU Jie, JIA Xue-jing, FANG Xiao-bin, et al. Ultrasonic extraction, antioxidant and anticancer activities of novel polysacch-arides from Chuanxiong rhizome[J]. International Journal of Biological Macromolecules, 2016, 85: 277-284.
[6] 王雪, 丁金龙, 黄苇, 等. 火龙果皮中果胶的提取及其结构研究[J]. 中国食品添加剂, 2015(3): 102-106.
[7] 李敏晶, 刘昌雨, 刘远, 等. 3种脱色方法对多棘海盘车多糖的脱色效果[J]. 贵州农业科学, 2014(3): 147-149.
[8] 赵艳, 王白娟, 杨青松, 等. 红雪茶多糖过氧化氢脱色工艺优化[J]. 南方农业学报, 2016, 47(5): 710-714.
[9] 汪鹏荣, 陈文静, 韦凤, 等. 红曲多糖的过氧化氢法脱色工艺研究[J]. 浙江师范大学学报: 自然科学版, 2012, 35(2): 203-208.
[10] 石硕, 孙丽娜, 仙靓, 等. 神仙草叶多糖提取及过氧化氢脱色工艺研究[J]. 现代中药研究与实践, 2017, 31(3): 50-54.
[11] 韦媛媛, 刘阳, 龚帅, 等. 积雪草多糖的脱脂工艺研究[J]. 广西科技大学学报, 2014, 25(2): 90-94.
[12] 殷洪梅, 尚强, 萧伟. 金银花多糖脱蛋白方法的研究[J]. 中草药, 2010, 41(4): 584-586.
[13] 高洁, 董文宾, 王勇, 等. 山皂荚多糖的提取工艺及抑菌活性[J]. 食品与机械, 2017, 33(3): 145-149.
[14] 李彪, 董刚, 巩红冬, 等. 瑞香狼毒花多糖提取工艺优化及其抑菌活性研究[J]. 西藏大学学报: 自然科学版, 2017, 32(1): 17-25.
