鸡枞菌不同溶剂提取物成分分析及抗氧化作用研究
2018-05-02栗铭鸿李官浩朴守焕崔福顺
栗铭鸿 - 李官浩 - 朴守焕 - 崔福顺 -
(1. 延边大学农学院,吉林 延吉 133002;2. 延边百草药材有限公司,吉林 珲春 133300)
鸡枞菌[Termitomycesalbuminosus(Berk.)Heim],又名蚁枞、鸡丝菇、伞把菇等,属担子菌纲,伞菌目,口蘑科,蚁巢伞属[1]。鸡枞菌肉厚肥硕,质细丝白,味道鲜甜香脆;含有蛋白37.8%、脂肪5.1%[2-3],是一种高蛋白、低脂肪、低纤维的食用菌[4-5],并含有氨基酸、维生素和钙、磷、核黄酸等物质[6-7]。目前国内外对鸡枞菌的研究主要集中在多糖的提取[8-10];多糖的抗氧化[11-13]、降血脂[14]、免疫功能[15]、抗肿瘤[16]及其他生物活性[17-19]。而对鸡枞菌中其他生物活性物质含量、功能等研究较少。食用菌中常见的活性成分主要包括多糖、酚类、萜类等。近代研究发现食用菌中麦角甾醇、腺苷也具有很好的生物活性。Kang等[20]、高虹等[21]发现麦角甾醇具有很好的抑制肿瘤作用;Ye等[22]研究表明腺苷具有抗氧化作用。因此,本研究通过8种不同极性溶剂提取鸡枞菌,分析鸡枞菌提取物中4种活性物质及抗氧化作用,探讨其成分、含量与生物活性的关联性,为鸡枞菌进一步开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
鸡枞菌:2017年2月采集于延边大学农学院实验基地;
没食子酸标准品:97.5%,美国Sigma公司;
腺苷标准品:99.7%,中国食品药品检定研究院;
芦丁标准品:98%,上海源叶生物科技有限公司;
DPPH、ABTS、福林酚试剂、过硫酸钾等:≥98%,美国Sigma公司;
乙腈:色谱级,美国Mreda公司;
其他试剂为分析纯。
1.2 仪器与设备
紫外可见分光光度计:UV-1800型,上海美谱达仪器有限公司;
高效液相色谱仪:LC-2010型,日本岛津仪器有限公司;
大容量速冻离心机:Z400K型,德国哈默有限公司;
电热恒温鼓风干燥箱:DHG-90731型,上海新苗医疗器械制造有限公司;
冷冻干燥机:FD-1A型,北京博医康试验仪器有限公司。
1.3 方法
1.3.1 提取物制备及得率计算 将采集的鸡枞菌去根土、干燥、粉碎、过20目筛。称重后以料液比1∶12 (g/mL)分别加入8种不同极性溶剂(蒸馏水、甲醇、无水乙醇、丙酮、乙酸乙酯、正己烷、正丁醇和石油醚),混匀,摇床振荡提取(摇床转速110 r/min,温度50 ℃)6 h,于4 000 r/min离心20 min,过滤;滤渣中加入溶剂再提取1次;合并滤液,用相应溶剂定容制得提取液。一部分用于含量测定及抗氧化试验;另称取3份等体积各自恒温(50 ℃)干燥至恒重,称量质量,按式(1)计算提取物得率。
(1)
式中:
w——提取物得率,%;
m1——浓缩干燥样品和平皿的质量,g;
m2——平皿的质量,g;
m3——折算的原料质量,g。
1.3.2 功效成分含量的测定
(1) 总黄酮:参照文献[23]的方法,以芦丁为标准品,绘制标准曲线,并测定样品中总黄酮含量。得到的标准曲线方程为:y=0.002 9x+0.005 2,R2=0.998 3。总黄酮含量以mg RTE/g 表示。
(2) 总酚:参照文献[24]的方法,以没食子酸为标准品,绘制标准曲线,并测定样品中总酚含量。得标准曲线方程为:y=0.015x-0.074 1,R2=0.997 6。总酚含量以mg GAE/g 表示。
(3) 麦角甾醇:采用HPLC法。色谱条件:色谱柱:InerSustain®C18(4.6 mm×150 mm,5 μm),流速:0.8 mL/min,检测波长:283 nm,进样量10 μL,柱温:30 ℃,流动相:甲醇,等浓度洗脱[20]。
标准曲线的制作:精密称取0.175 mg标准品,用甲醇溶解并定容至10 mL,吸取1 mL过0.45 μm滤膜,备用。分别设定进样量为5,10,15,20 μL,在上述色谱条件下测定麦角甾醇峰面积;并且以标准品溶液进样量(x)为横坐标,得到的峰面积积分值(y)为纵坐标绘制标准曲线,得到的标准曲线方程为:y=303 142x+2 232.3,R2=0.999 9。
(4) 腺苷含量:采用HPLC法。色谱条件:色谱柱:InerSustain®C18(4.6 mm×150 mm,5 μm),流速:0.8 mL/min,检测波长:260 nm,进样量10 μL,柱温:30 ℃,流动相:A:15%甲醇;B:85%水,等浓度洗脱[25]。
标准曲线的制作:精密称取0.19 mg腺苷标准品,用流动相溶解,并定容于10 mL容量瓶中。吸取1 mL过0.45 μm 滤膜,备用。分别设定进样量为2,4,6,8,10 μL,在上述色谱条件下测定峰面积,以标准品溶液进样量(x)为横坐标,得到的峰面积积分值(y)为纵坐标绘制标准曲线,得到标准曲线方程为:y=200 039x-27 756,R2=0.997 2。
1.3.3 抗氧化活性的测定
(1) 总抗氧化能力:参照文献[11]。
(2) DPPH·清除能力:参照文献[23]。
(3) ABTS+·清除能力:参照文献[13]。
(4) 羟自由基清除能力:采用水杨酸法[12]。
(5) 总还原力:参照文献[11]。
1.4 数据处理
数据采用SPSS 17.0软件进行方差分析并进行LSD多重比较,所有测定进行3次重复。
2 结果与分析
2.1 提取物得率及活性成分含量
提取物得率及成份含量结果见表1。由表1可知,极性溶剂中蒸馏水的提取物得率、总酚及腺苷含量最高;正己烷提取物中总黄酮含量最高;甲醇提取物中麦角甾醇含量最高。
不同极性溶剂提取物中总酚呈现出溶剂极性越大,含量越高的趋势。总酚含量大小依次为蒸馏水>甲醇>乙醇>丙酮>正丁醇>乙酸乙酯>正己烷=石油醚。可以推断鸡枞菌中酚类主要以极性酚为主。这与涂宗财等[23]研究红薯叶不同极性溶剂与提取物总酚含量的结论一致。卢彩会等[26]研究黑皮鸡枞菌时也得出水提物多酚含量(5.50 mg/g)大于醇提物,且含量高于本研究结果,可能是品种、产地等差异造成的。
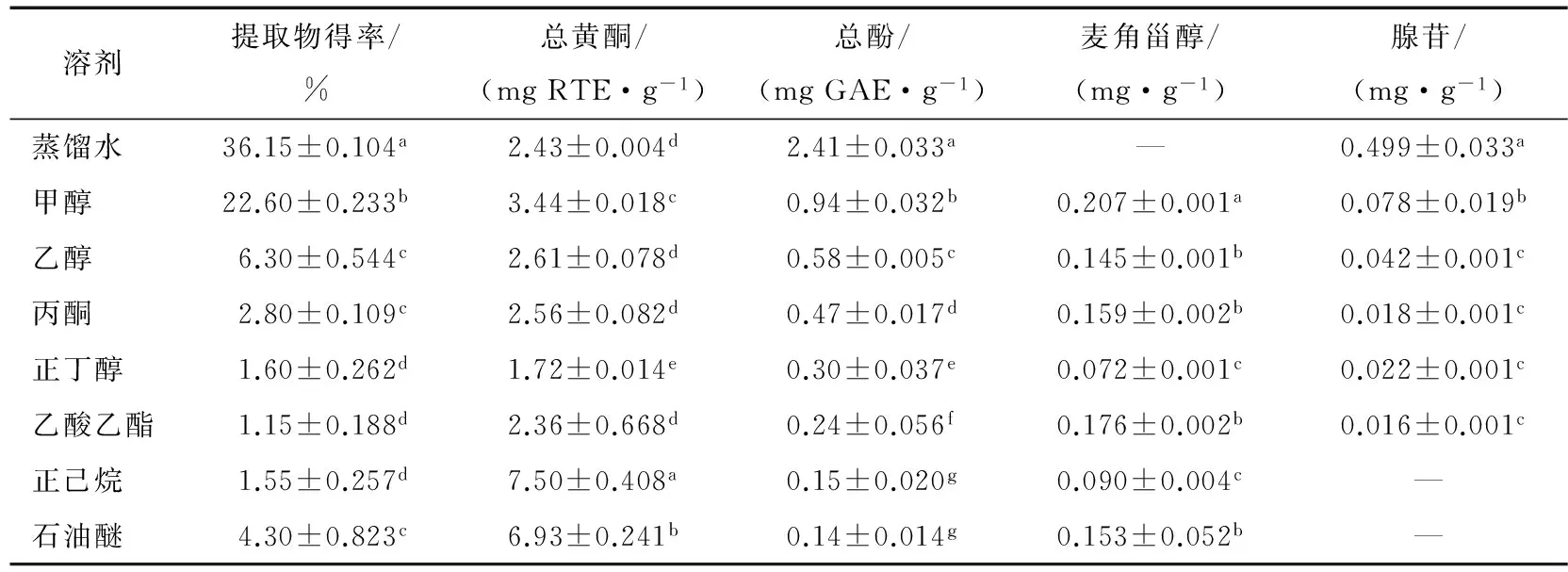
表1 不同极性溶剂提取物得率及成分含量†Table 1 The yield and content of different solvent extracts
† 同列不同字母表示差异显著P<0.05。
不同极性溶剂提取物中总黄酮含量大小依次为正己烷>石油醚>甲醇>蒸馏水=乙醇=丙酮=乙酸乙酯>正丁醇。极性最弱的正已烷和石油醚提取物中总黄酮含量最高;中等极性的正丁醇提取物中总黄酮含量最低。说明鸡枞菌中总黄酮主要以弱极性为主。卢彩会等[26]研究得出70%醇提物中黄酮含量为23.1 mg/g,而水提物中为0 mg/g,与本研究结果不一致。
不同极性溶剂提取物中麦角甾醇含量大小依次为甲醇>乙酸乙酯=丙酮=乙醇=石油醚>正己烷=正丁醇。在甲醇提取物中含量最高,蒸馏水提取物中没有检出。这与麦角甾醇易溶于甲醇,不溶于水相符。可以得出鸡枞菌不同极性溶剂提取物中麦角甾醇含量与极性大小没有相关性。不同极性溶剂提取物中腺苷含量最高的为极性较大的蒸馏水和甲醇;弱极性石油醚和正已烷中没有检出;其他溶剂提取物中含量较少,差异不显著。这与腺苷易溶于极性溶剂相符。高赏[27]在鸡枞菌代谢产物中分离鉴定了麦角甾醇和腺苷,并证明麦角甾醇具有较好的抑菌活性。
2.2 抗氧化作用
2.2.1 总抗氧化能力 在酸性条件下,抗氧化活性物质可以将Mo6+还原为Mo5+,随即Mo5+与磷酸形成磷酸-Mo5+的绿色复合物;体系颜色越深,吸光度会越大,说明抗氧化活性就越高。由图1可知,随着溶剂极性的减弱,吸光度值也呈下降趋势,鸡枞菌总抗氧化能力越来越弱。蒸馏水和甲醇提取物的抗氧化活性较高;蒸馏水提取物的总抗氧化能力与浓度0.25 mg/mL的 VC和0.40 mg/mL的 BHA相当。
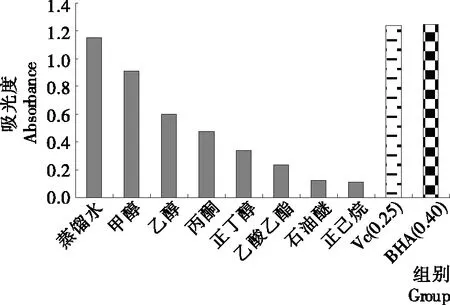
图1 不同极性溶剂提取物的总抗氧化能力Figure 1 The antioxidant capacity of extracts from different polar solvents
2.2.2 DPPH·清除能力 DPPH作为一种稳定的自由基,其醇溶液呈紫色,并在波长517 nm处有强吸收。当反应体系中有自由基清除剂存在时与DPPH单电子配对而使其颜色变浅,以此可用分光光度法进行定量分析。鸡枞菌不同极性溶剂提取物对DPPH·清除效果见图2。由图2可知,随着溶剂极性变小,清除率也随着下降;乙酸乙酯提取物清除率最低;随后弱极性溶剂石油醚和正己烷提取物的清除率又呈现上升的趋势。蒸馏水提取物对 DPPH·的清除率最好,与浓度为0.10 mg/mL VC的清除效果相当,高于浓度为0.10 mg/mL 的BHA;甲醇提取物也表现出较好的清除效果。对DPPH·清除率大小依次为蒸馏水=0.10 mg/mL VC>0.10 mg/mL BHA>甲醇>0.01 mg/mL VC>乙醇>0.01 mg/mL BHA>正己烷>石油醚=丙酮=正丁醇>乙酸乙酯。这个顺序与不同极性溶剂中总酚含量的顺序基本一致;但不同于总黄酮含量排序。由此可以推测,DPPH·的清除效果可能与总黄酮含量无关,而与总酚含量有关;还有可能是提取物中酚类物质不同,或还有多糖类等其他成分在起作用。
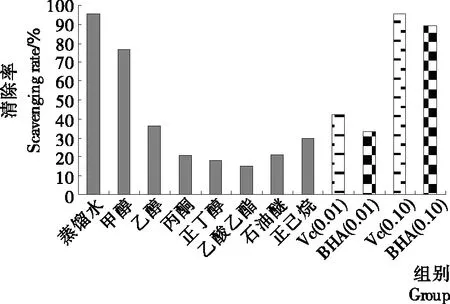
图2 不同极性溶剂提取物对DPPH自由基清除作用Figure 2 Scavenging effect on DPPH of different polar solvent extracts
2.2.3 ABTS+·清除能力 ABTS在氧化剂作用下会氧化成绿色的ABTS+·,当有抗氧化剂存在时,ABTS+·的产生会被抑制,颜色发生变化。鸡枞菌不同极性溶剂提取物对ABTS+·清除作用见图3。由图3可知,不同极性提取物对ABTS+·清除率大小依次为0.10 mg/mL VC=蒸馏水=0.10 mg/mL BHA=甲醇>0.03 mg/mL VC>0.03 mg/mL BHA>乙醇>正丁醇>丙酮>石油醚=乙酸乙酯>正己烷。结果按极性可分为三部分,极性大的蒸馏水和甲醇提取物清除效果最好,与0.10 mg/mL VC效果相当;中等极性溶剂清除效果一般;极性小的石油醚等清除效果最差。总体上呈现出溶剂极性越大,提取物清除能力越强。这与鸡枞菌中总酚含量的顺序也基本一致。
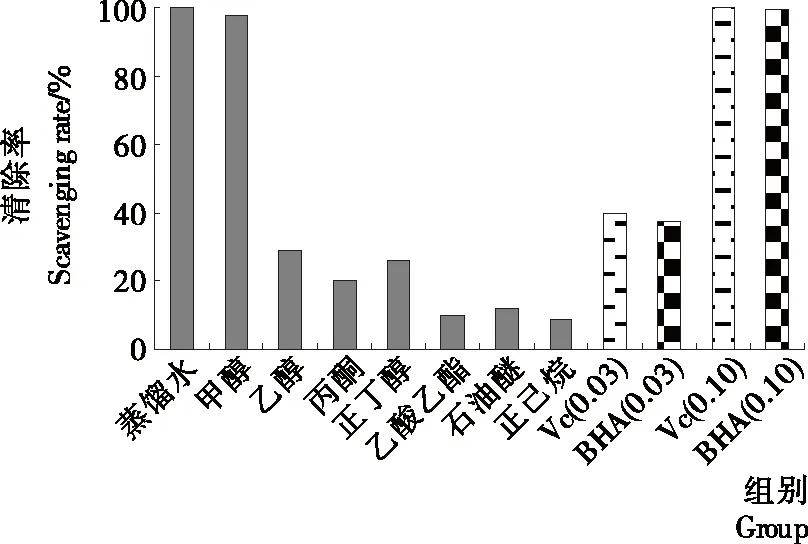
图3 不同极性溶剂提取物对ABTS+·清除作用Figure 3 Scavenging effect on ABTS+· of different polar solvent extracts
2.2.4 羟自由基清除能力 水杨酸法是利用亚铁离子与过氧化氢混合后产生羟自由基,而加入到反应体系中的水杨酸可以捕捉羟自由基,并且会产生有色的产物。若加入到反应体中的样品具有可以清除羟自由基的作用时,会与体系中水杨酸争夺羟自由基,降低有色产物的生成量,颜色变浅。不同极性溶剂提取物对羟自由基清除作用见图4。由图4可知,不同溶剂对羟自由基清除大小依次为0.4 mg/mL VC=蒸馏水>0.2 mg/mL VC>甲醇>石油醚=乙酸乙酯=8.0 mg/mL BHA>3.0 mg/mL BHA=正己烷>丙酮>正丁醇>乙醇。溶剂中极性最大的蒸馏水具有最好的清除羟自由基的能力,与0.4 mg/mL VC效果相当;极性小的石油醚等清除效果次之;而中等极性的溶剂清除效果最差。

图4 不同极性溶剂提取物对羟自由基清除作用Figure 4 Scavenging effect on hydroxyl radicals of different polar solvent extracts
2.2.5 总还原能力 铁氰化钾法是利用当反应体系中有抗氧化剂时,会使复合物中的Fe3+变成为Fe2+,而Fe2+复合物在波长700 nm处有最大吸收。因此,吸光度值越大,说明还原能力越强。由图5可知,随着溶剂极性的减弱,吸光度值也呈下降的趋势,鸡枞菌总还原能力越来越弱。不同极性溶剂中总还原能力大小依次为0.10 mg/mL VC=蒸馏水>0.25 mg/mL BHA>甲醇>乙醇>丙酮>石油醚正丁醇>正己烷=乙酸乙酯。蒸馏水提取物的吸光度大,总还原能力强,与0.10 mg/mL VC相当。这与鸡枞菌中总酚含量的顺序也基本一致。
综合以上结果可以得出,鸡枞菌不同溶剂提取物抗氧化作用溶剂极性越大,提取物清除能力越强;溶剂极性越小,提取物清除能力越弱。抗氧化能力与总酚含量呈正相关;麦角甾醇和腺苷在极性较大的甲醇提取物中含量很高。可以预测,鸡枞菌中主要活性成分为极性大的物质。Fedia等[28]、肖星凝等[29]研究发现,食用菌中麦角甾醇和酚类含量较高时表现出更好的抗氧化活性。这与本研究结果相一致。

图5 不同极性溶剂提取物总还原能力Figure 5 The reducing power of different polar solvent extracts
3 结论
通过对鸡枞菌8种不同极性溶剂提取物中生物活性成分及其抗氧化活性进行分析,得出鸡枞菌不同极性溶剂提取物中得率最高的为蒸馏水提取物(36.150%);不同极性溶剂提取物中总黄酮、总酚、麦角甾醇、腺苷含量最高的分别为正己烷提取物(7.500%)、蒸馏水提取物(2.410%)、甲醇提取物(0.207%)及蒸馏水提取物(0.499%)。说明鸡枞菌中生物活性成分总酚、麦角甾醇及腺苷等更易溶于极性大的溶剂中;同时溶剂极性不同,抗氧化能力也不同;溶剂极性越大,抗氧化能力越强。因此,可以选择极性大的溶剂对鸡枞菌中的抗氧化成分进行提取及开发利用。
目前对鸡枞菌抗氧化作用的研究主要集中在多糖,而其他活性成分与抗氧化性间的相互关系还少见报道。本试验得出不同极性溶剂提取物的综合抗氧化能力与总酚含量呈正相关;极性大的提取物中还含有较高的麦角甾醇、腺苷等活性成分;总黄酮含量与溶剂极性及抗氧化能力无关。说明鸡纵菌抗氧化作用不能只用单一物质含量进行衡量,值得进一步研究。
[1] YANG Fang, XU Bo, ZHAO San-jun, et al. De novo sequencing and analysis of the termite mushroom (Termitomycesalbuminosus) transcriptome to discover putative genes involved in bioactive component biosynthesis[J]. Journal of Bioscience and Bioengineering, 2012, 114(2): 228-231.
[2] 肖洋, 李祝, 施渺筱. 粗柄鸡枞菌子实体不同部位营养成分及重金属测定[J]. 中国酿造, 2014, 33(4): 142-144.
[3] OGUNDANA S K, FAGADE O E. Nutritive value of some Nigerian edible mushrooms[J]. Food Chemistry, 1982, 8(4): 263-268.
[4] 张灵芝, 陈健. 鸡枞菌子实体成分的分析与测定[J]. 食品工业科技, 2012(7): 358-361.
[5] GERMAIN K, DOMINIQUE C M, ALAIN B S, et al. Nutrient content of some mushroom species of the genusTermitomycesconsumed in Cameroon[J]. Nahrung-Food, 2003, 47(3): 213-216.
[6] 邹立扣, 潘欣, 岳爱玲, 等. 四川省鸡枞菌氨基酸组成及硒元素含量分析[J]. 食品科学, 2011, 32(14): 245-248.
[7] 施渺筱, 杨坤耀, 李祝, 等. 粗柄鸡枞菌子实体中氨基酸成分测定[J]. 食品研究与开发, 2013(14): 85-87.
[8] 李陈雪, 曹赢, 曲炳楠, 等. 四种提取方法提取黑鸡枞菌多糖的对比分析研究[J]. 哈尔滨商业大学学报: 自然科学版, 2016, 32(4): 403-405.
[9] 吴素蕊, 严明, 张鑫, 等. 响应面法优化水提黑皮鸡枞菌多糖工艺[J]. 食品工业, 2016, 37(5): 169-172.
[10] 孙凯, 郭晓萌, 牟德华, 等. 双正交法优化醇洗-水提黑皮鸡枞菌多糖的研究[J]. 食品工程, 2016(2): 35-38, 41.
[11] 周继平, 许泓瑜. 鸡枞菌粉不同组分的体外抗氧化活性研究[J]. 中国野生植物资源, 2008, 27(5): 46-49.
[12] 张恒, 郑俏然, 李敏. 响应面法优化超声波辅助提取鸡枞菌多糖及其抗氧化活性研究[J]. 食品与发酵科技, 2017, 53(2): 13-18, 121.
[13] MAU Jeng-leun, CHANG Chieh-no, HUANG Shih-jeng, et al. Antioxidant properties of methanolic extracts from Grifola frondosa, Morchella esculenta andTermitomycesalbuminosusmycelia[J]. Food Chemistry, 2004, 87(8): 111-118.
[14] ZHAO Hua-jie, LI Shang-shang, ZHANG Jian-jun, et al. The antihyperlipidemic activities of enzymatic and acidic intracellular polysaccharides byTermitomycesalbuminosus[J]. Carbohyd-rate Polymers, 2016, 151(10): 1 227-1 234.
[15] 梁月琴, 罗放灵, 王崇静, 等. 鸡枞菌对小鼠免疫功能的调节作用[J]. 云南医药, 2015(6): 584-586.
[16] 张灵芝. 鸡枞菌子实体多糖分离纯化与结构分析及抗肿瘤活性研究[D]. 广州: 华南理工大学, 2012: 50.
[17] QI Jian-hua, OJIKA Makoto, SAKAGAMI Youji. Termitomycesphins A-D, novel neuritogenic cerebrosides from the edible chinese mushroomTermitomycesalbuminosus[J]. Tetrahe-dron, 2000, 56(32): 5 835-5 841.
[18] QI Jian-hua, OJIKA Makoto, SAKAGAMI Youji. Neuritog-enic cerebrosides from an edible chinese mushroom Part 2: structures of two additional termitomycesphins and activity enhancement of an inactive cerebroside by hydroxylation[J]. Bioorganic & Medicinal Chemistry, 2001, 9(8): 2 171-2 177.
[19] HU Yuan-yuan, WANG Tong, YANG Xing-bin, et al. Analy-sis of compositional monosaccharides in fungus polysaccharides by capillary zone electrophoresis[J]. Carbohydrate Polymers, 2014, 102(1): 481-488.
[20] KANG Ju-hee, JANG Jeong-eun, MISHRA S K, et al. Ergosterol peroxide from Chaga mushroom (Inonotus obliquus) exhibits anti-cancer activity by down-regulation of theβ-catenin pathway in colorectal cancer[J]. Journal of Ethnopharmaco-logy, 2015, 173: 303-312.
[21] 高虹, 史德芳. 巴西菇麦角甾醇抗肿瘤活性及作用机理初探[J]. 中国食用菌, 2011, 30(6): 35-39.
[22] ZHANG Ye-ni, SONG Min,TZI Bun Ng, et al. Purification and characterization of antioxidant components from the fruiting bodies of Pleurotus abalonus including 9-beta-d-ribofuranosidoadenine, 5′-deoxy-5′-(methylthio)adenosine, and a triterpenoid[J]. Environmental Toxicology and Pharmacology, 2013, 36(2): 689-696.
[23] 涂宗财, 傅志丰, 王辉, 等. 红薯叶不同溶剂提取物抗氧化性及活性成分鉴定[J]. 食品科学, 2015, 36(17): 1-6.
[24] MUSTAFA Özyürek, MUSTAFA Bener, KUBILAY Güçlü, et al. Antioxidant/antiradical properties of microwave-assisted extracts of three wild edible mushrooms[J]. Food Chemistry, 2014, 157(15): 323-331.
[25] 于士军, 柴新义, 樊美珍. 蝉花菌质主要营养成分和活性成分分析[J]. 食品与机械, 2015, 31(1): 155-158.
[26] 卢彩会, 郭晓萌, 牟德华. 黑皮鸡枞菌水提物和醇提物的主要成分及抗氧化性研究[J]. 食品工程, 2016(3): 35-40, 57.
[27] 高赏. 药食用真菌代谢产物的活性研究[D]. 贵阳: 贵州医科大学, 2016: 21-22.
[28] FEDIA Souilem,NGELA Fernandes, RICARDO C, et al. Wild mushrooms and their mycelia as sources of bioactive compounds: Antioxidant, anti-inflammatory and cytotoxic proper-ties[J]. Food Chemistry, 2017, 230: 40-48.
[29] 肖星凝, 袁娅, 廖霞, 等. 食用菌抗氧化活性成分及其抗氧化作用机制研究进展[J]. 食品与机械, 2016, 32(11): 207-211.
