杂交鲟腹水症的病理学诊断
2018-05-02黄小丽汪开毓
黄小丽,冯 杨,成 霞,汪开毓
(1.四川农业大学动物科技学院,成都 611130;2.四川农业大学动物医学院,成都 611130)
杂交鲟(hybrid sturgeon),属鲟形目(Acipenseriformes)、鲟科(Acipenseridae)、鲟属(Acipenser)。养殖杂交鲟主要是施氏鲟(Acipenser schrencki)、西伯利亚鲟(Acipenser baeri)和俄罗斯鲟(ipenser guldenstadti)的杂交后代[1],也有的为施氏鲟与东北鳇鱼(Huso dauricus)或施氏鲟和西伯利亚鲟的杂交后代。杂交鲟因适应性强、生长速度快、性成熟早、后代可育、遗传性状较稳定等特点,已成为深受欢迎的鲟养殖品种。但是随着中国鲟工厂化、高密度化养殖,各种疾病频频发生,卵霉病、败血病、肿嘴病、锥虫病、小瓜虫病(又称白点病)、气泡病和腹水症等疾病的发生严重影响了鲟产业的发展[2]。
腹水症是以腹水为主要临床特征的一大类鱼类疾病的总称。可在包括黄颡鱼(Pelteobagrus fulvidraco)[3]、大菱鲆(Scophthalmus maximus)[4]和鲟(Acipensers)[5]等在内的多种水生动物上出现。该病多发生在高温季节,可引起鲟大批量死亡。病鱼临床症状主要表现为独游、浮游、无力、停食、腹部膨胀;解剖病鱼可见腹腔内积有大量淡黄色或清亮透明的腹水。多种因素均可引起鱼类腹水症,包括细菌性因素,如嗜水气单胞菌(Aeromonas hydrophila)[6]、拟态弧菌(Vibrio mimicus)[7];病毒性因素,如呼肠弧病毒(CCV)[8]、Sorimachi[9];寄生虫性因素,如隐鞭虫(Cryptobia)[10]、艾美球虫(Eimeria)[9];营养性因素,如维生素E缺乏[11];其他因素,如土霉素不合理长期使用,严重时可引起腹水[12]等。2015年四川某鲟养殖场养殖的杂交鲟(施氏鲟♂×西伯利亚鲟♀)出现腹水的症状。该养殖场共有杂交鲟4万余尾,患病杂交鲟体长10~15 cm,送样时已有半月的发病期,开始时每日死亡20~30尾,至送样时已达每日200尾左右,每天死亡率约为1.5%。发病后养殖户采用1 g/kg的恩诺沙星混合1.5 g/kg的氟苯尼考拌料喂,未见明显疗效。病鱼临床症状主要表现为独游、游动无力、食欲降低或停食、张口呼吸等。本次研究采用临床诊断、病原学、病理学对该病病因进行分析,以期为类似疾病的防控提供参考借鉴。
1 材料和方法
1.1 试验动物
患病濒死杂交鲟4尾(10~15 cm),来自四川某鲟养殖场,具有典型腹腔积水症状,用于剖检观察、病料采集和病原菌分离。
1.2 剖检观察
用MS-222将送检鱼麻醉后用于剖检。首先检查病鱼体表完整性及其他体表症状,同时取少量鳃丝、体表黏液于载玻片上,压片后显微镜下观察有无寄生虫。之后打开口咽腔、围心腔、腹腔,依次观察各体腔黏膜情况及各内脏器官大体病理表现。最后取肠道内容物压片,观察有无寄生虫感染。
1.3 细菌学检查
利用75%的乙醇体表消毒后,在无菌条件下分别从送检鱼的肝脏、脾脏、肾脏中用铂金环接种细菌至BHI琼脂培养基。分别于15℃和25℃下恒温培养,连续观察1周,确定细菌的生长情况。
1.4 病毒学检测
选取病变明显的脾脏和肝脏组织,各取一小块进行混合匀浆,滤菌后加入含青、链霉素的Hanks液,12000r/min,离心5min后取上清液作为接种物接种胖头鲤肌肉细胞系(FHM),25℃培养7后观察细胞病变。
1.5 病理学检查
分别采取患病鱼的鳃、体侧肌肉、心、肝、肾、脾、脑、胃、肠道、鳔、眼睛等组织,用10%的中性甲醛固定,石蜡包埋,常规切片(5 μm),H·E 染色,中性树胶封片,光学显微镜下观察病理损伤,并照相记录。对H·E染色下病变明显的组织,用油镜观察细菌形态。
2 结果与分析
2.1 病史及临床症状
患病杂交鲟为池塘养殖模式下人工养殖的商品鱼,体长10~15 cm。病鱼临床症状主要表现为病鱼摄食减少或者停食,鱼体消瘦,游动缓慢、无力,常独自弋游在水面或垂直悬浮于水面,对外界刺激反应迟钝,呼吸困难,有的明显可见腹部膨胀,积有腹水,侧翻或腹部上翻,张口呼吸。发病水温为25℃。发病后曾投喂恩诺沙星、氟苯尼考,未见明显疗效。
2.2 尸检及病理学观察
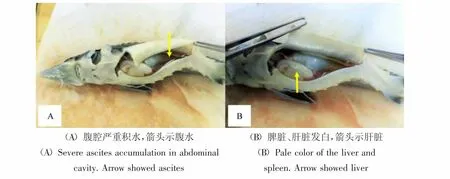
图1 患病杂交鲟腹腔积水及实质器官大体病变Figure 1 Ascites and gross pathology of diseased hybrid sturgeon
患病杂交鲟主要表现为腹部膨胀。剖解后在腹部发现大量清亮腹水(见图1A);脾脏苍白,表面可见大小不一出血斑;肝脏发白(见图1B),有直径2~3 mm的出血点。消化道无食物,其他脏器眼观病变不明显。鳃丝、黏液及肠道内容物压片中未见明显寄生虫。
2.3 细菌学检测
在无菌条件下利用接种环从病鱼的脾脏、肝脏、肾脏中接种细菌至BHI培养基,15℃和25℃恒温培养1 w后,未见明显细菌生长。
2.4 病毒学检测
组织匀浆上清液,过滤除菌后接种到FHM细胞系,25℃培养7 d后,未观察到细胞病变。
2.5 组织病理学检查
经石蜡切片,H·E染色后观察发现,该病靶器官主要出现在脾脏、肝脏、头肾和体肾。此外,还可见轻微的心肌炎。肌肉、脑、眼睛、鳔等未见明显病变。
脾脏主要表现为大面积充血,出现多灶性坏死(见图2A),坏死灶内细胞破裂,细胞核裂解、胞质融合,且有许多炎性细胞分布,形成许多无结构区域(见图2B)。油镜下可见细胞中有成簇状生长的短杆状细菌(见图2C)。
肝脏主要病变为结构紊乱,肝索消失,低倍镜下可见许多区域弥漫性出血,大量红细胞散在分布(见图2D)。高倍镜下可见肝实质细胞溶解、破裂,结构消失,呈现大面积无结构区域(见图2E)。肝静脉及血窦中蓄积了大量炎性细胞。油镜下可见坏死灶细胞内有大量呈簇状分布的杆菌(见图2F)。
头肾及体肾主要表现为肾间质性肾炎。头肾组织颜色不均,大面积区域褪色(见图2J),褪色灶内有大量的炎症细胞(见图2K)。此外,体肾造血组织坏死,细胞崩解、破碎,细胞核浓缩深染,坏死组织内大量炎性细胞浸润,肾小囊及血窦扩张(见图2I)。
肠表现为肠绒毛部分坏死脱落,黏膜下层水肿,肠上皮细胞坏死脱落,固有层裸露(见图2G),毛细血管充血并可见炎性细胞浸润(见图2H)。浆膜层水肿增厚,伴有炎性浸润,油镜下固有层和黏膜下层可见少量细菌。此外,心脏表现为轻微心肌炎,心肌小部分区域存在炎性浸润现象(见图2L)
2.6 病因分析
经尸检发现,病变主要在腹腔实质器官内,以脾脏和肝脏的病变最为明显。病鱼鳃丝、黏液及肠道内容物压片中未见明显寄生虫,可排除寄生虫致病因素;采集病变器官进行病毒分离培养,未见细胞病变,可基本排除病毒性致病因素;对病鱼的各组织器官病理学分析发现,脾脏和肝脏损伤明显,油镜下可见脾脏、肝脏、肾脏和肠道有大量呈簇状生长的短杆状细菌。从细菌学角度来看,虽然BHI培养基并没有分离出病原性细菌,但组织切片的观察中,病灶中均发现大量待确定具体种类的杆状细菌。故综上检测结果,判定此次杂交鲟腹水综合征可能是由某种杆菌感染引起。
3 讨论
腹水,即腹腔内蓄积大量液体成分,它不是独立的疾病,而是伴随与诸多病因的一种病征。导致其发生的主要有以下几种病因:①心源性腹水:出现于能造成充血性心力衰竭的各种疾病,使静脉系统淤血,体腔积液;②稀血性腹水:出现于能造成血液稀薄和胶体渗透压明显降低的疾病,如慢性贫血或低蛋白血症等,使蛋白丢失过多和体液存留而致发本病;③瘀血性腹水:出现于能造成门静脉系统淤血的各种疾病,如肝硬化、肝坏死等,因静脉压升高血行受阻,毛细血管内液体渗出而发生腹水[13]。此次实验中病鱼有明显的肝脏病变、脾脏病变,轻微的心脏病变,因此肝脏出血坏死导致门脉系统高压,血液回心受阻引起的腹腔内积液可能性较大。
对于养殖鱼类腹水症的发生原因,国内外学者都进行了广泛研究。目前发现的致病因素包括细菌性因素,如气单胞菌类感染[14];病毒性因素,如鱼腹水病毒(YAV)感染[15];寄生虫因素,如吸虫纲的某些寄生虫感染[16-17]。此外,营养不良,微量元素缺乏等也可以继发腹水症状。此次实验中,运用病原菌分离培养技术虽然未能分离到目标菌株,但在组织病理学观察中,在肝脏、脾脏、肾脏、肠道等多个组织器官均发现大量细菌,可基本推测本病是一种细菌性疾病。至于未能成功分离到细菌可能原因有:其一,该细菌生长或对营养要求高或需其他特殊条件,在常规培养基上无法生长;其二,该细菌寄生于器官细胞内,不易分离培养,而本实验亦未进行组织捣碎研磨涂抹培养。
此次在杂交鲟病灶部位发现大量细长、棒杆状、胞内成簇状生长的细菌。水产上呈簇状的杆菌主要有柱状黄杆菌[18]、溶藻弧菌[19]、和副溶血弧菌[20]等几个种类。此次实验中的致病菌具体是哪种细菌有待进一步鉴定。目前,针对胞内菌感染的药物不多,可供选择的有酰胺醇类,如氟苯尼考;四环素类,如多西环素等。
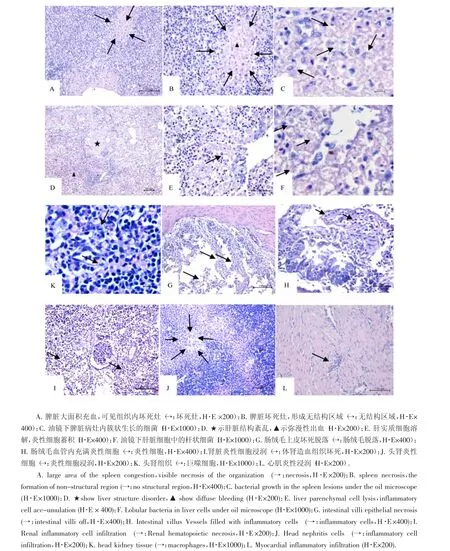
图2 患病杂交鲟组织病理学表现.Figure 2 Histopathological manifestations of diseased hybrid sturgeon
鱼类腹水症在许多疾病上均有表现,因此仅根据临床症状难以确诊,需借助其他特殊诊断法。病理学诊断方法与其他方法相比,具有切片制作简单,所需器材常见,耗时短的特点。通过显微镜观察,不仅可以直观观察到组织病变情况,快速确定被攻击的靶器官,明确机体病变情况,而且可以直接观察到细菌、寄生虫、真菌等部分病原,明确疾病种类,防止操作失误导致的误诊,弥补分离培养技术和分子生物学技术易受多种条件影响的这一不足,为下一步确诊和治疗指明方向。
参考文献:
[1]王小亮,徐立蒲,王静波,等.杂交鲟海豚链球菌的分离、鉴定及药物敏感性[J].微生物学报,2014,54(4):442-448.
[2]潘连德.养殖鲟鱼非寄生性疾病的诊断与控制[J].淡水渔业,2000,30(6):36-38.
[3]丁正峰,薛晖,边文冀,等.养殖黄颡鱼腹水症病原研究[J].华中农业大学学报,2008,27(5):639-643.
[4]孙玉华,丁军.大菱鲆工厂化养殖常见疾病防治技术[J].中国水产,2015(12):84-85.
[5]罗钦,陈玉坤,饶秋华,等.鲟鱼腹水综合症疾病诊断及防治技术[J].福建农业科技,2014,45(7):46-47.
[6]钟妮娜,汪开毓,罗碧平,等.斑点叉尾鮰“腹水症”病原分离及免疫研究[J].中国兽医杂志,2002,38(9):40-41.
[7]张传亮.拟态弧菌外毒素的检测及中草药抑菌抗毒素活性的研究[D].合肥:安徽农业大学,2007.
[8]钟妮娜,汪开毓,罗碧平,等.斑点叉尾鮰疑似疱疹病毒感染的病理形态学观察[J].中国兽医杂志,2002,38(9):40-41.
[9]战文斌.水产动物病害学[M].北京:中国农业大学出版社,2004.
[10]PATRICK T K W.鲑鱼隐鞭虫病及其防治策略[J].动物学报:英文版,2005,51(4):546-549.
[11]汪开毓,周震,耿毅.鲤维生素E缺乏的病理学研究[J].水生生物学报,2007,31(3):354-362.
[12]陈杖榴.兽医药理学[M].北京:中国农业大学出版社,1980.
[13]王建华.兽医内科学[M].北京:中国农业出版社,2010:89-90.
[14]孙其焕,孙佩芳,金丽华,等.异育银鲫溶血性腹水病病原的研究[J].水产学报,1991,15(2):130-139.
[15]ISSHIKI T,KUSUDA R.Susceptibility of different marine fish fing-erlings to yellowtail ascites virus(YAV[)J].Fish Pathology,2009,22(4):191-194.
[16]蔡茹,李朝品,王健,等.淮南地区淡水鱼感染华支睾吸虫囊蚴的调查[J].中国寄生虫学与寄生虫病杂志,2005,23(1):46-47.
[17]宋学宏,李义,杨彩根,等.苏州地区野生黄颡鱼寄生虫多样性及其寄生特性[J].动物学杂志,2004,39(1):80-84.
[18]夏文静,姜中玉,张玉千,等.黄杆菌胞内酶提取和快速转化甜菊糖为甜茶甙的方法[P].发明专利,CN102061324 A.2011.
[19]林桂芳,陈文博,苏永全,等.γ-干扰素对溶藻弧菌(Vibrio alginolyticus)在青石斑鱼(Epinephelus awoara)巨噬细胞胞内存活的影响[J].海洋与湖沼,2013,44(5):1241-1248.
[20]陈珍.副溶血弧菌胞内存活相关基因功能研究[D].厦门:集美大学,2012.
